Study on antioxidation, animal experiments of hyperglycemia and hyperlipemia of agaropectin from Gracilaria lemaneiformis
-
摘要:
为探讨硫琼脂降血糖、降血脂活性及其体外抗氧化作用,文章通过对超氧阴离子(·O2-)、羟基自由基(·OH)及1, 1-二苯基-2-三硝基苯肼(DPPH)清除效果的研究评价了硫琼脂的体外抗氧化活性;建立四氧嘧啶高血糖小鼠模型和高脂饲料高血脂大鼠模型,给予不同剂量的硫琼脂设计动物试验,以测定的小鼠空腹血糖值、大鼠血脂水平[胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]以及血清、肝脏的生化指标值研究硫琼脂的降血糖、降血脂活性。结果表明,硫琼脂具有良好的抗氧化作用,尤其对·OH的清除效果最好;能显著降低高血糖小鼠的空腹血糖值及高血脂大鼠的TC、TG、LDL-C浓度,提高HDL-C浓度,具有降血糖、降血脂活性。
Abstract:This paper aims at investigating the role agaropectin plays in hyperglycemia, hyperlipemia and antioxidation. We studied the cleaning effect of·O2-, ·OH and DPPH, based on which vitro antioxidation was assessed. We also researched hyperglycemia and hyperlipidemia by making use of alloxan to build diabetic model, and hyperlipidemia fodder to build hyperlipemia model, and conducted animal experiments with different doses of agaropectin so as to assay fasting blood glucose, rat′s blood fats (TC, TG, HDL-C and LDL-C), as well as biochemical indexes of serums and livers. The study of vitro antioxidation reveals that agaropectin has antioxidant effect, functioning especially well on scavenging·OH. Animal experiments show that agaropectin can significantly reduce fasting plasma glucose value in hyperglycemia mice, and decrease the content of TC, TG and LDL-C contained in hyperlipidemia rats, which indicates that agaropectin really has an effect on hyperglycemia and hyperlipemia.
-
Keywords:
- agaropectin /
- antioxidant ability /
- hyperglycemia /
- hyperlipemia
-
亚甲基蓝(methylene blue,MB)又名次甲基蓝、碱性湖蓝、美蓝,是一种人工合成的噻嗪类染料,具有抗菌和消毒的作用,可用于治疗淡水鱼类的小爪虫病、斜管虫病、水霉病和凡纳滨对虾(Penaeus vannamei)幼体粘脏病,也可用作抗真菌药物 [1-3],降低鱼类运输中的死亡率。由于亚甲基蓝及其代谢物被认为对动物体有毒性并有致突变作用[4-8],在美国、日本等国家禁止用于水产养殖,在国内也未被批准使用。
亚甲基蓝及其代谢物残留的检测方法有分光光度法[9]、毛细管电泳法[10]、液相色谱法等[11-13],其中对水产品中的残留检测方法国外研究较少,国内主要是液相色谱法。超高效液相色谱串联质谱方法,可以实现同时对水产品中几种有害物质进行定性并定量检测,具有检测限低、准确度高的优点[14],是近年来食品中有害物质残留检测的发展趋势[15-17],笔者在已有研究的基础上[10-11],建立了使用超高效液相色谱-电喷雾串联质谱仪同时测定水产品中亚甲基蓝及其3种代谢产物——天青A、天青B、天青C含量的方法,具有实际意义和推广前景。
1. 材料与方法
1.1 试验材料
试验用草鱼(Ctenopharyngodon idellus)6尾,体长(60±2)cm,每尾体质量为(2.5±0.3)kg,去鳞、去皮,沿脊背取肌肉;凡纳滨对虾200尾,体长(10±1)cm,每尾体质量为(10±1.2)g,去头、去壳、去肠腺,取肌肉部分;中华绒鳌蟹(Eriocheir sinensis)50只,每只体质量为(100±7.5)g,取可食部分。样品充分绞碎、混匀,于-20 ℃冷冻保藏。试验所用水产品均购自南京市迎宾菜市场。
混合型阳离子交换柱(MCX)、C8/SCX混合模式柱(MCAX)、C18柱(C18)、对丙磺酸柱(PRS)(美国Agilent公司出品),规格均为500 mg/3 mL。
1.2 仪器
Accela超高效液相色谱、TSQ Quantum Access Max三重四级杆质谱仪(美国Thermo Fisher公司出品)、Allegra 64R高速冷冻离心机(美国Beckman公司出品)、Caliper Turbovap LV全自动浓缩工作站(美国Zymark公司出品)、12通道自动固相萃取装置(德国CNW公司出品)、十万分之一电子天平(德国Sartorius公司出品)、Milli-Q去离子水发生器(美国Millipore公司出品)。
1.3 试剂
亚甲基蓝、天青A和天青C购自美国Fluka公司,纯度均大于95%;天青B购自美国Sigma公司,纯度为89%。甲醇、乙腈、二氯甲烷、甲酸、乙酸铵均为色谱纯试剂(美国TEDIA公司出品),盐酸羟胺、对甲苯磺酸均为分析纯试剂。
1.4 样品前处理方法
称取5.00 g样品,其中中华绒螯蟹样品2.00 g,于50 mL离心管中分别加入0.5 g·mL-1的盐酸羟胺溶液0.75 mL、2 mol·L-1的对甲苯磺酸溶液1.25 mL、pH 4.5 0.1 mol·L-1的乙酸铵缓冲液5 mL,涡旋1 min;再加入10 mL乙腈涡旋1 min,8 000 r·min-1离心10 min,上清液倒入125 mL分液漏斗中;再用10 mL乙腈重复提取2次;加入25 mL二氯甲烷振荡萃取,静置1 h后取下层溶液用45 ℃氮气吹至近干。用3 mL乙腈溶解残渣,上样于用3 mL乙腈活化好的PRS柱,再用乙腈重复溶解残渣2次,待样液流尽后将柱子吹至近干,用3 mL洗脱液[V(乙酸铵,1 mol·L-1) : V(乙腈) =1 : 1]洗脱,洗脱液收集于10 mL玻璃试管中,用蒸馏水稀释到10 mL。涡旋混匀后过0.22 μm尼龙滤膜供质谱检测。
1.5 色谱条件
色谱柱为Thermo Hypersil Gold C18柱,50 mm×2.1 mm(内径),粒度1.9 μm;柱温为30 ℃;进样体积10 μL;流动相为甲醇+0.2%甲酸溶液,采用梯度洗脱的方法,梯度洗脱程序见表 1。
表 1 流动相梯度洗脱程序Table 1. Gradient elution with mobile phasest/min 0.2%甲酸(A)
0.2% methanoic acid甲醇(B)
methanol0.0 90 10 1.0 90 10 5.0 10 90 5.1 90 10 9.0 90 10 1.6 质谱条件
电喷雾离子源(ESI),正离子模式,喷雾电压3 000 V,蒸发器温度300 ℃,鞘气为10.5 L·min-1,辅助气3 L·min-1,毛细管温度270 ℃,碰撞气为氩气(0.2 Pa),选择反应监测(SRM)扫描模式。SRM模式各离子信息详见表 2。
表 2 亚甲基蓝及代谢物的定性定量特征离子及优化的质谱参数Table 2. Qualitative and quantitative characteristic ions and optimized MS/MS parameters of methylene blue and metabolites标准物
compounds母离子/(m/z)
mother ion子离子/(m/z)
daughter ion碰撞能量/V
collision energy亚甲基蓝 MB 284 268.2* 33 252.1 52 天青A AzuA 256 214.2* 33 199.1 42 天青B AzuB 270 254.1* 35 255.2 28 天青C AzuC 242 200.1* 34 227.2 27 注:*.定量离子
Note: *.MS/MS quantitative ion2. 结果与讨论
2.1 条件优化研究
2.1.1 提取溶液的选择
提取时体系中加入适量浓度的盐酸羟胺溶液可维持还原环境[15],使亚甲基蓝及其代谢物结构保持稳定;同时,对甲苯磺酸作为离子对试剂,可与离子型化合物结合成为分子型物质[15],更有利于亚甲基蓝及其代谢物的提取。向空白阴性草鱼样品中添加200 μL质量浓度为100 μg·L-1的4种混和标准溶液,涡旋混匀,放置30 min后分别使用3.0、4.5、5.5、7.0、10.0等5个不同pH的乙酸铵缓冲液提取,每组4个平行,分别测定每次提取所得亚甲基蓝及其代谢物的回收率,采用pH 4.5的乙酸铵缓冲液提取时亚甲基蓝及其代谢物回收率最高(表 3)。
表 3 不同pH值的提取液提取时亚甲基蓝及代谢物的回收率Table 3. Recovery of methylene blue and metabolites extracting in different pH level% 目标物质
target compoundpH 3.0 4.5 5.5 7.0 10.0 亚甲基蓝 MB 80.63 87.38 78.69 73.94 68.13 天青A AzuA 76.32 91.58 83.12 68.35 70.33 天青B AzuB 79.36 90.19 80.39 48.10 77.31 天青C AzuC 78.98 86.71 81.55 57.31 68.96 2.1.2 提取次数的选择
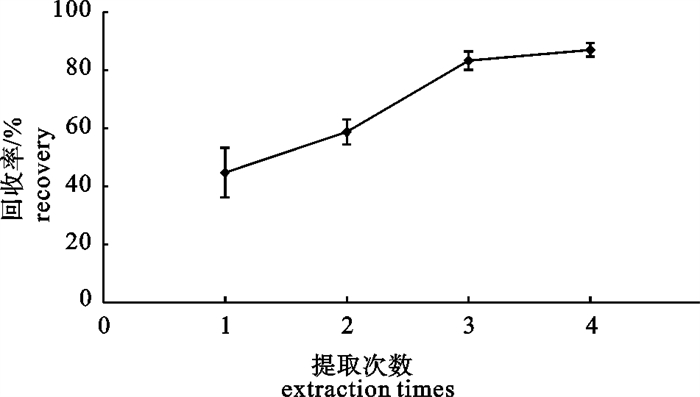
分别使用10 mL的乙腈提取1、2、3、4次,每次4个平行样品,分别测定提取所得亚甲基蓝及其代谢物的回收率,提取1次时亚甲基蓝及其代谢物回收率仅有50%左右,随着提取次数的增多、亚甲基蓝及其代谢物的回收率提高,提取3次和4次的差别不大(图 1),但综合考虑检测成本和时效性,最终选用提取3次。
2.1.3 SPE净化小柱的选择
在试管中将200 μL 100 μg·L-1的标准溶液用乙腈稀释到3 mL,加到活化好的对丙磺酸小柱(PRS)、混合型阳离子交换小柱(MCX)、C8/SCX混合模式小柱(MCAX)、C18小柱(C18)4种固相萃取柱上,用3 mL乙腈重复洗涤试管2次,用体积分数为50%的乙酸铵(1 mol·L-1)乙腈洗脱,每组4个平行,考察了不同SPE小柱对亚甲基蓝及其代谢物提取效率的影响。表 4显示MCX过柱速度太快,难以控制流速,目标物损失严重,亚甲基蓝及其代谢物回收率不到40%;C18柱净化效果不理想,过柱后仍有许多杂质;MCAX和PRS柱对目标物质回收率相似,但PRS柱萃取过程中样液流速适中,更易于控制,且加标回收率更稳定,所以采用PRS柱。
表 4 不同的净化小柱对亚甲基蓝及代谢物回收率的影响Table 4. Recovery of methylene blue and metabolites under different solid phase extraction columns% 目标物质
target compounds丙磺酸小柱
PRS column混合型阳离子交换小柱
MCX columnC8/SCX混合模式小柱
MCAX columnC18小柱
C18 column亚甲基蓝 MB 93.2 36.8 90.1 68.3 天青A AzuA 90.3 35.1 80.3 59.2 天青B AzuB 89.2 30.5 87.5 70.5 天青C AzuC 87.1 33.7 79.2 66.9 2.1.4 洗脱剂的选择
在试管中将200 μL 100 μg·L-1的标准溶液用乙腈稀释到3 mL,加到活化好的对丙磺酸小柱(PRS)上,用3 mL乙腈重复洗涤试管2次,分别用甲醇、乙腈、体积分数为50%的乙酸铵(1 mol·L-1)乙腈、体积分数为50%的乙酸铵(1 mol·L-1)甲醇洗脱。结果显示,纯的有机溶剂如甲醇、乙腈等不能将目标物洗脱下来,乙酸铵和甲醇混合液洗脱时仅有部分洗脱下来;采用乙酸铵和乙腈等体积混合洗脱效率明显增强,目标物质峰型良好。此外,试验还考察了采用不同浓度的乙酸铵溶液洗脱对亚甲基蓝及其代谢物回收率的影响(表 5)。结果表明,采用浓度为1 mol·L-1的乙酸铵溶液和等体积的乙腈混和时,亚甲基蓝及其代谢物回收率最高。将洗脱后的溶液稀释到10 mL再进样,使样品中的盐浓度降低,可起到保护质谱仪的作用。
表 5 不同浓度的乙酸铵乙腈洗脱时亚甲基蓝及代谢物的回收率Table 5. Recovery of methylene blue and metabolites with different concentration of eluents% 目标物质
target compoundsc(乙酸铵)/ mol·L-1
ammonium acetate content0.1 0.5 1.0 亚甲基蓝 MB 40.38 73.94 98.13 天青A AzuA 31.58 68.35 95.33 天青B AzuB 30.19 68.10 97.31 天青C AzuC 36.71 87.31 95.96 2.1.5 色谱条件的优化及选择
此试验分别采用5 mmol·L-1乙酸铵-甲醇、5 mmol·L-1乙酸铵-乙腈、0.2%甲酸-甲醇、0.2%甲酸-乙腈4种流动相试验。结果表明,采用0.2%甲酸溶液和甲醇作为流动相时亚甲基蓝及其代谢物峰型最好。甲酸溶液与甲醇的比例不同,对亚甲基蓝及代谢物出峰时间和强度存在明显差异。当流动相中甲醇比例较高时,亚甲基蓝及其代谢物在色谱柱上的保留时间短,峰形也较差;随着甲酸溶液比例增高,亚甲基蓝及其代谢物的出峰时间推迟,且峰形变好。最后形成的梯度洗脱程序见表 1。
2.1.6 质谱条件的优化及确定
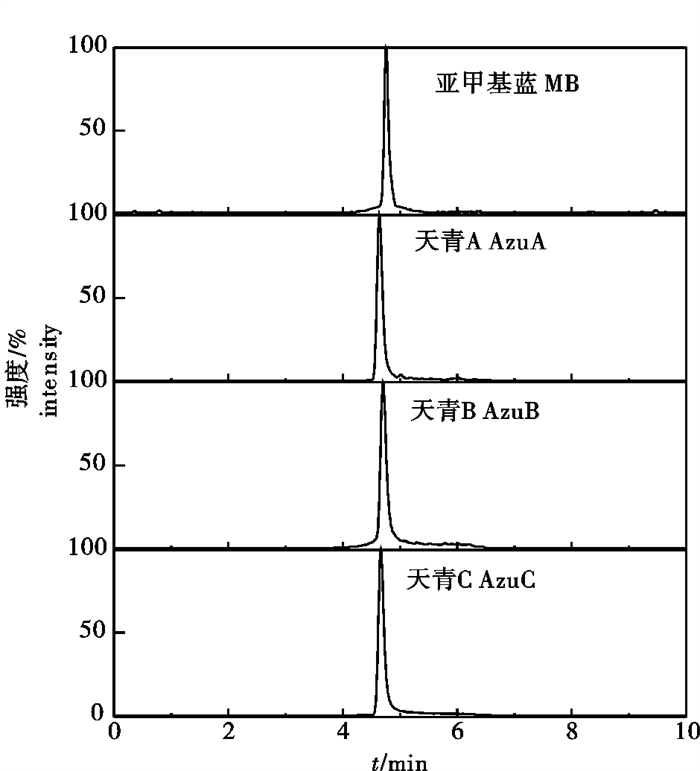
取质量浓度为10 mg·L-1的亚甲基蓝及天青标准品用质谱仪检测,采用注射泵以5 μL·min-1的速度进样,调节毛细管电压和碰撞电压,探索亚甲基蓝及代谢物标准品最佳质谱条件。根据亚甲基蓝及天青的结构特征选择正离子模式,优化喷雾电压、辅助气和鞘气等质谱参数,获得亚甲基蓝和天青稳定的分子离子峰,然后以氩气为碰撞气,获得碎片离子的质谱信息,并进一步优化碰撞能量、毛细管温度和蒸发器温度等质谱参数,使碎片离子信号强度达到最大。最后选择相对丰度最高2个离子作为定量和定性离子,第一强的碎片离子作为定量离子,次强的作为定性离子。亚甲基蓝及代谢物的定性与定量特征离子及优化的质谱参数见表 2。优化条件下各种目标物的SRM图见图 2。
2.2 方法学研究
2.2.1 方法的线性范围、检出限、定量限
准确称取4种标准品各5.0 mg,分别以甲醇溶解并定容至100 mL,其质量浓度均为50 mg·L-1的单标储备液。采用逐级稀释的方式,配制成质量浓度为0.50 μg·L-1、2.00 μg·L-1、5.00 μg·L-1、10.00 μg·L-1、50.00 μg·L-1、100.00 μg·L-1的混合标准工作液,按照质量浓度由低到高进样,对各目标物峰面积及其质量浓度进行线性回归分析,得到亚甲基蓝及其代谢物的标样工作曲线。结果表明,4种目标物在0.50~100.00 μg·L-1范围内呈良好的线性关系,相关系数R>0.99。检出限(LOD)采用向空白样品中逐级降低加标浓度的方法来确定,以大于等于3倍信噪比(S/N≥3)对应的目标物浓度为检出限,以S/N≥10对应的浓度为定量限(表 6)。
表 6 0.50~100.00μg·L-1范围内亚甲基蓝及其代谢物的线性关系及相关系数Table 6. Linear relationship and correlation coefficient of methylene blue and metabolites within scope 0.50~100.00 μg·L-1物质
compound线性方程
linear relationship相关系数
R检出限/μg·kg-1
LOD定量限/μg·kg-1
LOQ亚甲基蓝 MB y=45 254x+140 368 0.997 9 0.40 2.00 天青A AzuA y=3 308.3x+16 774 0.995 9 0.60 2.00 天青B AzuB y=49 098x+167 560 0.998 0 0.50 2.00 天青C AzuC y=13 223x+30 124 0.995 3 0.40 2.00 注:y.亚甲基蓝及其代谢物的定量离子的质谱峰面积;x.亚甲基蓝及其代谢物的质量浓度(μg·L-1)
Note: y. mass spectra peak area of methylene blue and metabolites; x. content of methylene blue and metabolites(μg·L-1)2.2.2 样品加标的回收率和精密度
选取空白草鱼、凡纳滨对虾和中华绒螯蟹3种类型的水产品,分别添加2 μg·kg-1、4 μg·kg-1、10 μg·kg-13个水平的亚甲基蓝及其代谢物标准品,按1.4、1.5、1.6所述方法进行加标回收率测定,每个加标水平平行测定6次,计算平均回收率和相对标准偏差。4种目标物的加标回收率为74.23%~94.40%,在各个加标水平下加标回收率比较稳定,相对标准偏差(RSD)为1.13%~10.28%(表 7~表 9),可满足水产品中亚甲基蓝及代谢物残留的检测要求。
表 7 空白草鱼肉样中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 7. Recovery and precision of methylene blue and azures of blank Ctenoparyngodon idellus samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 83.10 1.13 4 81.59 4.09 10 88.35 3.97 天青A AzuA 2 85.47 9.41 4 81.75 5.03 10 87.68 9.76 天青B AzuB 2 82.94 2.53 4 89.65 5.83 10 88.56 8.03 天青C AzuC 2 87.91 9.72 4 90.69 3.61 10 92.60 5.98 表 8 空白凡纳滨对虾样品中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 8. Recovery and precision of methylene blue and azures of blank Penaeus vannamei samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 87.94 5.46 4 89.42 4.91 10 80.80 1.46 天青A AzuA 2 78.11 8.97 4 84.86 9.81 10 82.20 6.06 天青B AzuB 2 80.01 5.53 4 83.62 8.58 10 90.83 5.24 天青C AzuC 2 91.49 8.69 4 94.40 5.21 10 92.86 4.10 表 9 空白中华绒螯蟹样品中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 9. Recovery and precision of methylene blue and azures of blank Eriocheir sinensis samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 81.85 5.42 4 80.35 6.22 10 81.68 4.20 天青A AzuA 2 74.54 8.75 4 81.05 8.25 10 90.42 9.74 天青B AzuB 2 74.23 6.83 4 85.24 7.84 10 87.05 10.28 天青C AzuC 2 86.69 2.59 4 86.21 6.50 10 88.50 4.24 3. 结论
建立了超高效液相色谱-串联质谱法分析水产品中亚甲基蓝及其代谢物残留量的方法。样品用乙腈提取,经PRS柱固相萃取,乙酸铵乙腈洗脱,以甲醇和0.2%甲酸为流动相进行梯度洗脱分离,质谱条件采用电喷雾离子源(ESI),正离子模式,选择反应监测(SRM)的扫描模式定量分析。该方法准确度高、实用性强、简便易行,能满足实际样品中亚甲基蓝及其代谢物的检测要求,也可作为亚甲基蓝其他方面研究的参考方法。
-
表 1 降血糖动物试验设计
Table 1 Design of hypoglycemic animal experiment
组别 group 药品 pharmaceutical 剂量/mg·kg-1 dose 高血糖模型组 diabetic model (DM) 蒸馏水 - 药物对照组 drug control (DC) 格列吡嗪 5 正常对照组 normal control (NC) 蒸馏水 - 硫琼脂低剂量组 agaropectin low-dose (SPS-L) 硫琼脂 200 硫琼脂中剂量组 agaropectin mediu-dose (SPS-M) 硫琼脂 500 硫琼脂高剂量组 agaropectin high-dose (SPS-H) 硫琼脂 800 表 2 降血脂动物试验设计
Table 2 Design of hypolipidemic animal experiment
组别
group喂养饲料
feed灌胃药物
pharmaceutical剂量/g·kg-1
dose正常对照组 normal control (NC) 普通饲料 蒸馏水 - 正常硫琼脂组 normal control-agaropectin (NC-S) 普通饲料 硫琼脂 0.80 高脂模型对照组 hyperlipidemia model (HL) 高脂饲料 蒸馏水 - 药物对照组 drug control (DC) 高脂饲料 辛伐他汀 0.01 硫琼脂低剂量组 agaropectin low-dose (SPS-L) 高脂饲料 硫琼脂 0.20 硫琼脂中剂量组 agaropectin mediu-dose (SPS-M) 高脂饲料 硫琼脂 0.50 硫琼脂高剂量组 agaropectin high-dose (SPS-H) 高脂饲料 硫琼脂 0.80 表 3 硫琼脂对小鼠体质量的影响(X ±SD)
Table 3 Effect of agaropectin on weight in mice
组别
group体质量/g body weight 增加量/g
weight growth增重率/%
rate of weight growth0 d 7 d 14 d 21 d 28 d 高血糖模型组(DM) 24.6±2.0** 28.3±2.9** 29.6±3.5** 31.1±3.5** 30.3±3.7** 5.7ab 23.2 药物对照组(DC) 25.1±1.8** 29.1±2.4** 31.6±2.9** 32.8±3.7** 33.3±4.0** 8.2ab 32.7 正常对照组(NC) 36.9±1.9## 40.9±2.9## 43.7±3.1## 45.6±3.1## 46.2±3.0## 9.3ab 25.2 低剂量组(SPS-L) 25.4±1.9** 28.9±2.9** 31.3±3.7** 31.8±3.8** 33.0±4.2** 7.6ab 29.9 中剂量组(SPS-M) 25.1±2.2** 29.0±3.2** 30.7±3.9** 32.7±4.7** 33.2±5.2** 8.1ab 32.3 高剂量组(SPS-H) 26.0±2.7** 29.1±3.1** 32.5±4.1** 33.7±5.2** 34.7±5.8**# 8.7ab 33.5 注:与NC组比较,*. 差异显著(P < 0.05),* *. 差异极显著(P < 0.01);与DM组比较,#. 差异显著(P < 0.05),##. 差异极显著(P < 0.01);各组内比较,aa. 差异显著(P < 0.05),ab. 差异极显著(P < 0.01);后表同此
Note:Compared with NC group,*. significant difference (P < 0.05),* *. very significant difference (P < 0.01);Compared with DM group,#. significant difference (P < 0.05),##. very significant difference (P < 0.01);Compare between all groups,aa. significant difference (P < 0.05),ab. very significant difference (P < 0.01);the same case in the following tables.表 4 硫琼脂对小鼠降血糖效果的影响(X ±SD)
Table 4 Effect of agaropectin on lowering blood-glucose in mice
mmol·L-1 组别
group0 d 7 d 14 d 21 d 28 d 变化值
difference value高血糖模型组(DM) 20.3±5.2** 22.2±4.3** 23.5±5.1** 25.6±2.2** 26.5±4.0** 6.2ab 药物对照组(DC) 20.2±4.6** 17.3±3.6**# 15.8±4.5**## 13.5±3.1**## 11.7±5.3**## 8.5aa 正常对照组(NC) 6.7±1.2## 8.0±1.3## 7.3±1.1## 8.0±1.5## 7.0±1.4## 0.3 低剂量组(SPS-L) 20.3±3.9** 19.1±2.7** 18.4±4.3**# 17.5±3.7**## 16.1±4.5**## 4.2 中剂量组(SPS-M) 20.5±4.1** 18.9±3.2** 17.5±3.6**# 16.1±2.8**## 14.3±3.5**## 6.2ab 高剂量组(SPS-H) 20.6±4.8** 18.2±3.5** 16.5±3.2**## 14.8±4.9**## 13.2±2.3**## 7.4aa 表 5 硫琼脂对小鼠负荷糖耐量的影响(X ±SD)
Table 5 Effect of agaropectin on load glucose tolerance in mice
mmol·L-1 组别 group 0 h 0.5 h 2 h 高血糖模型组(DM) 30.3±3.3* 33.3±3.7 33.1±2.8*aa 药物对照组(DC) 22.1±4.7## 32.4±4.2 24.7±2.6# 正常对照组(NC) 8.4±1.6**## 12.5±1.8**## 6.2±1.7**## 低剂量组(SPS-L) 24.1±3.8# 30.8±2.6 26.1±3.0 中剂量组(SPS-M) 22.6±4.3# 33.3±3.3 24.6±2.6# 高剂量组(SPS-H) 20.6±3.5## 31.9±2.7 23.1±3.2## 注:与DC组比较
Note:Compared with DC group.表 6 硫琼脂对小鼠脏器指数的影响(X ±SD)
Table 6 Effect of agaropectin on index of spleen, thymus and liver of diabetic mice
g 组别
group肝脏指数
liver index脾脏指数
spleen index胸腺指数
thymus index高血糖模型组(DM) 0.052 8±0.003 0* 0.002 3±0.000 3** 0.001 2±0.000 3* 药物对照组(DC) 0.044 6±0.002 5# 0.003 9±0.000 3## 0.001 8±0.000 2 正常对照组(NC) 0.043 3±0.002 3# 0.004 2±0.000 4## 0.002 1±0.000 2# 低剂量组(SPS-L) 0.050 6±0.004 9 0.003 6±0.001 1# 0.001 5±0.000 2 中剂量组(SPS-M) 0.048 7±0.004 2 0.003 7±0.000 5# 0.001 7±0.000 2 高剂量组(SPS-H) 0.044 2±0.003 9# 0.003 9±0.000 7## 0.001 8±0.000 3 表 7 血清各项指标测定结果(X ±SD)
Table 7 Measurements of GSP, liver glycogen and insulin in serum
组别group c(糖化血清蛋白)/mmol·L-1
glutathion peroxidase (GSP)w(肝糖原)/mg·g-1
hepatic glycogen血清胰岛素/mIU·L-1
serum insulin高血糖模型组(DM) 5.88±0.60* 0.81±0.56* 5.89±1.17** 药物对照组(DC) 4.50±0.37## 1.76±0.68## 4.68±0.62## 正常对照组(NC) 4.85±0.34# 2.26±0.14# 4.41±0.93## 低剂量组(SPS-L) 5.20±1.81 0.85±0.16 4.89±0.88# 中剂量组(SPS-M) 5.04±1.24 1.36±0.17 4.78±1.62## 高剂量组(SPS-H) 4.82±0.64## 2.04±0.45## 4.69±0.98## 表 8 硫琼脂对大鼠胆固醇、甘油三酯的影响(X ±SD)
Table 8 Effect of agaropectin on TC and TG in rats
mmol·L-1 组别
group胆固醇 total cholesterol (TC) 甘油三酯 triglyceride (TG) 0 d 28 d 0 d 28 d 正常对照组(NC) 2.65±0.10# 2.20±0.32##aa 1.14±0.10## 1.31±0.29## 正常硫琼脂组(NC-S) 2.30±0.22## 2.28±0.24## 1.18±0.41## 1.34±0.55## 高血脂模型组(HL) 3.35±0.36* 3.85±0.21**aa 2.60±0.41** 2.81±0.33** 药物对照组(DC) 3.55±0.42** 2.06±0.17##ab 2.31±0.53** 1.07±0.25*##ab 低剂量组(SPS-L) 3.36±0.34* 2.12±0.10##ab 2.4±0.67** 1.13±0.24##ab 中剂量组(SPS-M) 3.41±0.45** 1.99±0.23##ab 2.51±0.49** 1.23±0.21##ab 高剂量组(SPS-H) 3.58±0.50** 1.82±0.20**##ab 2.64±0.82** 1.24±0.11##ab 注:与HL组比较
Note:Compared with HL group.表 9 硫琼脂对大鼠高密度脂蛋白胆固醇、低密度脂蛋白胆固醇的影响(X ±SD)
Table 9 Effect of agaropectin on HDL-C and LDL-C in rats
mmol·L-1 组别
group高密度脂蛋白胆固醇
high-density lipoprotein (HDL-C)低密度脂蛋白胆固醇
low density lipoprotein (LDL-C)0 d 28 d 0 d 28 d 正常对照组(NC) 2.45±0.39## 2.54±0.29## 1.07±0.19## 1.15±0.37## 正常硫琼脂组(NC-S) 2.52±0.07## 2.36±0.23## 1.16±0.15 1.32±0.19## 高血脂模型组(HL) 1.37±0.70** 0.95±0.16** 1.79±0.65** 2.38±0.35**ab 药物对照组(DC) 1.55±0.45** 2.16±0.18*##ab 1.95±0.70** 1.13±0.20##ab 低剂量组(SPS-L) 1.58±0.31** 2.05±0.19**##ab 1.84±0.56** 1.24±0.13##ab 中剂量组(SPS-M) 1.37±0.45** 2.11±0.16*##ab 1.95±0.71** 1.19±0.18##ab 高剂量组(SPS-H) 1.26±0.19** 2.19±0.23*##ab 1.96±0.45** 1.15±0.16##ab 表 10 硫琼脂对大鼠体质量的影响(X ±SD)
Table 10 Effect of agaropectin on weight in rats
组别
group体质量/g body weight 增加量/g
weight growth增重率/%
rate of weight growth0 d 7 d 14 d 21 d 28 d 正常对照组(NC) 198.9±14.2 252.5±15.6 282.4±19.1 302.6±25.4 315.1±34.2 116.2ab 58.4 正常硫琼脂组(NC-S) 201.6±14.8* 240.4±15.9 275.4±16.1 294.5±16.2 313.7±16.3 112.1ab 55.6 高血脂模型组(HL) 195.1±13.8 249.0±17.6 275.4±19.1 294.9±27.6 316.9±31.6 121.8ab 62.4 药物对照组(DC) 196.5±11.4 242.3±17.7 263.1±19.6 281.2±21.8 294.9±18.9 98.4ab 50.1 低剂量组(SPS-L) 186.3±12.6 231.7±15.5 249.0±22.0*# 271.7±22.1*# 288.4±26.7*# 102.1ab 54.8 中剂量组(SPS-M) 189.8±10.8 239.6±12.8 258.0±21.7 273.5±28.6*# 287.3±35.4*# 97.5ab 51.4 高剂量组(SPS-H) 186.6±20.2 233.8±22.0 252.6±23.1* 266.6±24.3*# 285.3±24.6*# 98.7ab 52.9 表 11 肝脏抗氧化指标及肝脏指数测定结果(X ±SD)
Table 11 Measurements of agaropectin on index of GSH-Px, T-SOD, NO and MDA in liver
组别
group肝脏指数/g
liver index谷胱甘肽过氧化物酶/活力单位
GSH-Px超氧化物歧化酶/U·mg-1 prot
T-SODb(一氧化氮) /μmol·g-1
NOb(丙二醛) /nmol·mg-1
MDA正常对照组(NC) 0.027 8±0.001 8## 258.21±20.92## 60.96±13.00## 1.59±0.80## 5.83±2.15## 正常硫琼脂组(NC-S) 0.026 9±0.001 5## 313.88±17.64*## 72.07±5.26*## 1.32±0.60## 4.29±1.39## 高血脂模型组(HL) 0.035 7±0.001 6** 150.57±41.82** 41.69±4.61** 4.54±1.95** 14.81±1.41** 药物对照组(DC) 0.028 6±0.001 9## 245.99±41.42## 56.98±3.70## 2.02±1.69## 10.05±1.73**## 低剂量组(SPS-L) 0.031 1±0.001 4*## 239.84±42.47## 54.48±6.57# 3.08±1.91**## 12.96±1.42**# 中剂量组(SPS-M) 0.030 2±0.002 6## 258.32±27.74## 55.81±12.51# 2.53±1.90## 11.87±1.35**## 高剂量组(SPS-H) 0.028 9±0.001 9## 271.08±25.07## 56.81±7.35## 1.65±0.51## 10.91±0.89**## 表 12 硫琼脂对高血脂大鼠血清抗氧化能力的影响(X ±SD)
Table 12 Measurements of agaropectin on index of GSH-Px, T-SOD, NO and MDA in serum
组别
group谷胱甘肽过氧化物酶/活力单位
GSH-Px超氧化物歧化酶/U·mg-1 prot
T-SODb(一氧化氮) /μmol·g-1
NOb(丙二醛) /nmol·mg-1
MDA正常对照组(NC) 1 935.2±90.7**## 711.6±67.7## 15.54±2.76# 8.40±2.61## 正常硫琼脂组(NC-S) 2 024.8±120.4**## 729.4±107.8## 15.87±2.60# 8.09±1.45## 高血脂模型组(HL) 958.4±169.0* 563.4±33.3** 25.96±2.27* 11.47±2.10** 药物对照组(DC) 1 170.4±289.2# 780.4±64.2## 16.03±1.69# 8.52±1.01## 低剂量组(SPS-L) 997.6±129.7 764.6±51.0## 19.07±1.91 9.84±0.82*## 中剂量组(SPS-M) 1 182.4±105.6# 793.0±83.8## 18.27±1.90## 9.02±1.39## 高剂量组(SPS-H) 1 303.2±225.7## 798.8±61.1## 16.67±2.51## 8.10±0.99## 注:与DC组比较
Note:Compared with DC group. -
[1] 刘秋凤, 吴成业. 硫酸酯多糖的生物活性及其提取方法[J]. 福建水产, 2012, 34(3): 240-244. doi: 10.3969/j.issn.1006-5601.2012.03.013 [2] 张彦民, 李宝才, 朱利平, 等. 多糖化学及其生物活性研究进展[J]. 昆明理工大学学报: 理工版, 2003, 28(3): 140-145. doi: 10.3969/j.issn.1007-855X.2003.03.035 [3] 刘力. 琼脂分级产物的研究[D]. 青岛: 中国科学院海洋研究所, 2001. http://cdmd.cnki.com.cn/Article/CDMD-80068-2001002949.htm [4] 赵永强. 龙须菜琼胶糖的制备及其副产物的研究[D]. 湛江: 广东海洋大学, 2010. 10.7666/d.y1806091 [5] KIHO T, MORIMOTO H, KOBAYASHI T, et al. Effect of a polysaccharide (TAP) from the fruiting bodies of Tremlla auranitia on glucose metabolism in mouse liver[J]. Biomchnol Biochem, 2000, 64(2): 417. doi: 10.1271/bbb.64.417
[6] 谌素华, 王维民, 刘辉, 等. 马尾藻岩藻聚糖硫酸酯纯化及降血脂功能研究[J]. 食品与发酵工业, 2010, 36 (5): 28-31. https://d.wanfangdata.com.cn/periodical/spyfx201005007 [7] 王兵, 李靖, 马舒冰, 等. 羊栖菜多糖降血糖作用的实验研究[J]. 中国海洋药物, 2000, 19(3): 33. doi: 10.3969/j.issn.1002-3461.2000.03.011 [8] 刘秋凤, 苏永昌, 吴成业. 硫琼脂提取工艺的响应面法优化[J]. 福建农业学报, 2012, 27(9): 1004-1010. doi: 10.3969/j.issn.1008-0384.2012.09.019 [9] 曾小玲. 七种菊科植物抗活性氧作用的研究对超氧阴离子的自由基清除作用[J]. 中国现代医学杂志, 1999(2): 51-52. https://www.cqvip.com/QK/98531X/19992/3413386.html [10] 贾彦明, 闵伟红. 海带多糖的分离纯化及体外抗氧化作用的研究[J]. 农产品加工学刊, 2010(8): 26-35. doi: 10.3969/j.issn.1671-9646(X).2010.08.007 [11] SHAMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chem, 2009, 113(4): 1202-1205. doi: 10.1016/j.foodchem.2008.08.008
[12] 范玉生. 马齿苋多糖降血糖作用研究[D]. 杨凌: 西北农林科技大学, 2008. https://d.wanfangdata.com.cn/thesis/Y1284838 [13] SEZIK E, ASLAN M, YESILADA E, et al. Hypoglycaemic activity of Gentiana olivieri and isolation of the active constituent through bioassay-directed fractionation techniques[J]. Life Sci, 2005, 76(11): 1223-1238. doi: 10.1016/j.lfs.2004.07.024
[14] 中华人民共和国卫生部. 卫法监发[2003]42号保健食品检验与评价技术规范(2003版)[Z]. 2003: 35-42. https://www.chinafooddb.com/rsdb/detail/d0ukh38188w0 [15] 于竹芹, 刘宗宝, 龚少兰, 等. 海带对实验性高脂血症大鼠降血脂作用及其机制[J]. 青岛大学医学院学报, 2010, 46(5): 419-424. doi: 10.3969/j.issn.1672-4488.2010.05.013 [16] SHARMA S B, NASIR A, PRABHU K M, et al. Hypoglycaemic and hypolipidemic effect of ethanolic extract of seeds of Eugenia jambolana in alloxan-induced diabetic rabbits[J]. J Ethnopharmacol, 2003, 85(2/3): 201-206. doi: 10.1016/S0378-8741(02)00366-5
[17] 贾之慎, 部建敏, 唐孟成. 比色法测定Fenton反应产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(2): 184-186. https://www.pibb.ac.cn/pibbcn/article/abstract/19960224?st=article_issue [18] JEON SM, BOK S H, JANGM K, et al. Antioxidative activity of maringin and lovastain in high cholesterol-fed rabbits[J]. Life Sci, 2001, 69(24): 2855. doi: 10.1016/S0024-3205(01)01363-7
[19] MARITIM A C, SANDERS R A, WATKINS J B. Diabetes, oxidative stress and antioxidants: a review[J]. J Biochem Mol Toxicol, 2003, 17(1): 24-38. doi: 10.1002/jbt.10058
[20] 林龙, 常建波, 孙煜煊. 孔石莼多糖降血糖作用研究[J]. 食品科技, 2012, 37(6): 224-227. https://www.cqvip.com/QK/95840X/201206/42298081.html [21] 任初杰. 不同溶剂提取花生粕多糖工艺结构及抗氧化活性的研究[D]. 武汉: 华中农业大学, 2007. [23] 刘铜华, 吕仁和. 中医药防治糖尿病及其并发症的作用途径[J]. 北京中医药大学学报, 2000, 23(3): 69-71. doi: 10.3321/j.issn:1006-2157.2000.03.027 -
期刊类型引用(10)
1. 孙良娟,李红权,蔡润斌,庄姜云,唐庆强,唐媛媛,钟键,黄武. 高效液相色谱-串联质谱法测定水产品中9种禁用染料类药物残留. 分析测试学报. 2023(01): 89-95 .  百度学术
百度学术
2. 李涛,贾立平,李锋刚,王绿洲. 亚甲基蓝在鲤体内消除规律研究. 水产科技情报. 2022(02): 99-105 .  百度学术
百度学术
3. 黄宣运,杨光昕,孔聪,黄冬梅,蔡友琼. 间接竞争酶联免疫法测定鱼体中的亚甲基蓝. 食品安全质量检测学报. 2020(22): 8235-8239 .  百度学术
百度学术
4. 余玮玥,黄冬梅,史永富,孔聪,田良良,韩峰,张政权. 液相色谱-串联质谱法测定水产品中亮绿、亚甲基蓝及其代谢物残留量. 分析测试学报. 2019(01): 58-63 .  百度学术
百度学术
5. 施雅. 淡水鱼中亚甲基蓝、孔雀石绿类药物残留检测. 广州化工. 2019(14): 131-133 .  百度学术
百度学术
6. 高平,杨曦,莫彩娜,陈日檬,曾丹丹,刘唤明,洪鹏志,周凯,陈营寿. 通过式固相萃取净化/高效液相色谱-串联质谱法快速测定水产品中6种麻醉剂残留. 分析测试学报. 2019(09): 1059-1065 .  百度学术
百度学术
7. 杨卫军,张静余,严敏鸣. 亚甲基蓝检测方法及代谢动力学研究进展. 食品安全质量检测学报. 2018(10): 2419-2425 .  百度学术
百度学术
8. Jin Fan,Zhi-Hai Xie,Xiao-Xiao Teng,Yu Zhang. Determination of methylene blue by resonance light scattering method using silica nanoparticles as probe. Chinese Chemical Letters. 2017(05): 1104-1110 .  必应学术
必应学术
9. 梁楠,胡鲲,刘腾飞,吴映捷,杨先乐. 亚甲基蓝及其代谢物在异育银鲫体内分布及消除规律的研究. 南方水产科学. 2017(01): 19-25 .  本站查看
本站查看
10. 龙举,李子孟,喻亮,李佩佩,严忠雍,张小军. 高效液相色谱法测定养殖水体中的亚甲基蓝. 安徽农业科学. 2015(24): 5-6+16 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
