Optimal culture conditions and medium of Nocardia seriolea
-
摘要:
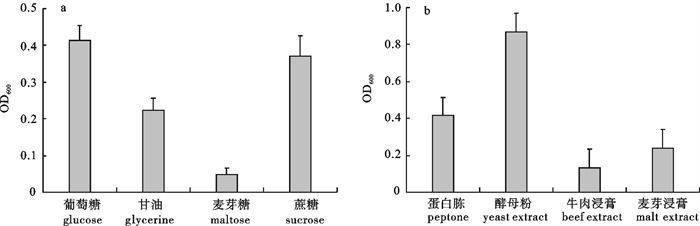
对鰤鱼诺卡氏菌(Nocardia seriolea)ZJ0503的增菌培养基和生长条件进行优化。研究了温度、盐度、初始pH对鰤鱼诺卡氏菌生长的影响,并通过单因素试验对培养基的碳源、氮源和无机盐成分进行了筛选,采用正交试验法对培养基各主要成分的添加量进行了优化。结果表明,鰤鱼诺卡氏菌最适宜生长条件为温度25 ℃、盐度5、pH 6.5±0.2;经筛选,鰤鱼诺卡氏菌培养基中最佳碳源是葡萄糖,最佳氮源是酵母粉,促生长作用最强的2种无机盐是磷酸氢二钾(K2HPO4)和氯化钙(CaCl2);确立了培养基优化配方为葡萄糖20 g·L-1,酵母粉15 g·L-1,K2HPO4 0.75 g·L-1,CaCl2 0.2 g·L-1(单独灭菌),氯化钠(NaCl)5 g·L-1,pH 6.5±0.2。
Abstract:We carried out the study to optimize the enrichment medium and culture conditions of Nocardia seriolea (ZJ0503). We studied the effects of temperature, salinity and initial pH on the growth of N.seriolea, investigated the carbon source, nitrogen source and inorganic ions of N.seriolea with single-factor experiment, and optimized different ingredients of medium with orthogonal experiment. The results indicate that the optimal growing condition of N.seriolea is temperature 25 ℃, salinity 5 and pH 6.5±0.2, the optimum carbon source is glucose, and nitrogen source yeast extract; that K2HPO4 and CaCl2 promote the growth of N.seriolea greatly. In addition, the optimum ingredients of medium are as follows: glucose 20 g·L-1, yeast extract 15 g·L-1, K2HPO4 0.75 g·L-1, CaCl2 0.2 g·L-1 (sterilized separately), and NaCl 5 g·L-1, pH 6.5±0.2.
-
Keywords:
- Nocardia seriolea /
- medium /
- culture conditions /
- optimization
-
随着近年来海洋动物养殖业的迅猛发展,加上陆源污染的持续注入,中国近海富营养化现象日益严重[1-3]。由于大型海藻能够快速吸收并移出海水中的氮(N)、磷(P)等营养物质,因此国内外学者普遍认为大型海藻的规模化栽培是延缓近海富营养化进程、修复近海生态环境的有效途径之一[4-6],而对大型海藻营养盐吸收特点和生物修复功能的研究也受到了广泛的关注[7-10]。P是海藻生长的必需元素,是核蛋白和磷脂的重要成分,同时参与海藻细胞内很多生化反应过程,具有非常重要的生理地位[11]。但是,由于海洋中存在着能够将有机磷转化为无机磷的碱性磷酸酶[12-14],因此在自然海域中P通常不被认为是海藻的生长限制因子。然而,随着近海富营养化现象的加重,N浓度的急剧升高往往使得P被动的成为海藻生长的限制因素,对大型海藻P吸收的研究也因此逐渐受到关注[7, 10, 15]。
羊栖菜(Hizikia fusiforme)是一种大型经济褐藻,在中国近海潮间带广泛分布。由于具有较高的营养和药用价值[16],人们对其的过度采集已造成当前羊栖菜自然资源的严重锐减。近年来国内学者对羊栖菜的人工繁育进行了初步的研究并取得一定的进展[17-18],其人工繁育和栽培在浙江近海形成了一定的规模,这使羊栖菜成为近海富营养化海水修复的潜在品种。文章以羊栖菜为研究材料,在实验室可控条件下探讨温度、光照和营养史等环境因子对其无机磷吸收的影响,试图为其在海水富营养化生物修复功能中的应用提供理论依据。
1. 材料与方法
1.1 材料
野生羊栖菜采自汕头南澳岛潮间带,采集时选择健康一致、体长5 cm左右的孢子体,放于4 ℃保温箱3 h内运到实验室,暂养在经高压灭菌的自然海水中备用。暂养海水pH为8.2,盐度为33,无机氮浓度为10 μmol·L-1,无机磷浓度为0.5 μmol·L-1。培养温度为20 ℃,光照强度为10 000 lx,光照周期为亮(L) ∶暗(D)=12 ∶ 12,24 h充气。
1.2 不同培养条件的设置
1.2.1 不同温度条件的设置
光照控温培养箱设置10 ℃、20 ℃和30 ℃ 3个温度梯度,不同温度下培养光照强度(photons)均为10 000 lx,培养密度(湿质量,FW)为10 g·L-1,培养海水(2 L)初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。初始N、P浓度分别通过向自然海水中添加硝酸钠(NaNO3)和磷酸二氢钠(NaH2PO4)获得。
1.2.2 不同光照强度条件的设置
光照控温培养箱设置0、1 500 lx和6 500 lx 3个光照强度梯度,不同光强下温度均为20 ℃,培养密度(FW)为10 g·L-1,培养海水(2 L)初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。初始N、P浓度分别通过向自然海水添加NaNO3和NaH2PO4获得。
1.2.3 不同营养史的获得
1) F/2加富人工海水的配制。首先在蒸馏水中溶解氯化钠(NaCl)450 mmol·L-1、氯化钾(KCl)10 mmol·L-1、氯化钙(CaCl2)10 mmol·L-1、硫酸镁(MgSO4)30 mmol·L-1、碳酸氢钠(NaHCO3)2.2 mmol·L-1,获得人工海水[19],然后参照BOROWITZKA[20]的方法进行F/2配方营养加富,其中不添加N和P,使培养水体中不缺乏其他营养元素而保证N和P浓度为零。
2) 不同P营养史的获得。健康一致的羊栖菜孢子体于0、5 μmol·L-1或50 μmol·L-13种P浓度条件下分别适应培养96 h,获得具有不同P营养史的试验材料。培养温度为20 ℃,光照强度为10 000 lx,光照周期为L ∶ D=12 ∶ 12,N浓度为200 μmol·L-1。培养密度(FW)为10 g·L-1,不间断充气,每24 h分别更换培养海水。培养海水使用如1)配制的人工海水,通过添加NaH2PO4获得不同的P浓度。
3) 不同N营养史的获得。孢子体于0、10 μmol·L-1或200 μmol·L-13种N浓度条件下分别适应培养96 h,获得具有不同N营养史的试验材料。培养温度为20 ℃,光照强度为10 000 lx,光照周期为L ∶ D=12 ∶ 12,P浓度为50 μmol· L-1。培养密度(FW)为10 g·L-1,不间断充气,每24 h分别更换培养海水。培养海水使用如1)配制的人工海水,通过添加NaNO3获得不同的N浓度。
4) 培养后P吸收的测定。具有不同营养史的孢子体材料,转入相同的培养条件的2 L培养海水中分别测定其P吸收情况。培养条件为温度20 ℃,光照强度10 000 lx,培养密度(FW)为10 g·L-1,培养海水初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。
1.3 P吸收速率的测定
不同温度、光照强度或营养史条件下培养的羊栖菜,分别于第0小时、第0.5小时、第1小时、第2小时、第4小时、第6小时和第9小时测定培养海水中的P浓度,以P浓度的变化来表示羊栖菜对P的吸收情况。吸收速率计算公式为:
$$ 吸收速率=\left(N_0-N_t\right) \times V \times\left(t \times W_0\right)^{-1} $$ 其中,N0为初始培养海水中的P浓度,Nt为测量结束时的P浓度(μmol·L-1),V为培养海水的体积(L),W0为初始时藻体的湿质量(FW,g),t为试验时间(h),吸收速率(FW)的单位为μmol·(h·g)-1。培养海水中P浓度的测定采用磷钼蓝分光光度法[21]。
1.4 数据处理和统计分析
所有测定结果表示为平均数±标准差(X ±SD)(n=4),用单因子方差分析(One-way ANOVA)和t检验进行差异显著性分析,以P < 0.05作为差异的显著性水平。
2. 结果
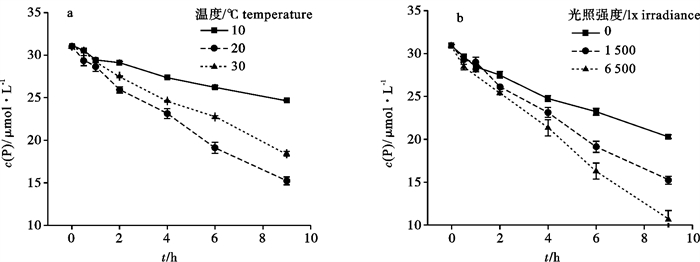
2.1 不同温度下羊栖菜对P的吸收
不同温度培养下羊栖菜培养海水中P浓度随时间变化情况见图 1-a。培养液中P浓度随时间逐渐下降,20 ℃时下降最快,10 ℃最慢,说明羊栖菜对P的吸收速率在20 ℃时达到最大,在10 ℃时最小。9 h内羊栖菜对P的平均吸收速率在不同温度条件之间存在显著性差异(P < 0.001),吸收速率(FW)分别为10 ℃时(0.105±0.001) μmol·(h·g)-1;20 ℃时(0.197±0.005) μmol·(h·g)-1;30 ℃时(0.169±0.001) μmol·(h·g)-1。
2.2 不同光照强度下羊栖菜对P的吸收
不同光照强度条件下羊栖菜培养海水中P浓度的变化情况见图 1-b。随着光照强度的增加,P浓度的下降速度与程度都明显增加,说明羊栖菜对P的吸收速率随着光强升高而显著增大(P < 0.001),9 h内各光强下羊栖菜对P的平均吸收速率为无光照(0)时(0.148±0.002) μmol·(h·g)-1;1 500 lx时(0.197±0.005) μmol·(h·g)-1;6 500 lx时(0.241±0.010) μmol·(h·g)-1。
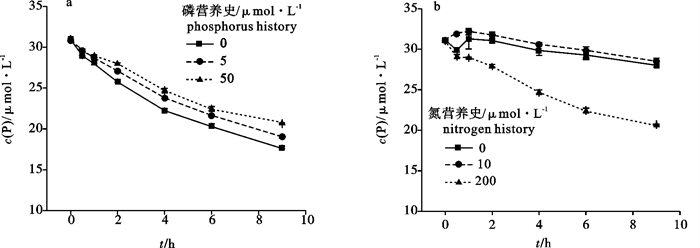
2.3 不同营养史的羊栖菜对P的吸收
具有不同P营养史的羊栖菜,在相同培养条件下藻体对于P的吸收速率呈现出显著的差异(P < 0.05),其培养海水中P浓度的变化见图 2-a。不同营养史的羊栖菜对P的吸收速率的特点为营养史中培养海水P浓度越高,其吸收速率则越低,9 h内平均吸收速率分别为无磷(0)营养史的藻体P吸收速率为(0.173±0.001) μmol·(h·g)-1;5 μmol·L-1营养史的藻体P吸收速率为(0.160±0.001) μmol·(h·g)-1;50 μmol·L-1营养史的藻体P吸收速率为(0.144±0.000) μmol·(h·g)-1。
具有不同N营养史的羊栖菜,在相同培养条件下其培养海水中P浓度的变化见图 2-b。高氮(200 μmol·L-1)营养史藻体的P浓度随时间下降显著,而低氮(10 μmol·L-1)和无氮(0)营养史的藻体培养海水中P浓度随时间变化不明显,并且两者在9 h内对P的平均吸收速率之间无显著性差异(P>0.1)。无氮(0)、低氮(10 μmol·L-1)和高氮(200 μmol·L-1)3种N营养史的藻体9 h内对P的平均吸收速率分别为(0.072±0.003) μmol·(h·g)-1、(0.068±0.004) μmol·(h·g)-1和(1.155±0.007) μmol·(h·g)-1。
3. 讨论
P是大型海藻生长的必需元素,海藻对P的吸收为主动吸收[22],一般情况下其吸收特点符合典型的酶促反应动力学曲线特征[15, 22]。P的吸收代谢与细胞的核酸合成、膜结构组装、识别调节蛋白和酶活性等生化过程密切相关[11],与海藻的生长以及光合作用紧密联系[23-24],因此,影响海藻生长和光合作用的环境因子也必将影响海藻对P的吸收代谢过程。
PEDERSEN等[25]研究了温度对几种紫菜(Porphyra)营养盐吸收速率的影响,结果表明,在P供应充足的条件下海藻对P的吸收速率随温度的升高而加快,温度每升高10 ℃吸收速率就增为2倍,即温度系数Q10=2。笔者研究中温度从10 ℃升到20 ℃时羊栖菜对P的吸收速率从(0.105±0.001) μmol·(h·g)-1升高到(0.197±0.005) μmol·(h·g)-1,Q10约为1.88,这与PEDERSEN等[25]的研究结果相似。其原因可能是由于在较高的温度下P主动吸收需要的各种酶的活性增强,同时随温度而加快的呼吸作用也能为其提供充足的能力,因此能够保持藻体较快的P吸收速率。但当温度为30 ℃时羊栖菜对P的吸收反而出现了一定程度的降低[(0.169±0.001) μmol·(h·g)-1],这可能是高温对P吸收作用相关酶的活性产生了影响。许忠能等[7]早在2002年在对细基江蓠(Gracilaria tenuistipitata)的研究中就发现温度的升高没有使藻体对P的吸收增强,而徐智广等[15]对龙须菜(Gracilaria lemaneiformis)P吸收的研究结果显示,在不同的底物浓度下温度对P吸收特性各个参数的影响也存在差别。温度变化对P吸收影响的差异,除了与不同的海藻种类相关外,很可能受到不同条件下海藻其他生理活动的影响,如光合作用、N的代谢等[23]。
光照对营养盐吸收代谢的影响一般通过光合作用的变化实现。光合作用可以为P吸收提供代谢和相关酶合成所需的碳骨架,保证主动运输过程所需的能量供应[22],因此,光照强度的变化与P吸收具有一定的相关性。有研究表明,在一定条件下光照强度与海藻的P吸收速率呈近似的直角双曲线关系[26]。笔者研究证实,随着光照强度的增强,羊栖菜对P的吸收速率逐渐增强,而此前在对龙须菜的研究中却发现当光强较高(10 000 lx)时,海藻对P的吸收受到抑制[15]。羊栖菜与龙须菜P吸收对于光照强度的不同响应,可能是因为红藻特有的天线色素的高效捕光能力使龙须菜更能适应低光生活,而较高光照强度反而容易引起光抑制,对藻体的生理产生不利的影响。从此研究结果可以看出,羊栖菜更能有效抵制高光带来的光抑制等不利影响,从而可以为P吸收提供更多的能量和碳骨架。此试验结果也和羊栖菜分布于潮间带的中潮位,龙须菜分布于潮间带的低潮位,适应不同的光照强度的自然现象相一致。
大型海藻对P的吸收不仅与光合作用联系紧密,同时也与海藻本身的N、P营养史密切相关。LUNDBERG等[27]通过核磁共振的方法研究了绿藻石莼(Ulva lactuca)对N和P的吸收利用关系,结果显示当硝氮的供应增加时,藻体内的多聚磷酸盐含量反而降低,海藻对P的吸收也受到抑制。这一现象的原因可能是硝氮的代谢争夺光合作用供应的能量和碳骨架,从而抑制多聚磷酸盐的合成,最终反馈抑制P的吸收。而李再亮等[28]对羊栖菜的研究表明,P吸收速率与N/P比密切相关,在特定的N/P比下达到最大。笔者研究中高浓度的硝氮刺激了羊栖菜对P的吸收,与LUNDBERG等[27]的结果不同,而与李再亮等[28]的研究结果相似。这一结果也符合大型海藻生长对N、P按一定比例需求的规律[29]。另外,海藻对P的吸收与细胞内磷库的含量呈典型的负相关关系,这在很多微藻的研究中已经得到了证实[30]。笔者研究中也发现了类似的结论:羊栖菜对P的吸收速率与营养史中P的培养浓度刚好呈相反的趋势(图 2-a)。而HURD和DRING[31]对5种墨角藻(Fucus)P吸收动力学的研究表明,在开始的30 min内有一个快吸收,随后的30 min内几乎不吸收,然后维持稳定的中等吸收速率。这种吸收速率随时间变化的原因可能是藻体细胞内的营养库导致,开始的快吸收(10~60 min)用于充盈细胞内的磷库,随后吸收速率下降则是胞内磷库反馈调节的结果,最后的稳定速率则说明在保持一定磷库含量的情况下磷的吸收与同化速率达到了平衡[32]。
综上所述,羊栖菜对无机磷的吸收受到温度、光照强度以及N、P营养史的显著影响。因而在利用羊栖菜规模化栽培来修复富营养化海水时,要充分考虑海藻的栽培季节、挂养水深以及修复周期等与温度、光照强度、营养史相关的环境因素,根据不同的栽培海区条件,选择适宜的栽培方式,以达到理想的修复效果。
-
表 1 培养基不同成分对鰤鱼诺卡氏菌生长影响的正交试验设计及结果
Table 1 Experimental design and results of different ingredients of medium for the growth of N.seriolea
处理
treatment L9(34)因素/g·L-1 factors 组合的效果/菌浓度OD600
the effect of combination/ bacterial concentration葡萄糖
glucose (A)酵母粉
yeast extract (B)磷酸氢二钾
K2HPO4 (C)氯化钙
CaCl2 (D)1 10 5 0.25 0.1 0.547 2 10 10 0.50 0.2 0.801 3 10 15 0.75 0.3 0.953 4 20 5 0.50 0.3 0.658 5 20 10 0.75 0.1 0.891 6 20 15 0.25 0.2 1.030 7 30 5 0.75 0.2 0.674 8 30 10 0.25 0.3 0.858 9 30 15 0.50 0.1 1.038 K1 0.767 0.626 0.812 0.825 K2 0.860 0.850 0.832 0.835 K3 0.857 1.007 0.839 0.823 R 0.093 0.381 0.027 0.012 最优水平 optimal level A2 B3 C3 D2 因素主次顺序 the principal-secondary sequence of factors B>A>C>D -
[1] 黄郁葱, 简纪常, 吴灶和, 等. 卵形鲳鲹结节病病原的分离与鉴定[J]. 广东海洋大学学报, 2008, 28(4): 49-53. doi: 10.3969/j.issn.1673-9159.2008.04.011 [2] 张建丽, 刘志恒. 诺卡氏菌型放线菌的分类[J]. 微生物学报, 2001, 41(4): 513-517. doi: 10.3321/j.issn:0001-6209.2001.04.022 [3] 袁思平, 王国良, 金珊. 养殖鱼类致病诺卡氏菌研究进展[J]. 微生物学通报, 2006, 33(2): 137-141. doi: 10.3969/j.issn.0253-2654.2006.02.028 [4] 王瑞旋, 刘广锋, 王江勇, 等. 养殖卵形鲳鲹(Trachinotus ovatus)诺卡氏菌病的研究[J]. 海洋湖沼通报, 2010, 33(1): 52-58. doi: 10.3969/j.issn.1003-6482.2010.01.008 [5] 王国良, 徐益军, 金珊, 等. 养殖乌鳢诺卡氏菌病及其病原研究[J]. 水生生物学报, 2009, 33(2): 277-283. doi: 10.3724/SP.J.0000.2009.20277 [6] 石存斌, 潘厚军, 常藕琴, 等. 养殖乌鳢结节病的病原分析[J]. 安徽农业科学, 2009, 37(16): 7384-7386, 7397. doi: 10.3969/j.issn.0517-6611.2009.16.072 [7] WANG G L, YUAN S P, JIN S. Nocardiosis in large yellow croaker, Larimichthys crocea (Richardson)[J]. J Fish Dis, 2005, 28(6): 339-345. doi: 10.1111/j.1365-2761.2005.00637.x
[8] 彭开松, 佘锐萍, 祁克宗, 等. 暗纹东方鲀脂肪肝并发诺卡氏菌病[J]. 水产科学, 2008, 27(12): 629-632. doi: 10.3969/j.issn.1003-1111.2008.12.006 [9] CHEN S C, LEE J L, LAI C C, et al. Nocardiosis in sea bass, Lateolabrax japonicus, in Taiwan[J]. J Fish Dis, 2000, 23(5): 299-307. doi: 10.1046/j.1365-2761.2000.00217.x
[10] WANG P C, CHEN S D, TSA M AI, et al. Nocardia seriolae infection in the three striped tigerfish, Terapon jarbua (Forsskål)[J]. J Fish Dis, 2009, 32(4): 301-310. doi: 10.1111/j.1365-2761.2008.00991.x
[11] 蒋依依, 李安兴. 鰤诺卡菌特异性PCR快速检测方法的建立[J]. 南方水产科学, 2011, 7(6): 47-51. doi: 10.3969/j.issn.2095-0780.2011.06.008 [12] KUSUDA R, NAKAGAWA A. Nocardia infection of cultured yellowtail[J]. Fish Pathol, 1978, 13(1): 25-31. doi: 10.3147/jsfp.13.25
[13] SHIMAHARA Y, YASUDA H, NAKAMURA, et al. A detection of antibody responses against Nocardia seriolae by enzyme-linked immunosorbent assay (ELISA) and a preliminary vaccine trial in yellowtail Seriola quinqueradiata[J]. Eur Assoc Fish Pathologists, 2005, 25(6): 270-275.
[14] ITANO T, KAWAKAMI H, KONO T, et al. Live vaccine trials against nocardiosis in yellowtail, Seriola quinqueradiata[J]. Aquaculture, 2006, 261(4): 1175-1180. doi: 10.1016/j.aquaculture.2006.09.006
[15] 常藕琴, 石存斌, 潘厚军, 等. 乌鳢诺卡氏菌病的组织病理学[J]. 水产学报, 2008, 32(2): 209-216. doi: 10.3321/j.issn:1000-0615.2008.02.006 [16] 王国良, 刘璐, 李思源, 等. 鰤鱼诺卡氏菌SYBR GreenⅠ实时荧光定量PCR检测方法的建立与应用[J]. 水产学报, 2012, 36(4): 509-513. doi: 10.3724/SP.J.1231.2012.27624 [17] 王国良, 刘璐, 徐益军. 鱼类致病鰤鱼诺卡氏菌(Nocardia seriolae)的LAMP检测技术建立与应用[J]. 海洋与湖沼, 2011, 42(1): 27-31. doi: 10.11693/hyhz201101004004 -
期刊类型引用(11)
1. 周庆澔,许曹鲁,权伟. 不同条件下羊栖菜溶解有机碳(DOC)分泌特征. 渔业研究. 2023(03): 271-279 .  百度学术
百度学术
2. 陈泽宇,丁雨豪,王静文,倪嘉璇,何昊林,徐加涛,蒋书英,王津果. 温度和氮营养盐对龙须菜生长与光合生理的影响. 湖北农业科学. 2023(12): 94-101 .  百度学术
百度学术
3. Jin Xu,Zhixin Guo,Xiaochun Jiang,Golam Jalal Ahammed,Yanhong Zhou. Light regulation of horticultural crop nutrient uptake and utilization. Horticultural Plant Journal. 2021(05): 367-379 .  必应学术
必应学术
4. 韩婷婷,齐占会,黄洪辉,梁庆洋. 3种氮源加富对半叶马尾藻幼苗生长和生化组成的影响. 渔业科学进展. 2018(04): 159-166 .  百度学术
百度学术
5. 刘棋琴,羊芃,马明婕,周丽亚,李亚鹤,杨锐. 温度对4种大型海藻氮磷吸收效率及光合生理特性的影响. 水生生物学报. 2018(05): 1050-1056 .  百度学术
百度学术
6. 杨安强,史定刚,陈少波,张鹏,王铁杆,关万春. 高CO_2条件下温度和光照对铜藻吸收N、P的短期影响. 浙江农业科学. 2017(02): 303-307 .  百度学术
百度学术
7. 刘迎超,李景玉,宫庆礼. 羊栖菜的生长和生化组成的影响因素. 河北渔业. 2016(08): 55-60 .  百度学术
百度学术
8. 张文文,郭永坚,李俊伟,朱长波,陈素文,颉晓勇. 营养盐对海萝生长和藻体生化成分的影响. 南方水产科学. 2016(02): 30-35 .  本站查看
本站查看
9. 芦薇薇,王巧晗,宫庆礼. 光照强度和温度对巨藻幼孢子体的生长和生化组成的影响. 中国海洋大学学报(自然科学版). 2016(01): 40-48 .  百度学术
百度学术
10. 李钠钾,许安定,单沛祥,江厚龙,杨超,王红锋,沈铮,马浩. 不同双棚管理对烟草漂浮育苗生长发育的影响. 广东农业科学. 2015(14): 36-40 .  百度学术
百度学术
11. 徐智广,朱安成,吴海一. 硝氮和紫外辐射对龙须菜碳氮利用的影响. 广西科学院学报. 2015(03): 219-227 .  百度学术
百度学术
其他类型引用(11)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
