Observation of gonad at different development stages and expression analysis of Kiss2/Kiss2r genes in Megalobrama amblycephala
-
摘要:
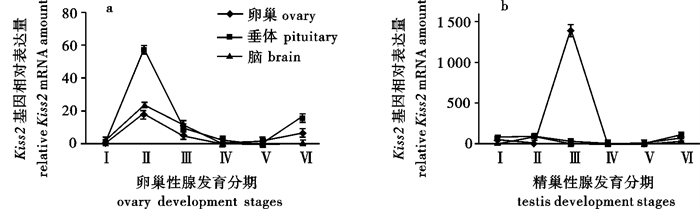
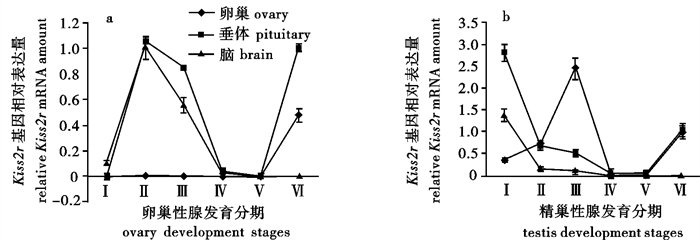
Kiss基因(Kisspeptin)及其受体Kissr基因(Kiss receptor)组成的系统参与下丘脑-垂体-性腺轴功能的调节,在脊椎动物青春期启动的过程中发挥重要作用。该研究通过组织切片技术观察了团头鲂(Megalobrama amblycephala)卵巢和精巢的不同分期,进一步采用荧光定量PCR技术分析比较了团头鲂Kiss2和Kiss2r基因在雌、雄性腺不同时期对应的脑、垂体、性腺组织中的表达量。组织切片观察明确鉴别出团头鲂卵巢和精巢发育Ⅰ期至Ⅵ期的性腺组织结构,基因荧光定量PCR分析结果表明Kiss2/Kiss2r系统主要是通过增加团头鲂卵巢发育Ⅱ期时脑和垂体的表达量以及Ⅲ期精巢的表达量来发挥生殖启动作用。
-
关键词:
- 团头鲂 /
- Kiss2/Kiss2r系统 /
- 性腺发育 /
- 基因表达
Abstract:Lots of studies have proved that Kiss gene and its receptor gene Kissr play an important role in the regulation of the gonadotropic axis, especially in the timing of puberty in vertebrates. We identified the gonad development of blunt snout bream (Megalobrama amblycephala) from stage Ⅰ to stage Ⅵ using tissue slice technology, detected the Kiss2 and Kiss2r gene transcription in the brain through quantitative real time PCR (qPCR), and collected pituitary and gonad tissues of the samples during different stages. The qPCR results show that Kiss2/Kiss2r play roles in the onset of puberty in M.amblycephala by increasing the expression of pituitary and gonad during ovary development in stage Ⅱ, and the expression of testis in stage Ⅲ.
-
Keywords:
- Megalobrama amblycephala /
- Kiss2/Kiss2r system /
- gonad development /
- gene expression
-
亚甲基蓝(methylene blue,MB)又名次甲基蓝、碱性湖蓝、美蓝,是一种人工合成的噻嗪类染料,具有抗菌和消毒的作用,可用于治疗淡水鱼类的小爪虫病、斜管虫病、水霉病和凡纳滨对虾(Penaeus vannamei)幼体粘脏病,也可用作抗真菌药物 [1-3],降低鱼类运输中的死亡率。由于亚甲基蓝及其代谢物被认为对动物体有毒性并有致突变作用[4-8],在美国、日本等国家禁止用于水产养殖,在国内也未被批准使用。
亚甲基蓝及其代谢物残留的检测方法有分光光度法[9]、毛细管电泳法[10]、液相色谱法等[11-13],其中对水产品中的残留检测方法国外研究较少,国内主要是液相色谱法。超高效液相色谱串联质谱方法,可以实现同时对水产品中几种有害物质进行定性并定量检测,具有检测限低、准确度高的优点[14],是近年来食品中有害物质残留检测的发展趋势[15-17],笔者在已有研究的基础上[10-11],建立了使用超高效液相色谱-电喷雾串联质谱仪同时测定水产品中亚甲基蓝及其3种代谢产物——天青A、天青B、天青C含量的方法,具有实际意义和推广前景。
1. 材料与方法
1.1 试验材料
试验用草鱼(Ctenopharyngodon idellus)6尾,体长(60±2)cm,每尾体质量为(2.5±0.3)kg,去鳞、去皮,沿脊背取肌肉;凡纳滨对虾200尾,体长(10±1)cm,每尾体质量为(10±1.2)g,去头、去壳、去肠腺,取肌肉部分;中华绒鳌蟹(Eriocheir sinensis)50只,每只体质量为(100±7.5)g,取可食部分。样品充分绞碎、混匀,于-20 ℃冷冻保藏。试验所用水产品均购自南京市迎宾菜市场。
混合型阳离子交换柱(MCX)、C8/SCX混合模式柱(MCAX)、C18柱(C18)、对丙磺酸柱(PRS)(美国Agilent公司出品),规格均为500 mg/3 mL。
1.2 仪器
Accela超高效液相色谱、TSQ Quantum Access Max三重四级杆质谱仪(美国Thermo Fisher公司出品)、Allegra 64R高速冷冻离心机(美国Beckman公司出品)、Caliper Turbovap LV全自动浓缩工作站(美国Zymark公司出品)、12通道自动固相萃取装置(德国CNW公司出品)、十万分之一电子天平(德国Sartorius公司出品)、Milli-Q去离子水发生器(美国Millipore公司出品)。
1.3 试剂
亚甲基蓝、天青A和天青C购自美国Fluka公司,纯度均大于95%;天青B购自美国Sigma公司,纯度为89%。甲醇、乙腈、二氯甲烷、甲酸、乙酸铵均为色谱纯试剂(美国TEDIA公司出品),盐酸羟胺、对甲苯磺酸均为分析纯试剂。
1.4 样品前处理方法
称取5.00 g样品,其中中华绒螯蟹样品2.00 g,于50 mL离心管中分别加入0.5 g·mL-1的盐酸羟胺溶液0.75 mL、2 mol·L-1的对甲苯磺酸溶液1.25 mL、pH 4.5 0.1 mol·L-1的乙酸铵缓冲液5 mL,涡旋1 min;再加入10 mL乙腈涡旋1 min,8 000 r·min-1离心10 min,上清液倒入125 mL分液漏斗中;再用10 mL乙腈重复提取2次;加入25 mL二氯甲烷振荡萃取,静置1 h后取下层溶液用45 ℃氮气吹至近干。用3 mL乙腈溶解残渣,上样于用3 mL乙腈活化好的PRS柱,再用乙腈重复溶解残渣2次,待样液流尽后将柱子吹至近干,用3 mL洗脱液[V(乙酸铵,1 mol·L-1) : V(乙腈) =1 : 1]洗脱,洗脱液收集于10 mL玻璃试管中,用蒸馏水稀释到10 mL。涡旋混匀后过0.22 μm尼龙滤膜供质谱检测。
1.5 色谱条件
色谱柱为Thermo Hypersil Gold C18柱,50 mm×2.1 mm(内径),粒度1.9 μm;柱温为30 ℃;进样体积10 μL;流动相为甲醇+0.2%甲酸溶液,采用梯度洗脱的方法,梯度洗脱程序见表 1。
表 1 流动相梯度洗脱程序Table 1. Gradient elution with mobile phasest/min 0.2%甲酸(A)
0.2% methanoic acid甲醇(B)
methanol0.0 90 10 1.0 90 10 5.0 10 90 5.1 90 10 9.0 90 10 1.6 质谱条件
电喷雾离子源(ESI),正离子模式,喷雾电压3 000 V,蒸发器温度300 ℃,鞘气为10.5 L·min-1,辅助气3 L·min-1,毛细管温度270 ℃,碰撞气为氩气(0.2 Pa),选择反应监测(SRM)扫描模式。SRM模式各离子信息详见表 2。
表 2 亚甲基蓝及代谢物的定性定量特征离子及优化的质谱参数Table 2. Qualitative and quantitative characteristic ions and optimized MS/MS parameters of methylene blue and metabolites标准物
compounds母离子/(m/z)
mother ion子离子/(m/z)
daughter ion碰撞能量/V
collision energy亚甲基蓝 MB 284 268.2* 33 252.1 52 天青A AzuA 256 214.2* 33 199.1 42 天青B AzuB 270 254.1* 35 255.2 28 天青C AzuC 242 200.1* 34 227.2 27 注:*.定量离子
Note: *.MS/MS quantitative ion2. 结果与讨论
2.1 条件优化研究
2.1.1 提取溶液的选择
提取时体系中加入适量浓度的盐酸羟胺溶液可维持还原环境[15],使亚甲基蓝及其代谢物结构保持稳定;同时,对甲苯磺酸作为离子对试剂,可与离子型化合物结合成为分子型物质[15],更有利于亚甲基蓝及其代谢物的提取。向空白阴性草鱼样品中添加200 μL质量浓度为100 μg·L-1的4种混和标准溶液,涡旋混匀,放置30 min后分别使用3.0、4.5、5.5、7.0、10.0等5个不同pH的乙酸铵缓冲液提取,每组4个平行,分别测定每次提取所得亚甲基蓝及其代谢物的回收率,采用pH 4.5的乙酸铵缓冲液提取时亚甲基蓝及其代谢物回收率最高(表 3)。
表 3 不同pH值的提取液提取时亚甲基蓝及代谢物的回收率Table 3. Recovery of methylene blue and metabolites extracting in different pH level% 目标物质
target compoundpH 3.0 4.5 5.5 7.0 10.0 亚甲基蓝 MB 80.63 87.38 78.69 73.94 68.13 天青A AzuA 76.32 91.58 83.12 68.35 70.33 天青B AzuB 79.36 90.19 80.39 48.10 77.31 天青C AzuC 78.98 86.71 81.55 57.31 68.96 2.1.2 提取次数的选择
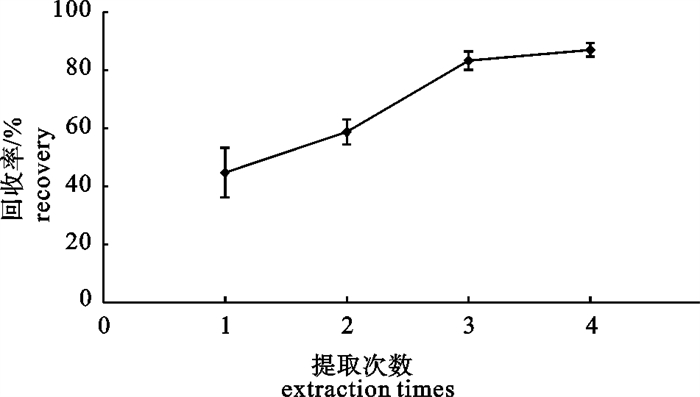
分别使用10 mL的乙腈提取1、2、3、4次,每次4个平行样品,分别测定提取所得亚甲基蓝及其代谢物的回收率,提取1次时亚甲基蓝及其代谢物回收率仅有50%左右,随着提取次数的增多、亚甲基蓝及其代谢物的回收率提高,提取3次和4次的差别不大(图 1),但综合考虑检测成本和时效性,最终选用提取3次。
2.1.3 SPE净化小柱的选择
在试管中将200 μL 100 μg·L-1的标准溶液用乙腈稀释到3 mL,加到活化好的对丙磺酸小柱(PRS)、混合型阳离子交换小柱(MCX)、C8/SCX混合模式小柱(MCAX)、C18小柱(C18)4种固相萃取柱上,用3 mL乙腈重复洗涤试管2次,用体积分数为50%的乙酸铵(1 mol·L-1)乙腈洗脱,每组4个平行,考察了不同SPE小柱对亚甲基蓝及其代谢物提取效率的影响。表 4显示MCX过柱速度太快,难以控制流速,目标物损失严重,亚甲基蓝及其代谢物回收率不到40%;C18柱净化效果不理想,过柱后仍有许多杂质;MCAX和PRS柱对目标物质回收率相似,但PRS柱萃取过程中样液流速适中,更易于控制,且加标回收率更稳定,所以采用PRS柱。
表 4 不同的净化小柱对亚甲基蓝及代谢物回收率的影响Table 4. Recovery of methylene blue and metabolites under different solid phase extraction columns% 目标物质
target compounds丙磺酸小柱
PRS column混合型阳离子交换小柱
MCX columnC8/SCX混合模式小柱
MCAX columnC18小柱
C18 column亚甲基蓝 MB 93.2 36.8 90.1 68.3 天青A AzuA 90.3 35.1 80.3 59.2 天青B AzuB 89.2 30.5 87.5 70.5 天青C AzuC 87.1 33.7 79.2 66.9 2.1.4 洗脱剂的选择
在试管中将200 μL 100 μg·L-1的标准溶液用乙腈稀释到3 mL,加到活化好的对丙磺酸小柱(PRS)上,用3 mL乙腈重复洗涤试管2次,分别用甲醇、乙腈、体积分数为50%的乙酸铵(1 mol·L-1)乙腈、体积分数为50%的乙酸铵(1 mol·L-1)甲醇洗脱。结果显示,纯的有机溶剂如甲醇、乙腈等不能将目标物洗脱下来,乙酸铵和甲醇混合液洗脱时仅有部分洗脱下来;采用乙酸铵和乙腈等体积混合洗脱效率明显增强,目标物质峰型良好。此外,试验还考察了采用不同浓度的乙酸铵溶液洗脱对亚甲基蓝及其代谢物回收率的影响(表 5)。结果表明,采用浓度为1 mol·L-1的乙酸铵溶液和等体积的乙腈混和时,亚甲基蓝及其代谢物回收率最高。将洗脱后的溶液稀释到10 mL再进样,使样品中的盐浓度降低,可起到保护质谱仪的作用。
表 5 不同浓度的乙酸铵乙腈洗脱时亚甲基蓝及代谢物的回收率Table 5. Recovery of methylene blue and metabolites with different concentration of eluents% 目标物质
target compoundsc(乙酸铵)/ mol·L-1
ammonium acetate content0.1 0.5 1.0 亚甲基蓝 MB 40.38 73.94 98.13 天青A AzuA 31.58 68.35 95.33 天青B AzuB 30.19 68.10 97.31 天青C AzuC 36.71 87.31 95.96 2.1.5 色谱条件的优化及选择
此试验分别采用5 mmol·L-1乙酸铵-甲醇、5 mmol·L-1乙酸铵-乙腈、0.2%甲酸-甲醇、0.2%甲酸-乙腈4种流动相试验。结果表明,采用0.2%甲酸溶液和甲醇作为流动相时亚甲基蓝及其代谢物峰型最好。甲酸溶液与甲醇的比例不同,对亚甲基蓝及代谢物出峰时间和强度存在明显差异。当流动相中甲醇比例较高时,亚甲基蓝及其代谢物在色谱柱上的保留时间短,峰形也较差;随着甲酸溶液比例增高,亚甲基蓝及其代谢物的出峰时间推迟,且峰形变好。最后形成的梯度洗脱程序见表 1。
2.1.6 质谱条件的优化及确定
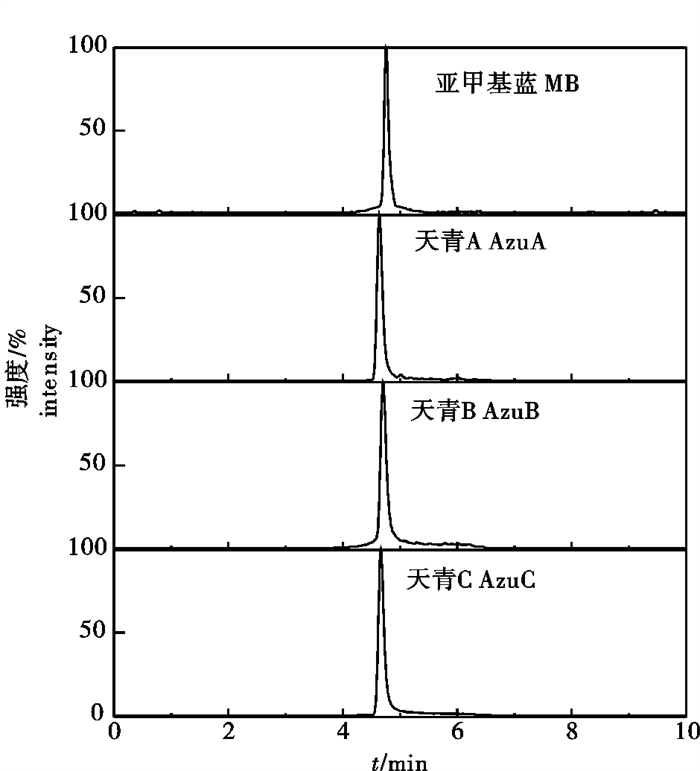
取质量浓度为10 mg·L-1的亚甲基蓝及天青标准品用质谱仪检测,采用注射泵以5 μL·min-1的速度进样,调节毛细管电压和碰撞电压,探索亚甲基蓝及代谢物标准品最佳质谱条件。根据亚甲基蓝及天青的结构特征选择正离子模式,优化喷雾电压、辅助气和鞘气等质谱参数,获得亚甲基蓝和天青稳定的分子离子峰,然后以氩气为碰撞气,获得碎片离子的质谱信息,并进一步优化碰撞能量、毛细管温度和蒸发器温度等质谱参数,使碎片离子信号强度达到最大。最后选择相对丰度最高2个离子作为定量和定性离子,第一强的碎片离子作为定量离子,次强的作为定性离子。亚甲基蓝及代谢物的定性与定量特征离子及优化的质谱参数见表 2。优化条件下各种目标物的SRM图见图 2。
2.2 方法学研究
2.2.1 方法的线性范围、检出限、定量限
准确称取4种标准品各5.0 mg,分别以甲醇溶解并定容至100 mL,其质量浓度均为50 mg·L-1的单标储备液。采用逐级稀释的方式,配制成质量浓度为0.50 μg·L-1、2.00 μg·L-1、5.00 μg·L-1、10.00 μg·L-1、50.00 μg·L-1、100.00 μg·L-1的混合标准工作液,按照质量浓度由低到高进样,对各目标物峰面积及其质量浓度进行线性回归分析,得到亚甲基蓝及其代谢物的标样工作曲线。结果表明,4种目标物在0.50~100.00 μg·L-1范围内呈良好的线性关系,相关系数R>0.99。检出限(LOD)采用向空白样品中逐级降低加标浓度的方法来确定,以大于等于3倍信噪比(S/N≥3)对应的目标物浓度为检出限,以S/N≥10对应的浓度为定量限(表 6)。
表 6 0.50~100.00μg·L-1范围内亚甲基蓝及其代谢物的线性关系及相关系数Table 6. Linear relationship and correlation coefficient of methylene blue and metabolites within scope 0.50~100.00 μg·L-1物质
compound线性方程
linear relationship相关系数
R检出限/μg·kg-1
LOD定量限/μg·kg-1
LOQ亚甲基蓝 MB y=45 254x+140 368 0.997 9 0.40 2.00 天青A AzuA y=3 308.3x+16 774 0.995 9 0.60 2.00 天青B AzuB y=49 098x+167 560 0.998 0 0.50 2.00 天青C AzuC y=13 223x+30 124 0.995 3 0.40 2.00 注:y.亚甲基蓝及其代谢物的定量离子的质谱峰面积;x.亚甲基蓝及其代谢物的质量浓度(μg·L-1)
Note: y. mass spectra peak area of methylene blue and metabolites; x. content of methylene blue and metabolites(μg·L-1)2.2.2 样品加标的回收率和精密度
选取空白草鱼、凡纳滨对虾和中华绒螯蟹3种类型的水产品,分别添加2 μg·kg-1、4 μg·kg-1、10 μg·kg-13个水平的亚甲基蓝及其代谢物标准品,按1.4、1.5、1.6所述方法进行加标回收率测定,每个加标水平平行测定6次,计算平均回收率和相对标准偏差。4种目标物的加标回收率为74.23%~94.40%,在各个加标水平下加标回收率比较稳定,相对标准偏差(RSD)为1.13%~10.28%(表 7~表 9),可满足水产品中亚甲基蓝及代谢物残留的检测要求。
表 7 空白草鱼肉样中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 7. Recovery and precision of methylene blue and azures of blank Ctenoparyngodon idellus samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 83.10 1.13 4 81.59 4.09 10 88.35 3.97 天青A AzuA 2 85.47 9.41 4 81.75 5.03 10 87.68 9.76 天青B AzuB 2 82.94 2.53 4 89.65 5.83 10 88.56 8.03 天青C AzuC 2 87.91 9.72 4 90.69 3.61 10 92.60 5.98 表 8 空白凡纳滨对虾样品中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 8. Recovery and precision of methylene blue and azures of blank Penaeus vannamei samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 87.94 5.46 4 89.42 4.91 10 80.80 1.46 天青A AzuA 2 78.11 8.97 4 84.86 9.81 10 82.20 6.06 天青B AzuB 2 80.01 5.53 4 83.62 8.58 10 90.83 5.24 天青C AzuC 2 91.49 8.69 4 94.40 5.21 10 92.86 4.10 表 9 空白中华绒螯蟹样品中亚甲基蓝及代谢物的加标回收率和精密度(n=6)Table 9. Recovery and precision of methylene blue and azures of blank Eriocheir sinensis samples目标物质 target compound 加标量/μg·kg-1 added amount 回收率/% recovery 相对标准偏差/% RSD 亚甲基蓝 MB 2 81.85 5.42 4 80.35 6.22 10 81.68 4.20 天青A AzuA 2 74.54 8.75 4 81.05 8.25 10 90.42 9.74 天青B AzuB 2 74.23 6.83 4 85.24 7.84 10 87.05 10.28 天青C AzuC 2 86.69 2.59 4 86.21 6.50 10 88.50 4.24 3. 结论
建立了超高效液相色谱-串联质谱法分析水产品中亚甲基蓝及其代谢物残留量的方法。样品用乙腈提取,经PRS柱固相萃取,乙酸铵乙腈洗脱,以甲醇和0.2%甲酸为流动相进行梯度洗脱分离,质谱条件采用电喷雾离子源(ESI),正离子模式,选择反应监测(SRM)的扫描模式定量分析。该方法准确度高、实用性强、简便易行,能满足实际样品中亚甲基蓝及其代谢物的检测要求,也可作为亚甲基蓝其他方面研究的参考方法。
-
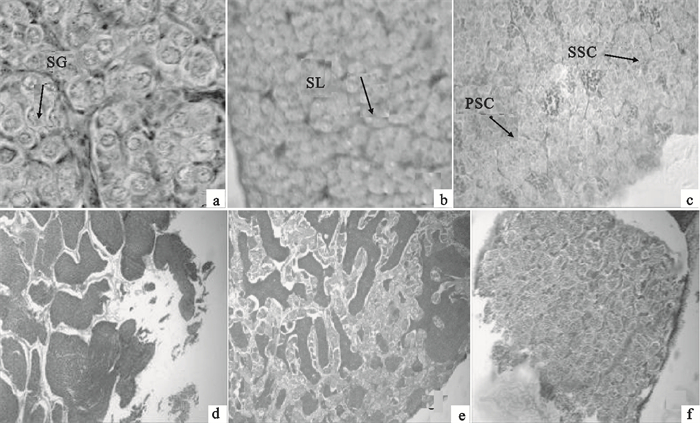
图 1 团头鲂精巢发育各时期的切片组织结构
a. Ⅰ期精巢(×400);b. Ⅱ期精巢(×400);c. Ⅲ期精巢(×400);d. Ⅳ期精巢(×100);e. Ⅴ期精巢(×100);f. Ⅵ期精巢(×100);SG. 精原细胞,SL. 精小叶,PSC. 初级精母细胞,SSC. 次级精母细胞
Figure 1. Microstructure of M.amblycephala in different testis development stages
a. testis at stage Ⅰ(×400);b. testis at stage Ⅱ(×400);c. testis at stage Ⅲ(×400);d. testis at stage Ⅳ(×100);e. testis at stage Ⅴ(×100);f. testis at stage Ⅵ(×100);SG. spermatogonium; SL. seminal lobule; PSC. primary spermatocytes; SSC. seeondary speratoeytes
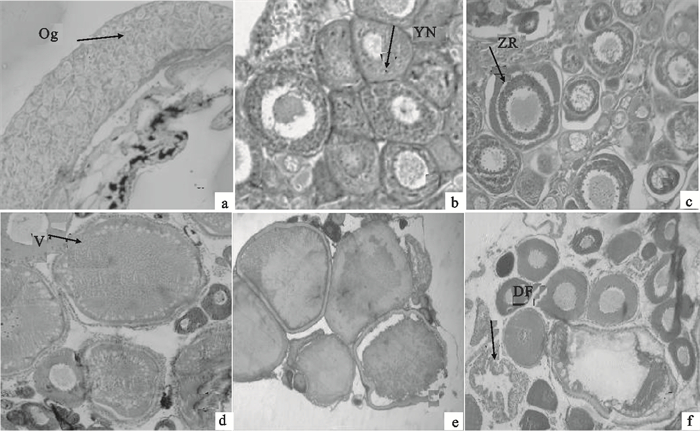
图 2 团头鲂卵巢发育各时期的切片组织结构
a. Ⅰ期卵巢(×100);b. Ⅱ期卵巢(×400);c. Ⅲ期卵巢(×400);d. Ⅳ期卵巢(×100);e. Ⅴ期卵巢(×100);f. Ⅵ期卵巢(×100);Og. 卵原细胞;YN. 卵黄核;ZR. 辐射带;V. 液泡;DF. 空滤泡
Figure 2. Microstructure of M.amblycephala in different testis development stages
a. ovary at stage Ⅰ(×100);b. ovary at stage Ⅱ(×400);c. ovary at stage Ⅲ(×400);d. ovary at stage Ⅳ(×100);e. ovary at stage Ⅴ(×100);f. ovary at stage Ⅵ(×100);Og. oogonium; YN. yolk nucleus; ZR. zona radiata; V. vesicles; DF. discharged follicles
表 1 基因荧光定量PCR所用引物序列
Table 1 Sequences of primers used for genes qPCR
基因 genes 引物序列 primer sequence (5′→3′) Kiss2 (GenBank: KC136218) F: CGTCAGAGTCCGTAGTTGTC R: ACTCCAAGCAGCACTATCTC Kiss2r (GenBank: KC146704) F: GGCCACTAACTTCTACATTGC R: ATGGCCATTGTCCTTGAAA β-actin (GenBank: AY170122.2) F: CGGACAGGTCATCACCATTG R: CGCAAGACTCCATACCCAAGA 表 2 12月龄团头鲂样品信息表
Table 2 Characteristics of collected one year old M.amblycephala
编号
No.体质量/g
body weight体长/cm
body length性腺质量/g
gonad weight性腺分期
gonad stage成熟系数/%
GSI1 35.69 13.40 0.12 Ⅱ 0.30 2 31.28 12.70 0.18 Ⅱ 0.58 3 102.37 16.83 0.57 Ⅱ 0.56 4 39.14 13.51 0.50 Ⅱ 1.28 5 90.42 16.21 0.70 Ⅱ 0.77 6 146.69 18.70 0.64 Ⅱ 0.44 7 39.47 13.21 0.66 Ⅲ 1.67 8 113.30 18.12 1.18 Ⅲ 1.04 9 170.32 20.19 0.38 Ⅲ 0.22 10 78.96 15.32 1.68 Ⅲ 2.13 11 156.70 19.54 3.85 Ⅲ 2.46 12 134.60 18.52 2.58 Ⅲ 1.92 13 108.59 17.43 2.41 Ⅲ 2.22 14 79.56 15.60 1.98 Ⅲ 2.49 15 115.69 17.40 1.89 Ⅲ 1.63 16 111.42 16.80 1.96 Ⅲ 1.76 17 62.38 14.80 0.64 Ⅲ 1.03 18 120.12 17.80 0.60 Ⅲ 0.50 19 122.89 18.50 0.92 Ⅲ 0.75 20 75.05 15.21 1.54 Ⅲ 2.05 21 73.27 15.09 1.46 Ⅲ 1.99 22 75.15 15.22 1.67 Ⅲ 2.22 23 63.32 14.51 0.96 Ⅲ 1.52 24 64.67 14.45 0.73 Ⅲ 1.13 25 82.60 16.40 4.61 Ⅳ 5.58 26 128.49 18.20 5.04 Ⅳ 3.92 27 129.28 18.70 4.50 Ⅳ 3.48 28 137.86 19.30 4.84 Ⅳ 3.51 29 132.80 19.60 12.64 Ⅳ 9.52 30 136.04 18.90 4.98 Ⅳ 3.66 -
[1] LEE D K, NGUYEN T, O′NEILL G P, et al. Discovery of a receptor related to the galanin receptors[J]. FEBS Lett, 1999, 446(1): 103-107. doi: 10.1016/S0014-5793(99)00009-5
[2] MESSAGER S, CHATZIDAKI E E, MA D, et al. Kisspeptin directly stimulates gonadotropin releasing hormone release via G protein-coupled receptor 54[J]. Proc Natl Acad Sci USA, 2005, 102(5): 1761-1766. doi: 10.1073/pnas.0409330102
[3] KOTANI M, DETHEUX M, VANDENBOGAERDE A, et al. The metastasis suppressor gene Kiss-1 encodes kisspeptins, the natural ligands of the orphan G protein-coupled receptor GPR54[J]. J Biol Chem, 2001, 276(37): 34631-34636. doi: 10.1074/jbc.M104847200
[4] ROA J, AGUILAR E, DIEGUEZ C, et al. New frontiers in kisspeptin/GPR54 physiology as fundamental gatekeepers of reproductive function[J]. Front Neuroendocrinol, 2008, 29(1): 48-69. doi: 10.1016/j.yfrne.2007.07.002
[5] PASQUIER J, LAFONT A G, TOSTIVINT H, et al. Comparative evolutionary histories of kisspeptins and kisspeptin receptors in vertebrates reveal both parallel and divergent features[J]. Front Endocrinol (Lausanne), 2012, 3(1): 173. https://pubmed.ncbi.nlm.nih.gov/23272003/
[6] MECHALY A S, VIÑAS J, PIFERRER F, et al. Identification of two isoforms of the kisspeptin-1 receptor (Kiss1r) generated by alternative splicing in a modern teleost, the Senegalese sole (Solea senegalensis)[J]. Biol Reprod, 2009, 80(1): 60-69. doi: 10.1095/biolreprod.108.072173
[7] FILBY A L, VAN AERLE R, DUITMAN J, et al. The kisspeptin/gonadotropin releasing hormone pathway and molecular signaling of puberty in fish[J]. Biol Reprod, 2008, 78(2): 278-289. doi: 10.1095/biolreprod.107.063420
[8] BIRAN J, BEN-DOR S, LEVAVI-SIVAN B. Molecular identification and functional characterization of the kisspeptin/kisspeptin receptor system in lower vertebrates[J]. Biol Reprod, 2008, 79(4): 776-786. doi: 10.1095/biolreprod.107.066266
[9] PARHAR I S, OGAWA S, SAKUMA Y. Laser-captured single digoxigenin-labeled neurons of gonadotropin-releasing hormone types reveal a novel G protein-coupled receptor (gpr54) during maturation in cichlid fish[J]. Endocrinology, 2004, 145(8): 3613-3618. doi: 10.1210/en.2004-0395
[10] MOHAMED J S, BENNINGHOFF A D, HOLT G J, et al. Developmental expression of the G protein-coupled receptor 54 and three GnRH mRNAs in the teleost fish cobia[J]. J Mol Endocrinol, 2007, 38(1/2): 235-244. doi: 10.1677/jme.1.02182
[11] NOCILLADO J N, LEVAVI-SIVAN B, CARRICK F, et al. Temporal expression of G-protein-coupled receptor 54 (GPR54) gonadotropin-releasing hormones (GnRH), and dopamine receptor D2 (drd2) in pubertal female grey mullet, Mugil cephalus[J]. Gen Comp Endocrinol, 2007, 150(2): 278-287. doi: 10.1016/j.ygcen.2006.09.008
[12] ZMORA N, STUBBLEFIELD J, ZULPERI Z, et al. Differential and gonad stage-dependent roles of kisspeptin1 and kisspeptin2 in reproduction in the modern teleosts, Morone species[J]. Biol Reprod, 2012, 86(6): 177. doi: 10.1095/biolreprod.111.097667.
[13] MECHALY A S, VIÑAS J, MURPHY C, et al. Gene structure of the Kiss1 receptor-2 (Kiss1r-2) in the Atlantic halibut: insights into the evolution and regulation of Kiss1r genes[J]. Mol Cell Endocrinol, 2010, 317(1/2): 78-89. doi: 10.1016/j.mce.2009.11.005
[14] SELVARAJ S, KITANO H, FUJINAGA Y, et al. Molecular characterization, tissue distribution, and mRNA expression profiles of two Kiss genes in the adult male and female chub mackerel (Scomber japonicus) during different gonadal stages[J]. Gen Comp Endocrinol, 2010, 169(1): 28-38. doi: 10.1016/j.ygcen.2010.07.011
[15] SHAHJAHAN M, MOTOHASHI E, DOIH, et al. Elevation of Kiss2 and its receptor gene expression in the brain and pituitary of grass puffer during the spawning season[J]. Gen Comp Endocrinol, 2010, 169(1): 48-57. doi: 10.1016/j.ygcen.2010.07.008
[16] SHIMIZU Y, TOMIKAWA J, HIRANO K, et al. Central distribution of Kiss2 neurons and peri-pubertal changes in their expression in the brain of male and female red seabream Pagrus major[J]. Gen Comp Endocrinol, 2012, 175(3): 432-442. doi: 10.1016/j.ygcen.2011.11.038
[17] 柯鸿文. 一种优良淡水鱼——团头鲂(Megalobrama amblycephala)的繁殖和饲养[J]. 水生生物学集刊, 1975, 5(3): 293-314. https://www.cqvip.com/QK/71135X/201107/15137783.html [18] 李思发. 鱼类良种介绍——团头鲂浦江1号[J]. 中国水产, 2001(11): 52. http://qikan.cqvip.com/Qikan/Article/Detail?id=5753116 [19] 施瑔芳, 尹伊伟, 胡传林, 等. 鲢鱼性腺周年变化的研究[J]. 水生生物学集刊, 1964, 5(1): 77-94. http://ssswxb.ihb.ac.cn/article/id/6ecaf666-1f46-4960-8fe3-b0cf4e46633d [20] SEMINARA S B, MESSAGER S, CHATZIDAKI E E, et al. The GPR54 gene as a regulator of puberty[J]. N Engl J Med, 2003, 349(17): 1614-1627. https://pubmed.ncbi.nlm.nih.gov/14573733/
[21] KAUFFMAN A S, CLIFTON D K, STEINER R A. Emerging ideas about kisspeptin-GPR54 signaling in the neuroendocrine regulation of reproduction[J]. Trends Neurosci, 2007, 30(10): 504-511. doi: 10.1016/j.tins.2007.08.001
[22] ROA J, VIGO E, CASTELLANO J M, et al. Hypothalamic expression of Kiss-1 system and gonadotropin-releasing effects of kisspeptin in different reproductive states of the female rat[J]. Endocrinology, 2006, 147(6): 2864-2878. https://academic.oup.com/endo/article/147/6/2864/2879393
[23] OKUZAWA K. Puberty in teleosts[J]. Fish Physiol Biochem, 2002, 26(1): 31-41. doi: 10.1023/A:1023395025374



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
