Effects of Ca2+ concentrations in seawater on element content of fish body and otolith of juvenile Paralichthys olivaceus
-
摘要:
在盐度30和水温20 ℃条件下,分别配制钙离子(Ca2+)质量浓度为200 mg·L-1(A组)、400 mg·L-1(B组,对照)、800 mg·L-1(C组)、1 600 mg·L-1(D组)和3 000 mg·L-1(E组)的人工海水,研究了水体ρ(Ca2+)对褐牙鲆(Paralichthys olivaceus)幼鱼鱼体和耳石元素成分的影响。经60 d养殖发现褐牙鲆鱼体中仅钙(Ca)、锌(Zn)和铜(Cu)质量分数差异不显著(P>0.05);鱼体中磷(P)、钠(Na)、镁(Mg)、锶(Sr)、铁(Fe)、锰(Mn)和镍(Ni)质量分数随水体ρ(Ca2+)的增加而下降。不同ρ(Ca2+)对褐牙鲆幼鱼耳石长、宽、长宽比和耳石质量影响显著(P < 0.05)。低浓度A组耳石长和耳石宽显著低于B组和C组,A组耳石长宽比(L/W)显著低于D组,A组的耳石质量显著低于B组和D组(P < 0.05)。其中w(Sr)随ρ(Ca2+)的增加显著下降,锶/钙(Sr/Ca)比、镁/钙(Mg/Ca)比随ρ(Ca2+)增加而下降。结果表明,水体ρ(Ca2+)对褐牙鲆鱼体成分、耳石形成及组分产生明显影响,ρ(Ca2+)能够影响鱼体和耳石元素的累积。
Abstract:We investigated the effects of Ca2 + concentrations on element content of fish body and otolith of juvenile Paralichthys olivaceus that were raised at 20℃ in artificial seawater for 60 more days. Five groups of seawater with Ca2 + concentrations 200 mg·L-1 (group A), 400 mg·L-1 (group B, control), 800 mg·L-1 (group C), 1 600 mg·L-1 (group D), and 3 000 mg·L-1 (group E), were used for raise. It was found that with the increase of Ca2+ concentration, the contents of P, Na, Mg, Sr, Fe, Mn and Ni in fish body decreased, and that Ca2+ concentrations significantly influenced the otolith length, width, L/W and weight. Specifically, otolith length and width of juvenile P.olivaceus group A were significantly lower than that of group B and C; L/W was significantly lower than that of group D; and otolith weight was significantly lower than that of group B and D. Sr content of otolith, significantly, and the ratio of Sr/Ca and Mg/Ca also decreased with increasing concentration of Ca2+. The results indicate that Ca2+ concentrations affect juvenile P.olivaceus significantly in terms of its body and otolith element content formation, composition and accumulation.
-
Keywords:
- Paralichthys olivaceus /
- Ca2+ /
- fish body /
- otolith /
- element
-
转化生长因子β(transforming growth factor beta,TGF-β)超家族是一类多效应细胞因子,在抑制肿瘤、细胞增殖、细胞分化、组织形成、世系决定、细胞迁移和细胞凋亡等多种生理过程中发挥重要作用[1]。TGF-β超家族成员包括转化生长因子β(TGF-β)、活化素(activin)和节/骨形成蛋白(bone morphogenetic protein,BMP)3个家族。狭义上的TGF-β通常指的是TGF-β家族。TGF-β既能促进细胞增殖,又能抑制细胞增殖;能控制细胞外基质的形成,如促进胶原蛋白的合成;通过调节细胞外基质诱导细胞凋亡和调控形态发生;TGF-β也是一种神经蛋白,能刺激神经生长因子的形成[2]。研究表明,TGF-β系统与人类多种疾病有重大关联,如心脏疾病[3]、微血管疾病[4]和癌症[5]等。在哺乳动物中对TGF-β及其受体的报道每年有数百篇,足以说明TGF-β系统的重要性。近年来,有许多学者在低等脊椎动物中对TGF-β系统进行了研究,而鱼类具有其独特的生活环境和进化历史上的特殊意义,因此TGF-β系统在低等脊椎动物中的研究又集中在鱼类上。
1. TGF-β介绍
TGF-β第一次是从人胎盘中发现的[6],在哺乳动物中已发现了3种TGF-β(1/2/3),其中TGF-β1在免疫系统中发挥主要功能[7]。在鸟类中发现有3种TGF-β(TGF-β2/3/4),两栖类中发现有2种TGF-β(TGF-β2/5),已有证据表明鸟类的TGF-β4和两栖类的TGF-β5是TGF-β1进化的前体,因此也称之为TGF-β1[8]。到目前为止,在硬骨鱼中发现了4种TGF-β(TGF-β1/2/3/6)。
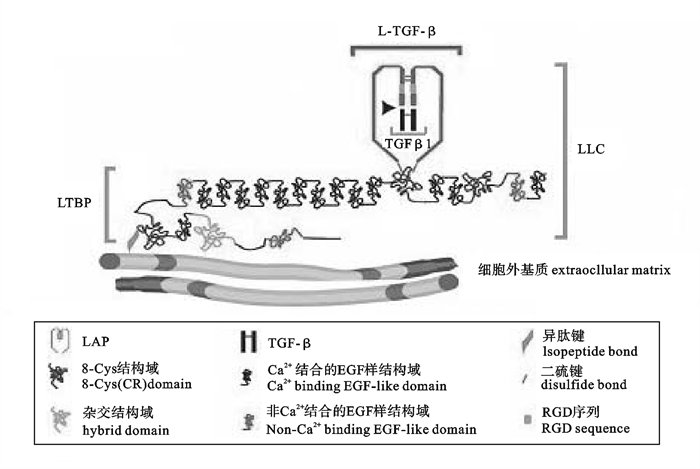
![]() 图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)
图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)哺乳动物TGF-β主要是由T细胞产生,但是在其他的细胞中都有表达。其他主要来源包括血小板、巨噬细胞、噬中性粒细胞、骨和软组织如胎盘、肾、子宫内膜和疾病细胞,通过自分泌和旁分泌的方式产生[2]。
哺乳动物中的3种TGF-β都可以在转录水平进行调控。TGF-β2和TGF-β3的启动子都包含有TATAA框和一个普通的近端CRE-ATF位点,这说明这些启动子都服从激素和发育调控[9]。TGF-β1的启动子缺少经典的TATAA框,但是有多元的调控位点,能够被c-jun、c-Fos和egr-1以及很多的致癌基因如abl、fos、jun、ras和src激活[10]。TGF-β1启动子的活性能被肿瘤抑制物所抑制[11]。低等脊椎动物中目前尚未见有关TGF-β转录调控方面的研究报道。
TGF-β是以前体蛋白的形式编码,每种TGF-β都是由一个单独的基因编码。TGF-β蛋白前体在细胞内经过一系列的加工过程后才分泌到细胞外。其中最重要的一步是前体蛋白的水解,将前体蛋白的N端切掉,是在高尔基体中由弗林蛋白酶(Furin-like peptidase)水解[12]。另有研究表明C型胶原蛋白酶也能裂解此位点[13],切掉的N端多肽又会形成二聚体,称为潜在关联蛋白(latency-associated protein,LAP),它与成熟TGF-β同型二聚体非共价结合,该复合体称为潜在的TGF-β(latent TGF-β,L-TGF-β)或小潜在复合体(small latent complex,SLC)。该复合体可以直接分泌到细胞外,或者再与潜在TGF-β结合蛋白(latent TGF-β binding protein,LTBP)相结合形成一个大的潜在复合体(large latent complex,LLC)而分泌,LTBP在使TGF-β靶向细胞外基质中发挥重要作用[14-15]。
哺乳类TGF-β1 LAP(LAP-1)的结构被广泛研究,LAP-1包含N端连接的糖链,其中2个含有甘露糖-6-磷酸基团,可以与细胞表面的甘露糖-6-磷酸盐/胰岛素样生长因子Ⅱ受体相互作用[16]。人类LAP-1含有3个半胱氨酸残基,223和225位置上的半胱氨酸对LAP形成链间二硫键十分重要。在223和225位置上的半胱氨酸用丝氨酸代替后,TGF-β1可直接以活性的形式分泌,表明这2个位置的半胱氨酸对LAP-1和TGF-β1的结合非常重要。此外,第33位的半胱氨酸与LTBP的结合有关[17]。LTBP具有15~19个表皮生长因子(EGF)样重复和多个半胱氨酸残基。LTBP的另一个功能是在高尔基体与L-TGF-β结合使SLC快速分泌。然而LTBP被广泛研究的功能是使L-TGF-β定位到细胞外基质,从而形成一个细胞外基质中的TGF-β库[18]。
TGF-β与LAP和LTBP结合时不能直接与受体结合,需要从复合物中释放出活性形式的TGF-β。在体外可以通过pH(2和8)、加热(100 ℃)或某些蛋白酶等条件使其释放[15]。至于在体环境是通过什么机制释放出活性的TGF-β,目前并没有确切的定论。但是学者们提出了几种假说,包括:1)通过反式谷氨酰胺酶水解活化假说[15];2)通过与血小板反应素物理接触改变LAP构想假说[19];3)表皮细胞αvβ6整联蛋白机械牵引假说[20-21]。
近期有报道MG63骨肉瘤细胞分泌到胞外的热休克蛋白HSP90β会抑制潜在TGF-β1的激活[22]。
2. TGF-β受体及信号通路
TGF-β受体的发现,最早是通过将125I-TGF-β化学交联到细胞表面的结合蛋白,再用凝胶电泳的方法分离交联上的配体受体复合体物,发现大多数细胞有3种膜表面的TGF-β结合蛋白,根据电泳的迁移率命名为Ⅰ型, Ⅱ型和Ⅲ型[23-24]。TGF-β Ⅰ型受体(TGF-β Receptor Ⅰ,TβRⅠ)和Ⅱ型受体(TGF-β Receptor Ⅱ,TβRⅡ)主要介导TGF-β的信号转导,这2种受体均为有单跨膜结构域的丝氨酸-苏氨酸激酶,氨基酸序列具有相当大的同源性[25]。一般TβRⅠ比TβRⅡ氨基酸序列要少。对人TβRⅡ氨基酸分析表明含有一个信号肽、一个136个氨基酸的N-糖基化的胞外结构域和一个主要是由激酶结构域组成的胞内结构域。2种受体胞外部分含有多个半胱氨酸,包括一个由3个半胱氨酸组成的半胱氨酸簇,表明受体自身的折叠和与配体的结合需要有很多二硫键。TβRⅠ和TβRⅡ均会形成同源二聚体,该二聚体的形成不依赖于配体结合。TβRⅠ在激酶结构域之前有一个SGSGSGLP的高度保守序列标签(GS结构域)[25]。TβRⅠ和TβRⅡ示意图见图 2-a。从目前研究结果来看,脊椎动物的TGF-β受体在结构上非常保守。
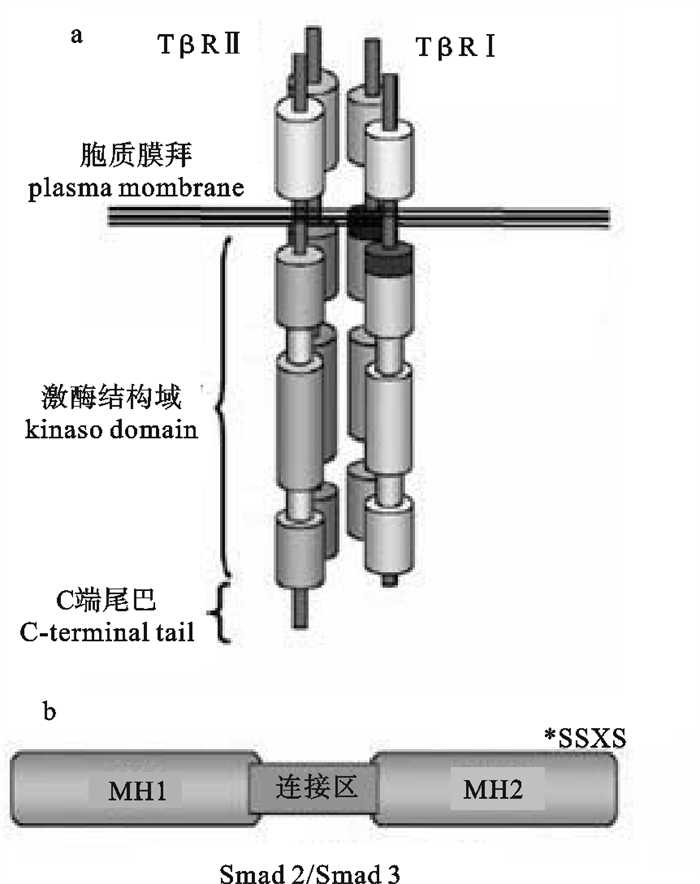
![]() 图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)
图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)TGF-β Ⅲ型受体(TGF-β Receptor Ⅲ,TβRⅢ),又称β蛋白聚糖,在很多种类的细胞中都有表达,是表达量最高的TGF-β受体。TβRⅢ也是跨膜受体,但是缺少酶的基序,不能直接与配体结合。因此认为TβRⅢ在TGF-β信号中发挥间接功能[25]。
成熟的TGF-β二聚体到达目标细胞表面时,与TβRⅡ同源二聚体结合,TβRⅡ激酶活性使其自身磷酸化,TGF-β-TβRⅡ复合物向TβRⅠ二聚体靠近,并磷酸化TβRⅠ而激活其激酶活性。因此活化的配体受体复合物是一个异源的六聚体,由1个TGF-β二聚体以及TβRⅠ和TβRⅡ各自的同源二聚体组成[27]。随后TβRⅠ磷酸化细胞内的Smad蛋白。脊椎动物Smad蛋白可以分为3个亚族:受体活化型Smad(R-Smad)、通用介导型Smad 4(Co-Smad)和抑制型Smad(Ⅰ-Smad,Smad 6和Smad 7)[28]。R-Smad包括BMP活化型(Smad 1、Smad 5、Smad 8)和TGF-β活化型(Smad 2、Smad 3)。R-Smad和Co-Smad是由2个Mad同源结构域(MH 1和MH 2)组成,通过连接区连接(图 2-b)。Ⅰ-Smad没有明显的MH1结构域,只有MH2结构域。非洲爪蟾(Xenopus laevis)有2种Smad 4,Smad 4α和Smad 4β,由2个基因编码。虽然2种Smad 4的氨基酸具有80%的同源性,但是其发育表达模式、亚细胞定位(Smad 4α主要在细胞质中,Smad 4β主要在细胞核中)和磷酸化水平截然不同。非洲爪蟾Smad 4β具有强的腹部形成诱导功能[29]。TβRⅠ磷酸化激活后使R-Smad C端SSXS基序磷酸化,SSXS基序在所有R-Smad中都是高度保守的,随后R-Smad与TβRI分离,与Smad 4形成复合物后进入细胞核,再与一些转录因子结合激活基因的转录[2]。尽管Co-Smad 4能够帮助R-Smad进入细胞核,但是R-Smad在没有Co-Smad 4的情况下也能进入到细胞核[20, 30]。R-Smad蛋白招募至受体复合物是由辅助蛋白介导的,例如Smad锚向受体活化蛋白(SARA)[31]。TGF-β与受体结合后,Smad 2和Smad 3被TβRⅠ磷酸化激活,再与Smad 4一起形成复合体进入细胞核,作用于Smad结合元件(Smad Binding Elements,SBE)。Ⅰ-Smad抑制TGF-β信号通过以下几种途径:1)与R-Smad竞争结合TβRⅠ;2)招募E3泛素连接酶Smurf 1/2使TβRⅠ泛素化而随之降解;3)与Smad 4作用,阻止R-Smad-Smad 4复合物的形成;4)直接抑制Smad引起的转录应答[20, 31]。一种重要抑制Smad功能的方式是招募Smad协同抑制因子,如c-Ski和SnoN[32-33]。
TGF-β信号的负调控有如下几个方面:1)通过Smurf途径使TGF-β受体降解;2)抑制TGF-β受体的活性;3)通过磷酸酶终结Smad信号;4)通过E3泛素连接酶关闭R-Smad和Smad 4;5)隔离Smad使其不参与活化的信号通路;6)抑制Smad的转录活性;7)Smad转录后修饰之间的竞争以及稳定性和活力之间的相互作用[31]。有些TGF-β的负调节因子,如Ⅰ-Smad和SnoN都是TGF-β直接作用的目的基因。
TGF-β除了能激活Smad依赖性通路外,也可以激活其他一些Smad非依赖性信号通路。已经证明,TGF-β刺激细胞后能快速激活Ras-Erk、TAK-MKK4-JNK、TAKMKK3/6-p38、Rho-Rac-cdc42 MAPK和PI3K-Akt通路,但是详细的机制目前并没有阐明[20]。TGF-β引起的Erk和JNK途径的激活可以导致Smad的磷酸化并调节Smad的激活。此外,TGF-β引起的Ras/Erk MAPK通路的激活会刺激TGF-β的表达,从而放大TGF-β的应答和导致二次TGF-β应答[34]。TGF-β1在CD4+T细胞中对IFN-γ引起的信号和Th1基因表达的抑制作用是Smad 3非依赖性的,但是MEK/ERK依赖性的[35]。最近又在小鼠(Mus muscculus)中发现TGF-β诱导IKK,p38和JNK的激活需要TAK1赖氨酸158残基[36]。
3. TGF-β及其受体在鱼类中的研究进展
3.1 TGF-β1在鱼类中的研究进展
TGF-β在鱼类中的研究还处于初步阶段,但是最近几年有关的研究也逐步增多,主要集中在TGF-β1。
3.1.1 与免疫和疾病相关
目前研究表明,TGF-β1与鱼类的免疫功能有着巨大的关系。ZHAN等[37]从鲤(Cyprinus carpio)活化的头肾淋巴细胞中克隆得到第一个鱼类的TGF-β1基因,其ORF编码376个氨基酸,包括与其他TGF-β蛋白一样的保守半胱氨酸。鲤TGF-β1在头肾、脾、卵和肝脏的表达量很少,但是用伴刀豆球蛋白A(Con A)激活头肾淋巴细胞后TGF-β1 mRNA水平会明显上升。HARMS等[38]从杂交狼鲈(Morone saxatilis×M.chrysops)头肾单核细胞中克隆到TGF-β1基因,其mRNA表达水平在外周血单核细胞中比脾和头肾中要高,初步显示TGF-β1的功能与免疫机制相关。笔者实验室也发现用聚肌胞苷酸(Poly I: C)或Con A刺激斜带石斑鱼(Epinephelus coioides)头肾淋巴细胞后,TGF-β1表达量明显上升,与在其他鱼中具有相似性[39]。YANG等[40]报道从草鱼(Ctenopharyngodon idellus)中克隆到TGF-β1 cDNA全长,组织分布表明TGF-β1 mRNA主要在胸腺、头肾和脾中大量分布,并发现重组人TGF-β1蛋白能诱导外周血淋巴细胞(PBL)增殖,但是也能显著抑制植物血凝集素(PHA)和脂多糖(LPS)刺激的PBL增殖,而且和脂多糖一样能显著上调草鱼MHCⅠmRNA表达。HADDAD等[41]从金鱼(Carassius auratus)中克隆到TGF-β1 cDNA序列。重组表达的金鱼TGF-β1成熟肽以剂量依存的方式促进金鱼成纤维细胞系(CCL71)的增殖。此外,重组的金鱼TGF-β1能够下调TNF-α活化的巨噬细胞一氧化氮应答。这是首次对硬骨鱼TGF-β1功能的报道。CAI等[42]报道真鲷(Pagrus major)的TGF-β1在诱导淋巴细胞迁移中具有两极特性。重组真鲷TGF-β1以剂量依赖的方式显著促进头肾和外周血淋巴细胞的迁移,但又能够抑制由LPS激活的淋巴细胞迁移。这是首次在鱼类中报道TGF-β1在调节鱼类免疫功能中具有天生的两极特性。最近,YANG等[43]又报道在草鱼白细胞中TGF-β1表现出对立的效应。TGF-β1能持续刺激外周血白细胞的活力和促炎症因子(TNF-α和IFN-γ)与T/B细胞标签[Cd4-like (Cd4l),Cd8α,Cd8β和Ig μ]的产生,但是在头肾白细胞中却相反。并表明TGF-β1可能通过下调ALK5 mRNA和蛋白水平,使草鱼白细胞对TGF-β1的敏感性下降。再次证明在硬骨鱼免疫功能中TGF-β1发挥正调控和负调控双重功能。
除了从理论上研究TGF-β1与免疫功能相关,有直接的研究表明TGF-β1与鱼类疾病有关。HARMS等[44]报道,用海鱼杆菌(Mycobacterium marinum)感染条纹狼鲈(M.saxatilis),其脾单核细胞TGF-β1 mRNA表达比未感染组要低,但是感染的杂交罗非鱼(Oreochromis spp.)和未感染鱼之间没有明显的变化。JOHNSON等[45]报道给大西洋油鲱(Brevoortia tyrannus)体腔注射去炎松导致其脾单核细胞TGF-β1 mRNA水平受到抑制,提示可能与大西洋油鲱发育过程中溃疡性皮肤损害的机制有关。LILLEENG等[46]报道在用大豆粉饲养大西洋鲑(Salmo salar)时TGF-β1明显下调,提示有可能和大西洋鲑大豆肠病的发病机理有关。已经报道用来源于欧鲶(Silurus glanis)和褐篮子鱼(Siganus fuscescens)的虹彩病毒(family Iridoviridae)刺激鱼的上皮瘤细胞后,引起TGF-β1短暂上升[47];嗜冷黄杆菌感染(Flavobacterium psychrophilum)的虹鳟(Oncorhynchus mykiss)脾脏TGF-β1下调,表明染病的鱼免疫系统变弱[48]。最近又发现TGF-β与藻毒素引起的免疫毒性效应有关,草鱼血和头肾淋巴细胞在藻毒素刺激后,TGF-β1 mRNA水平会上升[49]。这些证据表明很多鱼类在受到病害侵袭时,TGF-β1的表达水平都会有所变化,但是TGF-β1具体是如何参与到疾病的过程中,目前还没有阐明。
3.1.2 与生殖相关
TGF-β1除了与免疫和疾病相关之外,另一个主要功能是与生殖相关。KOULI等[50]从斑马鱼(Danio rerio)的卵巢中克隆到TGF-β1的cDNA序列,TGF-β1成熟肽区域与其他物种的相似度达到70%~85%。并发现TGF-β1能以剂量依赖和时间依赖的方式显著抑制促性腺激素和17α, 20β-二羟孕酮诱导的卵母细胞成熟,首次在鱼类中证明TGF-β1能调节卵母细胞的成熟。同时证明,TGF-β/Smad信号通路在斑马鱼卵巢中存在。TAN等[51]报道TGF-β1能够抑制膜黄体酮受体[membrane progestin receptors (mPRs)]β,而不能抑制受体α,以此来调节卵母细胞的成熟。JIN等[52]报道在斑马鱼卵泡细胞中TGF-β信号需要依赖动力蛋白轻链zkm23。研究TGF-β1在生殖中的作用对鱼类的繁殖育种有着重大意义。
3.1.3 与肝脏功能相关
最近,HOBBIE等[53]报道二甲基亚硝铵处理的青鳉(Oryzias latipes),肝脏TGF-β1表达升高,并且随着二甲基亚硝铵处理浓度的升高,胆囊上皮细胞、中间细胞、不成熟肝细胞和少量的成熟肝细胞中TGF-β1蛋白水平上升,显示TGF-β1与肝功能有关。
3.1.4 TGF-β1序列特点
从已经克隆到的鱼类TGF-β1cDNA序列分析发现,序列具有很高的保守性,与其他脊椎动物相似。它们均具有保守的9个半胱氨酸(草鱼和鲤在第7个保守半胱氨酸位点处被精氨酸代替),这也是TGF-β成员的一个标志性特征。其中的8个半胱氨酸以成对的方式形成分子中心区的4对链内二硫键,结合第9个半胱氨酸形成链间二硫键,一起形成TGF-β二聚体。前体肽均具有特征性标志成熟肽起始的KEX-Furin样蛋白酶识别位点RXXR。并且都具有整合素结合位点RGD,RGD能够与整合素特异结合,例如能够与αvβ6特异结合,从而使潜活型的TGF-β1活化[15]。而在大海马(Hippocampus kuda)TGF-β1序列中则由RSD取代了RGD[54],其中丝氨酸和甘氨酸具有相似的物理性质,都为亲水性的中性氨基酸,但转换的具体原因还不清楚。
3.2 TGF-β其他成员在鱼类中的研究进展
TGF-β家族的成员除了TGF-β1,常见的还有TGF-β2和TGF-β3。SUMATHY等[55]第一次从鲤中克隆得到TGF-β2基因,根据推测的氨基端列与人的TGF-β2基因比对,显示鲤TGF-β2前体蛋白和成熟蛋白与人的TGF-β2的前体蛋白和成熟蛋白相似度分别为81%和93%。LAING等[56]从钝吻鲟(Acipenser baeri)、虹鳟和欧洲鳗鲡(Anguilla anguilla)中克隆到部分核苷酸序列,证明TGF-β3在辐鳍亚纲的硬骨鱼中存在。LAING等[57]进一步在鲽(Pleuronectes platessa)中证明同时存在多种TGF-β基因。CHEAH等[58]报道在斑马鱼中克隆到TGF-β3 cDNA全长,显示该基因是由7个外显子组成,定位在14q24号染色体连锁群17的一部分。在转录起始位点的上游具有1个刺激蛋白1[Stimulating protein 1 (Sp1)]和2个TATA结合蛋白(TBP)的结合位点。TGF-β3在发育的胸鳍中大量表达,而没有在哺乳动物前肢中有类似的报道,表明TGF-β3在鱼类早期发育中具有新的功能。FUNKENSTEIN等[59]报道在金鲷(Sparus aurata)中发现一种新的TGF-β,其基因由7个外显子组成,预测编码420个氨基酸。基因组成与小鼠和鸡的TGF-β2相似,但氨基酸比对发现是一种新的在鱼类中特有的TGF-β,命名为TGF-β6,并发现TGF-β6能通过营养水平调节骨骼肌生长。目前还没有在其他脊椎动物中有关于TGF-β6的报道。
3.3 TGF-β受体在鱼类中的研究进展
对于鱼类TGF-β受体的研究还很少。最早是KOHLI等[50]在斑马鱼卵巢中克隆到TGF-β1的同时也克隆出TβRⅡ的cDNA序列,这是第一次在鱼类中报道的TβRⅡ,其激酶结构域与其他物种高度保守。MAEHR等[60]报道在虹鳟中克隆到2种TGF-β受体(TβRI和TβRⅡ)。从得到的虹鳟TβRI和TβRⅡ序列发现,其具备TβRI和TβRⅡ受体家族的所有特点,包括1个富含半胱氨酸的胞外结构域、1个跨膜结构域和1个丝氨酸/苏氨酸激酶结构域,并且激酶结构域高度保守。组织分布显示TβRI在胸腺和脾脏高表达;TβRⅡ在皮肤、胸腺和后肾中高表达,表明2种受体与免疫功能相关。同时2种受体在肌肉中都有很高表达,说明其与生长发育有关。同时,研究了各种刺激剂(LPS、Poly I: C、PHA、PMA、CI)刺激头肾淋巴细胞后对2种受体mRNA水平的影响,显示PHA、PMA、CI能下调2种受体的表达,首次深入了解2种受体在鱼类免疫过程中的调节情况。但是对TGF-β受体在鱼类中的研究还有待进一步深入。
4. 小结
TGF-β是一类非常重要的细胞因子,在脊椎动物的多种生理活动中都有所涉及。每年在哺乳动物中关于TGF-β系统相关的研究数以百计,其重要性可见一斑。而目前在硬骨鱼中对TGF-β通路的研究还处于初级阶段,其中大部分的研究都集中在TGF-β家族中的成员TGF-β1。对TGF-β1的研究主要集中在免疫疾病和生殖方面,最近也有涉及肝脏方面,而对TGF-β家族其他成员的研究较少。到目前为止,对于TGF-β受体在硬骨鱼中的研究只有在斑马鱼和虹鳟中有过报道。
由于进化过程中基因组复制的原因,鱼类中很多基因的拷贝数不同于哺乳动物。笔者实验室在尼罗罗非鱼(O.niloticus)中分离出2种TGF-β2和2种TGF-β3,并且在功能上也有差异(待发表)。因此,硬骨鱼中TGF-β系统还有很多是没有涉及到的,有待进一步研究。
由于TGF-β系统的重要性,未来在硬骨鱼中的研究,应该在理论研究的同时,紧密联系实际生产,向着抗病、促生长和繁殖育种等方向发展。
-
表 1 各处理组人工海水中钙离子浓度(X ±SD)
Table 1 Ca2+ concentration in different artificial seawater treatments
处理组/mg·L-1 treatments 200 A 400(对照 control) B 800 C 1 600 D 3 000 E 钙/镁Ca2+/Mg2+ 1/5.80 1/2.82 1/1.41 1/0.71 1/0.37 ρ(钙离子)/mg·L-1 Ca2+ 194±15 418±24 780±37 1 567±52 2 935±73 ρ(镁离子)/mg·L-1 Mg2+ 1 126±46 1 179±52 1 097±53 1 117±44 1 080±63 表 2 不同钙离子质量浓度下褐牙鲆鱼体主要元素成分的变化(X ±SD,n=3)
Table 2 Main element content of P.olivaceus in the artificial seawater with different Ca2+ concentrations
mg·g-1 处理组
treatmentsw(磷)
Pw(钙)
Caw(钠)
Naw(镁)
Mgw(锶)
SrA 21.18±0.99b 12.44±0.56a 4.63±0.32bc 1.43±0.06b 0.27±0.01c B 21.54±2.10b 12.52±0.99a 4.79±0.34c 1.47±0.14b 0.14±0.02b C 16.32±2.62ab 11.58±0.87a 3.25±0.60a 1.12±0.16ab 0.07±0.01a D 18.32±1.25ab 12.91±1.01a 4.00±0.15abc 1.25±0.08ab 0.07±0.01a E 14.03±1.48a 11.50±0.50a 3.44±0.41ab 0.98±0.11a 0.04±0.00a 注:同一行数字不同上标字母表示差异显著(P < 0.05);后表同此
Note:Values with different superscripts within the same line are singnificantly different(P < 0.05).The same case in the following tables.表 3 不同钙离子质量浓度下褐牙鲆鱼体微量元素成分的变化(X ±SD,n=3)
Table 3 Microelement content of P.olivaceus in the artificial seawater with different Ca2+ concentrations
μg·g-1 处理组
treatmentsw(铁)
Few(锌)
Znw(锰)
Mnw(铜)
Cuw(镍)
NiA 60.14±4.54b 56.97±1.14a 47.46±4.40b 9.29±2.47a 5.41±1.93b B 32.11±1.63a 58.84±0.39a 41.85±4.64ab 8.35±1.35a 2.67±0.11ab C 31.13±4.37a 42.80±4.00a 30.84±3.60a 3.99±0.40a 0.97±0.30a D 35.87±5.89a 48.68±11.42a 34.64±3.59ab 6.79±1.94a 0.73±0.48a E 32.09±3.29a 48.23±3.71a 32.36±3.54a 4.19±0.25a 1.20±0.24a 表 4 不同钙离子质量浓度下褐牙鲆耳石形态特征的变化(X ±SD)
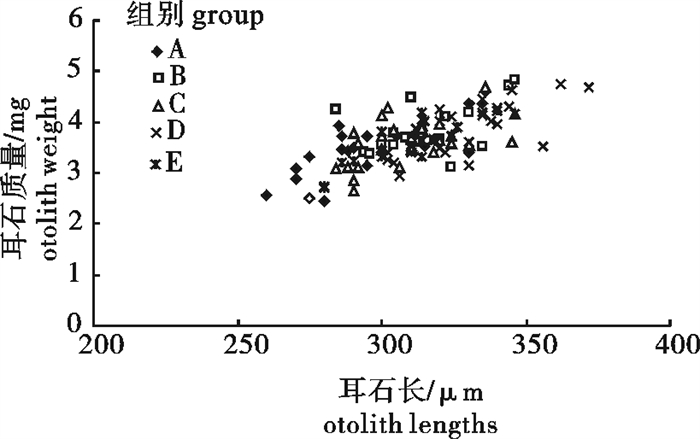
Table 4 The variation of otolith morphology of P.olivaceus in the artificial seawaterwith different Ca2+ concentrations
处理组
treatments体质量/g
body weight体长/cm
body length耳石长/μm
otolith length耳石宽/μm
otolith width耳石长/宽比(L/W)
length/width耳石质量/mg
otolith weightA 23.18±1.28a 13.78±0.29a 297.30±4.60a 205.57±3.02a 1.45±0.02a 3.48±0.12a B 24.99±1.27a 14.41±0.21a 321.83±8.26bc 216.17±2.41c 1.49±0.03ab 3.88±0.10b C 22.53±0.86a 13.73±0.18a 309.54±3.20ab 209.25±2.62abc 1.48±0.02ab 3.63±0.08ab D 25.05±1.01a 14.24±0.17a 327.52±3.31c 214.79±2.28bc 1.53±0.02b 3.86±0.09b E 22.48±0.84a 13.80±0.17a 308.06±4.58ab 206.88±3.32ab 1.49±0.01ab 3.59±0.12ab 表 5 不同钙离子质量浓度下褐牙鲆耳石主要元素成分的变化(X ±SD)
Table 5 Main element content in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrations
mg·g-1 处理组
treatmentsw(钙)
Caw(钠)
Naw(锶)
Srw(镁)
Mgw(铁)
FeA 26.05±0.13a 3.47±0.05a 2.54±0.03d 0.21±0.02ab 0.08±0.01a B 24.25±0.84a 3.52±0.04a 1.16±0.01c 0.23±0.01b 0.08±0.01a C 27.44±0.31a 3.54±0.03a 0.88±0.01b 0.31±0.01c 0.10±0.01a D 24.44±0.41a 3.60±0.00a 0.70±0.01a 0.19±0.01a 0.08±0.01a E 27.77±1.14a 3.64±0.16a 0.73±0.03a 0.21±0.01ab 0.09±0.01a 表 6 不同钙离子质量浓度下褐牙鲆耳石微量元素成分的变化(X ±SD)
Table 6 Microelement content in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrations
μg·g-1 处理组
treatmentsw(磷)
Pw(铜)
Cuw(锰)
Mnw(铅)
Pbw(镍)
NiA 51.18±2.39b 29.50±2.11a 19.09±0.52a 8.87±1.12b 1.81±0.40a B 44.41±3.37a 29.19±1.35a 21.45±3.33a 4.74±1.04a 1.02±0.21a C 55.44±1.52b 36.84±1.72b 18.01±1.02a 7.69±0.82b 0.83±0.42a D 42.49±0.78a 27.57±1.31a 20.27±1.92a 4.63±0.78a 1.27±0.33a E 38.78±2.31a 30.46±2.24a 15.77±2.53a 4.13±0.62a 1.01±0.37a 表 7 不同钙离子质量浓度下褐牙鲆耳石主要元素比例的变化(X ±SD)
Table 7 Element ratio in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrations
处理组
treatments锶/钙
Sr/Ca镁/钙
Mg/Ca铁/钙
Fe/Ca铜/钙
Cu/CaA 44.68±0.32e 13.59±1.02b 2.24±0.25a 0.72±0.05ab B 21.82±0.13d 15.71±0.11c 2.40±0.08a 0.75±0.00b C 14.62±0.39c 18.42±0.27d 2.60±0.09a 0.85±0.03c D 13.01±0.18b 12.91±0.10ab 2.34±0.15a 0.71±0.01ab E 12.11±0.25a 12.41±0.28a 2.24±0.09a 0.66±0.01a -
[1] 廖锐, 区又君. 鱼类耳石研究和应用进展[J]. 南方水产, 2008, 4(1): 69-75. doi: 10.3969/j.issn.2095-0780.2008.01.013 [2] LECOMTE-FINIGER R. The crystalline ultrastructure of otoliths of the eel, Anguilla anguilla L[J]. J Fish Biol, 1992, 40(2): 181-190. doi: 10.1111/j.1095-8649.1992.tb02565.x
[3] 张治国, 王卫民. 鱼类耳石研究综述[J]. 湛江海洋大学学报, 2001, 21(4): 77-83. doi: 10.3969/j.issn.1673-9159.2001.04.017 [4] 窦硕增. 鱼类的耳石信息分析及生活史重建——理论、方法与应用[J]. 海洋科学集刊, 2007(48): 93-113. https://d.wanfangdata.com.cn/periodical/ChpNaW5lclBlcmlvZGljYWxDSEkyMDIyMTAxMxIPaHlramprMjAwNzAxMDA5GghsenZrZmhvaQ%3D%3D [5] KALISH J M. Otolith microchemistry: validation of the effects of physiology, age and environmental on otolith composition[J]. J Exp Mar Biol Ecol, 1989, 132(3): 151-178. doi: 10.1016/0022-0981(89)90126-3
[6] SADOVY Y, SEVERIN K P. Trace elements in biogenic aragonite: correlation of body growth rate and strontium levels in the otoliths of the white grunt, Haemulon plumieri[J]. Bull Mar Sci, 1992, 50(2): 237-257. doi: 10.1029/92JC00372
[7] 付自东, 谢天明, 宋昭彬. 鱼类耳石元素指纹研究进展[J]. 应用与环境生物学报, 2007, 13(2): 278-283. doi: 10.3321/j.issn:1006-687X.2007.02.030 [8] FRIEDLAND K D, REDDIN D G, SHIMIZU N, et al. Strontium calcium ratios in Atlantic salmon (Salmo salar L. ) otoliths and observations on growth and maturation[J]. Can J Fish Aquat Sci, 1998, 55(5): 1158-1168. doi: 10.1139/f98-011
[9] GAO Y W, BEAMISH R J. Isotopic composition of otolith as a chemical tracer in population identification of sockeye salmon (Oncorhychus nerkas)[J]. Can J Fish Aquat Sci, 1999, 56(11): 2062-2068. doi: 10.1139/f99-145
[10] GALLAHAR N K, KINGSFORD M J. Patterns of increment width and strontium: calcium ratios in otoliths of juvenile rock blackfish, Girella elevat[J]. J Fish Biol, 1992, 41(5): 749-763. doi: 10.1111/j.1095-8649.1992.tb02704.x
[11] RADTKE R L, SHAFER D J. Environmental sensitivity of fish otolith micro-chemistry[J]. Aust J Mar Freshw Res, 1992, 43(5): 935-951. doi: 10.1071/MF9920935
[12] KALISH J M. Oxygen and carbon stable isotopes in the otoliths of wild and laboratory-reared Australian salmon (Arripis trutta)[J]. Mar Biol, 1991, 110(1): 37-47. doi: 10.1007/BF01313090
[13] SILVA J I, BALDISSEROTTO G B. Incubation of silver catfish, Rhamdia quelen (Pimelodidae), eggs at different calcium and magnesium concentrations[J]. Aquaculture, 2003, 228(1/2/3/4): 279-287. https://www.sciencedirect.com/science/article/pii/S0044848603002655
[14] 陈昌生, 纪德华, 王兴标. Ca2+, Mg2+对凡纳滨对虾存活及生长的影响[J]. 水产学报, 2004, 28(4): 413-418. doi: 10.3321/j.issn:1000-0615.2004.04.010 [15] DAVIS D A, SAOUD I P, BOYD C E, et al. Effects of potassium, magnesium and age on acclimation of Litopenaeus vannamei postlarvae to inland saline well-waters in west Alabama[J]. J World Aquac Soc, 2005, 36(3): 416-419.
[16] ROY L A, DAVIS D A, SAOUD I P, et al. Effects of varying levels of aqueous potassium and magnesium on survival, growth, and respiration of Litopenaeus vannamei reared in low salinity waters[J]. Aquaculture, 2007, 262(2/3/4): 461-469. https://www.sciencedirect.com/science/article/pii/S004484860600740X
[17] BROWN J A. Classification of juvenile fatfishes to estuarine and coastal habitats based on the elemental composition of otoliths[J]. Est Coast & Shelf Sci, 2006, 66(3/4): 594-611. https://www.sciencedirect.com/science/article/pii/S0272771405003744
[18] 张国华, 但胜国, 苗志国, 等. 6种鲤科鱼类耳石形态以及在种类和种群识别中的应用[J]. 水生生物学报, 1999, 23(6): 683-688. https://www.cqvip.com/QK/90584X/199906/4000776315.html [19] 郭弘义, 唐文乔, 魏凯, 等. 中国鲚属鱼类的矢耳石形态特征[J]. 动物学杂志, 2007, 42(1): 39-47. doi: 10.3969/j.issn.0250-3263.2007.01.006 [20] L′ABEE-LUND J H. Otolith shape discriminates between juvenile Atlantic salmon, Salmo salar, and brown trout, Salmo trutta L[J]. J Fish Biol, 1988, 33(6): 889-903. doi: 10.1111/j.1095-8649.1988.tb05538.x
[21] 邓维德, 赵亚辉, 康斌, 等. 耳石在鱼类年龄与生长研究中的应用[J]. 动物学杂志, 2010, 45(2): 171-180. http://dwxzz.ioz.ac.cn/dwxb/article/abstract/20100226?st=article_issue [22] 何文平. 鱼类耳石形态研究进展[J]. 安徽农业科学, 2012, 40(30): 14760-14762. doi: 10.3969/j.issn.0517-6611.2012.30.054 [23] WRIGHT P J, TALBOT C, THORPE J E. Otolith calification in Atlantic salmon parr, Salmo salar L., and its relation to photoperiod and calcium metabolism[J]. J Fish Biol, 1992, 40(5): 779-790. https://www.semanticscholar.org/paper/Otolith-calcification-in-Atlantic-salmon-parr%2C-L.-Wright-Talbot/419890df5bf3148b74c207922190000bebc04d12
[24] BEARNISH R J, NOAKES D J, MCFARLANE G A, et al. The regime concept and matural trends in the production of Pacific salmon[J]. Can J Fish Aquat Sci, 1999, 56(3): 516-526. doi: 10.1139/f98-200
[25] 叶振江, 孟晓梦, 高天翔, 等. 两种花鲈(Lateolabrax sp. )耳石形态的地理变异[J]. 海洋与湖沼, 2007, 38(4): 356-360. doi: 10.7666/d.y1112135 [26] STRANSKY C. Geographic variation of golden redfish (Sebastes marinus) and deep-sea redfish (S. mentella) in the North Atlantic based on otolith shape analysis[J]. J Mar Sci, 2005, 62(8): 1691-1698. https://academic.oup.com/icesjms/article/62/8/1691/795877
[27] 郭弘艺, 魏凯, 唐文乔, 等. 基于矢耳石形态特征的鲚属鱼类种类识别[J]. 动物分类学报, 2010, 35(1): 127-134. https://www.cqvip.com/QK/90158X/201001/32873025.html [28] KATAYAMA S, ISSHIKI T. Variation in otolith macrostructure of Japanese flounder (Paralichthys olivaceus): a method to discriminate between wild and released fish[J]. J Sea Res, 2007, 57(2/3): 180-186. https://www.sciencedirect.com/science/article/pii/S1385110106001456
[29] 区又君, 廖锐, 李加儿, 等. 珠江口棘头梅童鱼耳石的生长特性[J]. 动物学杂志, 2012, 47(1): 88-95. https://d.wanfangdata.com.cn/periodical/dwxzz201201011 [30] 区又君, 廖锐, 李加儿, 等. 黄唇鱼的耳石形态和微结构特征[J]. 广东农业科学, 2011, 38(12): 123-124. doi: 10.3969/j.issn.1004-874X.2011.12.045 [31] 区又君, 廖锐, 李加儿, 等. 4种石首鱼耳石形态特征的比较[J]. 华南农业大学学报, 2012, 33(2): 203-210. doi: 10.7671/j.issn.1001-411X.2012.02.018 [32] ADHAM K G, HASAN I F, TAHA N, et al. Impact of hazardous exposure to metals in the Nile and Delta Lakes on the catfish, Clarias Lazera[J]. Environ Monit Assess, 1999, 54(2): 107-124. doi: 10.1023/A:1005898430980
[33] RASHED M N. Cadmium and lead levels in fish Tilapia nilotica tissues as biological indicator for lake water pollution[J]. Environ Monit Assess, 2001, 68(1): 75-89. doi: 10.1023/A:1010739023662
[34] LAROCQUE A C L, RASMUSSEN P E. An overview of trace metals in the environment from mobilization to remediation[J]. Environ Geol, 1998, 33(2/3): 85-90. doi: 10.1007/s002540050227
[35] LIAO C M, LING M P. Assessment of human health risks for arsenic bioaccumulation in tilapia Oreochromis mossambicus and large-scale mullet Liza macrolepis from Blackfoot disease area in Taiwan[J]. Arch Environ Contam Toxicol, 2003, 45(2): 264-272. doi: 10.1007/s00244-003-0107-4
[36] BARRON M G, ALBEKE S. Calcium control of zinc uptake in rainbow trout[J]. Aquat Toxicol, 2000, 50(3): 257-264. https://www.sciencedirect.com/science/article/pii/S0166445X99000995
[37] PERSCHBACHER P W, WURTS W A. Effects of calcium and magnesium hardness on acute copper toxicity to juvenile channel catfish, Ictalurus punctatus[J]. Aquaculture, 1999, 172(3/4): 275-280. https://www.sciencedirect.com/science/article/abs/pii/S0044848698004992
[38] TEZNG W N. Temperature effect on the ineoproartion of sortntium in otolith of Japanese eel, Anguilla iaponica[J]. J Fish Biol, 1994, 45(6): 1055-1066. doi: 10.1111/j.1095-8649.1994.tb01072.x
[39] ARAI T, KOTAKE A, MORITA K. Evidence of downstream migration of Sakhalin taimen, Hucho perryias revealed by Sr : Ca ratios of otolith[J]. Ichyological Res, 2004, 51(4): 377-380. doi: 10.1007/s10228-004-0230-x
[40] 王巍令. 斑尾复鰕虎鱼耳石成分研究[D]. 青岛: 中国海洋大学, 2010. 10.7666/d.y1829722 [41] BISHAL G A, MCCONNAHA W E. Consideration of ocean conditions in the management of salmon[J]. Can J Fish Aquat Sci, 1998, 55(9): 2178-2186. doi: 10.1139/cjfas-55-9-2178
-
期刊类型引用(1)
1. 刘春晓,吕为群,杨志刚,陈阿琴. TGF-β/Smad信号通路响应光周期变化参与调控斑马鱼卵巢发育. 南方水产科学. 2019(03): 68-75 .  本站查看
本站查看
其他类型引用(10)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
