Studies on fin tissues cultivation, Ag-NORs and C-banding patterns of Pseudorasbora parva
-
摘要:
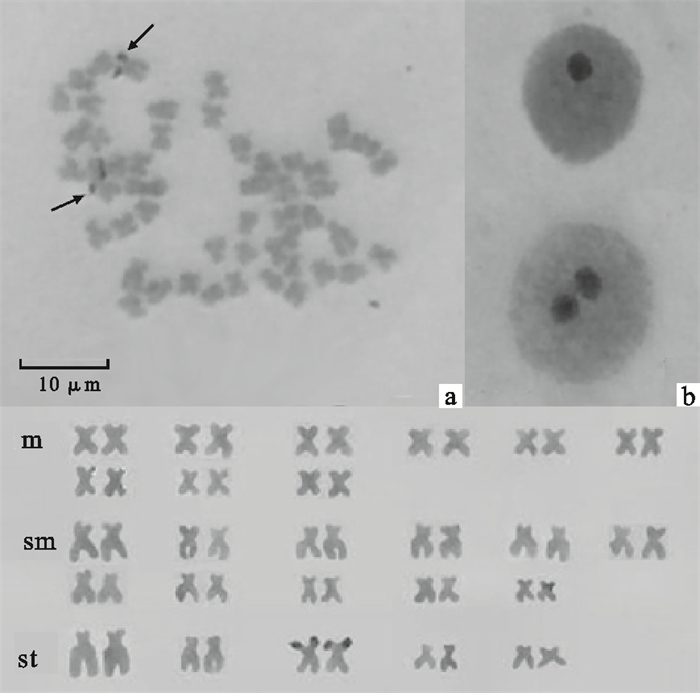
采用组织块贴壁培养法探索麦穗鱼(Pseudorasbora parva)鳍组织细胞的短期培养,同时对其染色体Ag-NORs和C-带进行了初步研究。结果显示:1)麦穗鱼鳍组织培养的最适培养基为MEM培养基,细胞在组织块贴壁后第6天迁出,经传代后细胞形态呈成纤维状;2)其染色体具有1对Ag-NORs,位于第23对染色体短臂末端,其NORs具多态性,未见Ag-NORs联合现象;3)其染色体C-带主要为端粒和着丝点C-带,少数为居间C-带,其中第23对染色体的短臂大部分呈现C-带强阳性,与Ag-NORs区域对应。
Abstract:We investigated short-term fin tissues cultivation of Pseudorasbora parva by explant technique, and studied its Ag-NORs, and C-banding patterns at the same time. Results are as follows: 1) Cells from the fin tissues of P.parva migrate out around tissues at 6th day through MEM medium, the most suitable one, and are fibroblast-like during cultivation; 2) A pair of Ag-NORs is found on the end of No.23 chromosome short arm, and the NORs are polymorphic, while no Ag-NORs combination has happened in this fish; 3) C-bands are located mainly in the terminal and centromere regions of chromosomes, and a few in the interstitial regions. In particular, most of the short arm on chromosome No.23 shows strong positive C-bands, which is corresponded with Ag-NORs region.
-
Keywords:
- Pseudorasbora parva /
- cell culture /
- chromosome /
- Ag-NORs /
- C-banding
-
转化生长因子β(transforming growth factor beta,TGF-β)超家族是一类多效应细胞因子,在抑制肿瘤、细胞增殖、细胞分化、组织形成、世系决定、细胞迁移和细胞凋亡等多种生理过程中发挥重要作用[1]。TGF-β超家族成员包括转化生长因子β(TGF-β)、活化素(activin)和节/骨形成蛋白(bone morphogenetic protein,BMP)3个家族。狭义上的TGF-β通常指的是TGF-β家族。TGF-β既能促进细胞增殖,又能抑制细胞增殖;能控制细胞外基质的形成,如促进胶原蛋白的合成;通过调节细胞外基质诱导细胞凋亡和调控形态发生;TGF-β也是一种神经蛋白,能刺激神经生长因子的形成[2]。研究表明,TGF-β系统与人类多种疾病有重大关联,如心脏疾病[3]、微血管疾病[4]和癌症[5]等。在哺乳动物中对TGF-β及其受体的报道每年有数百篇,足以说明TGF-β系统的重要性。近年来,有许多学者在低等脊椎动物中对TGF-β系统进行了研究,而鱼类具有其独特的生活环境和进化历史上的特殊意义,因此TGF-β系统在低等脊椎动物中的研究又集中在鱼类上。
1. TGF-β介绍
TGF-β第一次是从人胎盘中发现的[6],在哺乳动物中已发现了3种TGF-β(1/2/3),其中TGF-β1在免疫系统中发挥主要功能[7]。在鸟类中发现有3种TGF-β(TGF-β2/3/4),两栖类中发现有2种TGF-β(TGF-β2/5),已有证据表明鸟类的TGF-β4和两栖类的TGF-β5是TGF-β1进化的前体,因此也称之为TGF-β1[8]。到目前为止,在硬骨鱼中发现了4种TGF-β(TGF-β1/2/3/6)。
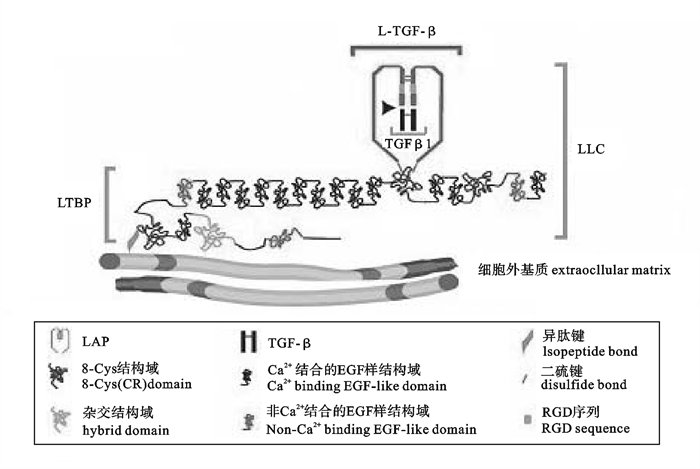
![]() 图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)
图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)哺乳动物TGF-β主要是由T细胞产生,但是在其他的细胞中都有表达。其他主要来源包括血小板、巨噬细胞、噬中性粒细胞、骨和软组织如胎盘、肾、子宫内膜和疾病细胞,通过自分泌和旁分泌的方式产生[2]。
哺乳动物中的3种TGF-β都可以在转录水平进行调控。TGF-β2和TGF-β3的启动子都包含有TATAA框和一个普通的近端CRE-ATF位点,这说明这些启动子都服从激素和发育调控[9]。TGF-β1的启动子缺少经典的TATAA框,但是有多元的调控位点,能够被c-jun、c-Fos和egr-1以及很多的致癌基因如abl、fos、jun、ras和src激活[10]。TGF-β1启动子的活性能被肿瘤抑制物所抑制[11]。低等脊椎动物中目前尚未见有关TGF-β转录调控方面的研究报道。
TGF-β是以前体蛋白的形式编码,每种TGF-β都是由一个单独的基因编码。TGF-β蛋白前体在细胞内经过一系列的加工过程后才分泌到细胞外。其中最重要的一步是前体蛋白的水解,将前体蛋白的N端切掉,是在高尔基体中由弗林蛋白酶(Furin-like peptidase)水解[12]。另有研究表明C型胶原蛋白酶也能裂解此位点[13],切掉的N端多肽又会形成二聚体,称为潜在关联蛋白(latency-associated protein,LAP),它与成熟TGF-β同型二聚体非共价结合,该复合体称为潜在的TGF-β(latent TGF-β,L-TGF-β)或小潜在复合体(small latent complex,SLC)。该复合体可以直接分泌到细胞外,或者再与潜在TGF-β结合蛋白(latent TGF-β binding protein,LTBP)相结合形成一个大的潜在复合体(large latent complex,LLC)而分泌,LTBP在使TGF-β靶向细胞外基质中发挥重要作用[14-15]。
哺乳类TGF-β1 LAP(LAP-1)的结构被广泛研究,LAP-1包含N端连接的糖链,其中2个含有甘露糖-6-磷酸基团,可以与细胞表面的甘露糖-6-磷酸盐/胰岛素样生长因子Ⅱ受体相互作用[16]。人类LAP-1含有3个半胱氨酸残基,223和225位置上的半胱氨酸对LAP形成链间二硫键十分重要。在223和225位置上的半胱氨酸用丝氨酸代替后,TGF-β1可直接以活性的形式分泌,表明这2个位置的半胱氨酸对LAP-1和TGF-β1的结合非常重要。此外,第33位的半胱氨酸与LTBP的结合有关[17]。LTBP具有15~19个表皮生长因子(EGF)样重复和多个半胱氨酸残基。LTBP的另一个功能是在高尔基体与L-TGF-β结合使SLC快速分泌。然而LTBP被广泛研究的功能是使L-TGF-β定位到细胞外基质,从而形成一个细胞外基质中的TGF-β库[18]。
TGF-β与LAP和LTBP结合时不能直接与受体结合,需要从复合物中释放出活性形式的TGF-β。在体外可以通过pH(2和8)、加热(100 ℃)或某些蛋白酶等条件使其释放[15]。至于在体环境是通过什么机制释放出活性的TGF-β,目前并没有确切的定论。但是学者们提出了几种假说,包括:1)通过反式谷氨酰胺酶水解活化假说[15];2)通过与血小板反应素物理接触改变LAP构想假说[19];3)表皮细胞αvβ6整联蛋白机械牵引假说[20-21]。
近期有报道MG63骨肉瘤细胞分泌到胞外的热休克蛋白HSP90β会抑制潜在TGF-β1的激活[22]。
2. TGF-β受体及信号通路
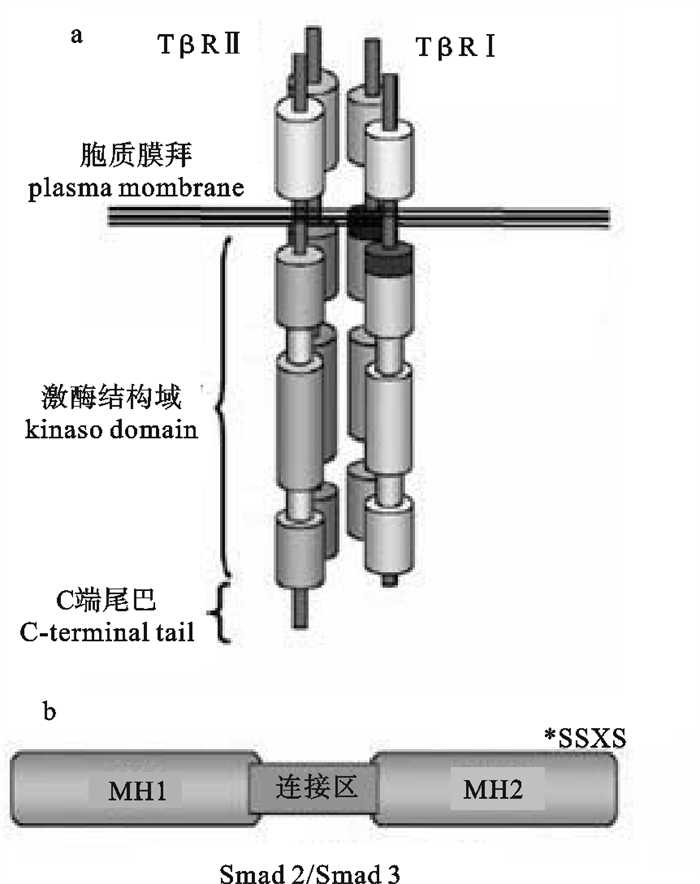
TGF-β受体的发现,最早是通过将125I-TGF-β化学交联到细胞表面的结合蛋白,再用凝胶电泳的方法分离交联上的配体受体复合体物,发现大多数细胞有3种膜表面的TGF-β结合蛋白,根据电泳的迁移率命名为Ⅰ型, Ⅱ型和Ⅲ型[23-24]。TGF-β Ⅰ型受体(TGF-β Receptor Ⅰ,TβRⅠ)和Ⅱ型受体(TGF-β Receptor Ⅱ,TβRⅡ)主要介导TGF-β的信号转导,这2种受体均为有单跨膜结构域的丝氨酸-苏氨酸激酶,氨基酸序列具有相当大的同源性[25]。一般TβRⅠ比TβRⅡ氨基酸序列要少。对人TβRⅡ氨基酸分析表明含有一个信号肽、一个136个氨基酸的N-糖基化的胞外结构域和一个主要是由激酶结构域组成的胞内结构域。2种受体胞外部分含有多个半胱氨酸,包括一个由3个半胱氨酸组成的半胱氨酸簇,表明受体自身的折叠和与配体的结合需要有很多二硫键。TβRⅠ和TβRⅡ均会形成同源二聚体,该二聚体的形成不依赖于配体结合。TβRⅠ在激酶结构域之前有一个SGSGSGLP的高度保守序列标签(GS结构域)[25]。TβRⅠ和TβRⅡ示意图见图 2-a。从目前研究结果来看,脊椎动物的TGF-β受体在结构上非常保守。
![]() 图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)
图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)TGF-β Ⅲ型受体(TGF-β Receptor Ⅲ,TβRⅢ),又称β蛋白聚糖,在很多种类的细胞中都有表达,是表达量最高的TGF-β受体。TβRⅢ也是跨膜受体,但是缺少酶的基序,不能直接与配体结合。因此认为TβRⅢ在TGF-β信号中发挥间接功能[25]。
成熟的TGF-β二聚体到达目标细胞表面时,与TβRⅡ同源二聚体结合,TβRⅡ激酶活性使其自身磷酸化,TGF-β-TβRⅡ复合物向TβRⅠ二聚体靠近,并磷酸化TβRⅠ而激活其激酶活性。因此活化的配体受体复合物是一个异源的六聚体,由1个TGF-β二聚体以及TβRⅠ和TβRⅡ各自的同源二聚体组成[27]。随后TβRⅠ磷酸化细胞内的Smad蛋白。脊椎动物Smad蛋白可以分为3个亚族:受体活化型Smad(R-Smad)、通用介导型Smad 4(Co-Smad)和抑制型Smad(Ⅰ-Smad,Smad 6和Smad 7)[28]。R-Smad包括BMP活化型(Smad 1、Smad 5、Smad 8)和TGF-β活化型(Smad 2、Smad 3)。R-Smad和Co-Smad是由2个Mad同源结构域(MH 1和MH 2)组成,通过连接区连接(图 2-b)。Ⅰ-Smad没有明显的MH1结构域,只有MH2结构域。非洲爪蟾(Xenopus laevis)有2种Smad 4,Smad 4α和Smad 4β,由2个基因编码。虽然2种Smad 4的氨基酸具有80%的同源性,但是其发育表达模式、亚细胞定位(Smad 4α主要在细胞质中,Smad 4β主要在细胞核中)和磷酸化水平截然不同。非洲爪蟾Smad 4β具有强的腹部形成诱导功能[29]。TβRⅠ磷酸化激活后使R-Smad C端SSXS基序磷酸化,SSXS基序在所有R-Smad中都是高度保守的,随后R-Smad与TβRI分离,与Smad 4形成复合物后进入细胞核,再与一些转录因子结合激活基因的转录[2]。尽管Co-Smad 4能够帮助R-Smad进入细胞核,但是R-Smad在没有Co-Smad 4的情况下也能进入到细胞核[20, 30]。R-Smad蛋白招募至受体复合物是由辅助蛋白介导的,例如Smad锚向受体活化蛋白(SARA)[31]。TGF-β与受体结合后,Smad 2和Smad 3被TβRⅠ磷酸化激活,再与Smad 4一起形成复合体进入细胞核,作用于Smad结合元件(Smad Binding Elements,SBE)。Ⅰ-Smad抑制TGF-β信号通过以下几种途径:1)与R-Smad竞争结合TβRⅠ;2)招募E3泛素连接酶Smurf 1/2使TβRⅠ泛素化而随之降解;3)与Smad 4作用,阻止R-Smad-Smad 4复合物的形成;4)直接抑制Smad引起的转录应答[20, 31]。一种重要抑制Smad功能的方式是招募Smad协同抑制因子,如c-Ski和SnoN[32-33]。
TGF-β信号的负调控有如下几个方面:1)通过Smurf途径使TGF-β受体降解;2)抑制TGF-β受体的活性;3)通过磷酸酶终结Smad信号;4)通过E3泛素连接酶关闭R-Smad和Smad 4;5)隔离Smad使其不参与活化的信号通路;6)抑制Smad的转录活性;7)Smad转录后修饰之间的竞争以及稳定性和活力之间的相互作用[31]。有些TGF-β的负调节因子,如Ⅰ-Smad和SnoN都是TGF-β直接作用的目的基因。
TGF-β除了能激活Smad依赖性通路外,也可以激活其他一些Smad非依赖性信号通路。已经证明,TGF-β刺激细胞后能快速激活Ras-Erk、TAK-MKK4-JNK、TAKMKK3/6-p38、Rho-Rac-cdc42 MAPK和PI3K-Akt通路,但是详细的机制目前并没有阐明[20]。TGF-β引起的Erk和JNK途径的激活可以导致Smad的磷酸化并调节Smad的激活。此外,TGF-β引起的Ras/Erk MAPK通路的激活会刺激TGF-β的表达,从而放大TGF-β的应答和导致二次TGF-β应答[34]。TGF-β1在CD4+T细胞中对IFN-γ引起的信号和Th1基因表达的抑制作用是Smad 3非依赖性的,但是MEK/ERK依赖性的[35]。最近又在小鼠(Mus muscculus)中发现TGF-β诱导IKK,p38和JNK的激活需要TAK1赖氨酸158残基[36]。
3. TGF-β及其受体在鱼类中的研究进展
3.1 TGF-β1在鱼类中的研究进展
TGF-β在鱼类中的研究还处于初步阶段,但是最近几年有关的研究也逐步增多,主要集中在TGF-β1。
3.1.1 与免疫和疾病相关
目前研究表明,TGF-β1与鱼类的免疫功能有着巨大的关系。ZHAN等[37]从鲤(Cyprinus carpio)活化的头肾淋巴细胞中克隆得到第一个鱼类的TGF-β1基因,其ORF编码376个氨基酸,包括与其他TGF-β蛋白一样的保守半胱氨酸。鲤TGF-β1在头肾、脾、卵和肝脏的表达量很少,但是用伴刀豆球蛋白A(Con A)激活头肾淋巴细胞后TGF-β1 mRNA水平会明显上升。HARMS等[38]从杂交狼鲈(Morone saxatilis×M.chrysops)头肾单核细胞中克隆到TGF-β1基因,其mRNA表达水平在外周血单核细胞中比脾和头肾中要高,初步显示TGF-β1的功能与免疫机制相关。笔者实验室也发现用聚肌胞苷酸(Poly I: C)或Con A刺激斜带石斑鱼(Epinephelus coioides)头肾淋巴细胞后,TGF-β1表达量明显上升,与在其他鱼中具有相似性[39]。YANG等[40]报道从草鱼(Ctenopharyngodon idellus)中克隆到TGF-β1 cDNA全长,组织分布表明TGF-β1 mRNA主要在胸腺、头肾和脾中大量分布,并发现重组人TGF-β1蛋白能诱导外周血淋巴细胞(PBL)增殖,但是也能显著抑制植物血凝集素(PHA)和脂多糖(LPS)刺激的PBL增殖,而且和脂多糖一样能显著上调草鱼MHCⅠmRNA表达。HADDAD等[41]从金鱼(Carassius auratus)中克隆到TGF-β1 cDNA序列。重组表达的金鱼TGF-β1成熟肽以剂量依存的方式促进金鱼成纤维细胞系(CCL71)的增殖。此外,重组的金鱼TGF-β1能够下调TNF-α活化的巨噬细胞一氧化氮应答。这是首次对硬骨鱼TGF-β1功能的报道。CAI等[42]报道真鲷(Pagrus major)的TGF-β1在诱导淋巴细胞迁移中具有两极特性。重组真鲷TGF-β1以剂量依赖的方式显著促进头肾和外周血淋巴细胞的迁移,但又能够抑制由LPS激活的淋巴细胞迁移。这是首次在鱼类中报道TGF-β1在调节鱼类免疫功能中具有天生的两极特性。最近,YANG等[43]又报道在草鱼白细胞中TGF-β1表现出对立的效应。TGF-β1能持续刺激外周血白细胞的活力和促炎症因子(TNF-α和IFN-γ)与T/B细胞标签[Cd4-like (Cd4l),Cd8α,Cd8β和Ig μ]的产生,但是在头肾白细胞中却相反。并表明TGF-β1可能通过下调ALK5 mRNA和蛋白水平,使草鱼白细胞对TGF-β1的敏感性下降。再次证明在硬骨鱼免疫功能中TGF-β1发挥正调控和负调控双重功能。
除了从理论上研究TGF-β1与免疫功能相关,有直接的研究表明TGF-β1与鱼类疾病有关。HARMS等[44]报道,用海鱼杆菌(Mycobacterium marinum)感染条纹狼鲈(M.saxatilis),其脾单核细胞TGF-β1 mRNA表达比未感染组要低,但是感染的杂交罗非鱼(Oreochromis spp.)和未感染鱼之间没有明显的变化。JOHNSON等[45]报道给大西洋油鲱(Brevoortia tyrannus)体腔注射去炎松导致其脾单核细胞TGF-β1 mRNA水平受到抑制,提示可能与大西洋油鲱发育过程中溃疡性皮肤损害的机制有关。LILLEENG等[46]报道在用大豆粉饲养大西洋鲑(Salmo salar)时TGF-β1明显下调,提示有可能和大西洋鲑大豆肠病的发病机理有关。已经报道用来源于欧鲶(Silurus glanis)和褐篮子鱼(Siganus fuscescens)的虹彩病毒(family Iridoviridae)刺激鱼的上皮瘤细胞后,引起TGF-β1短暂上升[47];嗜冷黄杆菌感染(Flavobacterium psychrophilum)的虹鳟(Oncorhynchus mykiss)脾脏TGF-β1下调,表明染病的鱼免疫系统变弱[48]。最近又发现TGF-β与藻毒素引起的免疫毒性效应有关,草鱼血和头肾淋巴细胞在藻毒素刺激后,TGF-β1 mRNA水平会上升[49]。这些证据表明很多鱼类在受到病害侵袭时,TGF-β1的表达水平都会有所变化,但是TGF-β1具体是如何参与到疾病的过程中,目前还没有阐明。
3.1.2 与生殖相关
TGF-β1除了与免疫和疾病相关之外,另一个主要功能是与生殖相关。KOULI等[50]从斑马鱼(Danio rerio)的卵巢中克隆到TGF-β1的cDNA序列,TGF-β1成熟肽区域与其他物种的相似度达到70%~85%。并发现TGF-β1能以剂量依赖和时间依赖的方式显著抑制促性腺激素和17α, 20β-二羟孕酮诱导的卵母细胞成熟,首次在鱼类中证明TGF-β1能调节卵母细胞的成熟。同时证明,TGF-β/Smad信号通路在斑马鱼卵巢中存在。TAN等[51]报道TGF-β1能够抑制膜黄体酮受体[membrane progestin receptors (mPRs)]β,而不能抑制受体α,以此来调节卵母细胞的成熟。JIN等[52]报道在斑马鱼卵泡细胞中TGF-β信号需要依赖动力蛋白轻链zkm23。研究TGF-β1在生殖中的作用对鱼类的繁殖育种有着重大意义。
3.1.3 与肝脏功能相关
最近,HOBBIE等[53]报道二甲基亚硝铵处理的青鳉(Oryzias latipes),肝脏TGF-β1表达升高,并且随着二甲基亚硝铵处理浓度的升高,胆囊上皮细胞、中间细胞、不成熟肝细胞和少量的成熟肝细胞中TGF-β1蛋白水平上升,显示TGF-β1与肝功能有关。
3.1.4 TGF-β1序列特点
从已经克隆到的鱼类TGF-β1cDNA序列分析发现,序列具有很高的保守性,与其他脊椎动物相似。它们均具有保守的9个半胱氨酸(草鱼和鲤在第7个保守半胱氨酸位点处被精氨酸代替),这也是TGF-β成员的一个标志性特征。其中的8个半胱氨酸以成对的方式形成分子中心区的4对链内二硫键,结合第9个半胱氨酸形成链间二硫键,一起形成TGF-β二聚体。前体肽均具有特征性标志成熟肽起始的KEX-Furin样蛋白酶识别位点RXXR。并且都具有整合素结合位点RGD,RGD能够与整合素特异结合,例如能够与αvβ6特异结合,从而使潜活型的TGF-β1活化[15]。而在大海马(Hippocampus kuda)TGF-β1序列中则由RSD取代了RGD[54],其中丝氨酸和甘氨酸具有相似的物理性质,都为亲水性的中性氨基酸,但转换的具体原因还不清楚。
3.2 TGF-β其他成员在鱼类中的研究进展
TGF-β家族的成员除了TGF-β1,常见的还有TGF-β2和TGF-β3。SUMATHY等[55]第一次从鲤中克隆得到TGF-β2基因,根据推测的氨基端列与人的TGF-β2基因比对,显示鲤TGF-β2前体蛋白和成熟蛋白与人的TGF-β2的前体蛋白和成熟蛋白相似度分别为81%和93%。LAING等[56]从钝吻鲟(Acipenser baeri)、虹鳟和欧洲鳗鲡(Anguilla anguilla)中克隆到部分核苷酸序列,证明TGF-β3在辐鳍亚纲的硬骨鱼中存在。LAING等[57]进一步在鲽(Pleuronectes platessa)中证明同时存在多种TGF-β基因。CHEAH等[58]报道在斑马鱼中克隆到TGF-β3 cDNA全长,显示该基因是由7个外显子组成,定位在14q24号染色体连锁群17的一部分。在转录起始位点的上游具有1个刺激蛋白1[Stimulating protein 1 (Sp1)]和2个TATA结合蛋白(TBP)的结合位点。TGF-β3在发育的胸鳍中大量表达,而没有在哺乳动物前肢中有类似的报道,表明TGF-β3在鱼类早期发育中具有新的功能。FUNKENSTEIN等[59]报道在金鲷(Sparus aurata)中发现一种新的TGF-β,其基因由7个外显子组成,预测编码420个氨基酸。基因组成与小鼠和鸡的TGF-β2相似,但氨基酸比对发现是一种新的在鱼类中特有的TGF-β,命名为TGF-β6,并发现TGF-β6能通过营养水平调节骨骼肌生长。目前还没有在其他脊椎动物中有关于TGF-β6的报道。
3.3 TGF-β受体在鱼类中的研究进展
对于鱼类TGF-β受体的研究还很少。最早是KOHLI等[50]在斑马鱼卵巢中克隆到TGF-β1的同时也克隆出TβRⅡ的cDNA序列,这是第一次在鱼类中报道的TβRⅡ,其激酶结构域与其他物种高度保守。MAEHR等[60]报道在虹鳟中克隆到2种TGF-β受体(TβRI和TβRⅡ)。从得到的虹鳟TβRI和TβRⅡ序列发现,其具备TβRI和TβRⅡ受体家族的所有特点,包括1个富含半胱氨酸的胞外结构域、1个跨膜结构域和1个丝氨酸/苏氨酸激酶结构域,并且激酶结构域高度保守。组织分布显示TβRI在胸腺和脾脏高表达;TβRⅡ在皮肤、胸腺和后肾中高表达,表明2种受体与免疫功能相关。同时2种受体在肌肉中都有很高表达,说明其与生长发育有关。同时,研究了各种刺激剂(LPS、Poly I: C、PHA、PMA、CI)刺激头肾淋巴细胞后对2种受体mRNA水平的影响,显示PHA、PMA、CI能下调2种受体的表达,首次深入了解2种受体在鱼类免疫过程中的调节情况。但是对TGF-β受体在鱼类中的研究还有待进一步深入。
4. 小结
TGF-β是一类非常重要的细胞因子,在脊椎动物的多种生理活动中都有所涉及。每年在哺乳动物中关于TGF-β系统相关的研究数以百计,其重要性可见一斑。而目前在硬骨鱼中对TGF-β通路的研究还处于初级阶段,其中大部分的研究都集中在TGF-β家族中的成员TGF-β1。对TGF-β1的研究主要集中在免疫疾病和生殖方面,最近也有涉及肝脏方面,而对TGF-β家族其他成员的研究较少。到目前为止,对于TGF-β受体在硬骨鱼中的研究只有在斑马鱼和虹鳟中有过报道。
由于进化过程中基因组复制的原因,鱼类中很多基因的拷贝数不同于哺乳动物。笔者实验室在尼罗罗非鱼(O.niloticus)中分离出2种TGF-β2和2种TGF-β3,并且在功能上也有差异(待发表)。因此,硬骨鱼中TGF-β系统还有很多是没有涉及到的,有待进一步研究。
由于TGF-β系统的重要性,未来在硬骨鱼中的研究,应该在理论研究的同时,紧密联系实际生产,向着抗病、促生长和繁殖育种等方向发展。
-
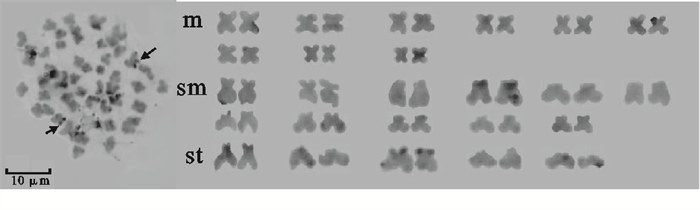
表 1 培养于不同培养基中的麦穗鱼鳍组织迁出细胞比较
Table 1 Comparison of cell migrated proportion from fin tissues of P.parva when cultured in different media
M199 MEM DMEM-F12 L-15 RPIM-1640 +++ ++++++ +++ ++ 无 注:+. 14 d后组织块周围迁出的细胞占培养瓶底面面积的2%
Note:+. the area of cells around the tissue accounted for 2% of the bottle base area 14 days later. -
[1] 解玉浩. 东北地区淡水鱼类[M]. 沈阳: 科学技术出版社, 2007: 160-162. [2] BRITTON J R, DAVIES G D, BRAZIER M. Towards the successful control of the invasive Pseudorasbora parva in the UK[J]. Biol Invas, 2010, 12(1): 125-131. doi: 10.1007/s10530-009-9436-1
[3] BOLTACHEV A R, DANILYUK O N, PAKHORUKOV N P, et al. Distribution and certain features of the morphology and biology of the stone moroco Pseudorasbora parva (cypriniformes, cyprinidae) in the waters of Crimea[J]. Ichthyology, 2006, 46(1): 58-63. doi: 10.1134/S0032945206010085
[4] 肖艺. 匙吻鲟鳍条组织细胞系的建立及其生物学特征[D]. 武汉: 华中农业大学, 2010. 10.7666/d.y2004172 [5] FENT K. Fish cell lines as versatile tools in ecotoxicology. Assessment of cytochrome P4501A induction potential and estrogenic activity of chemicals and environmental samples[J]. Toxicol In Vitro, 2001, 15(4/5): 477-488. doi: 10.1016/S0887-2333(01)00053-4
[6] 牛文涛, 蔡泽平. 中国海水鱼类核型研究概述[J]. 厦门大学学报: 自然科学版, 2006, 45(2): 125-131. doi: 10.3321/j.issn:0438-0479.2006.z2.017 [7] 余先觉, 周暾, 李渝成, 等. 中国淡水鱼类染色体[M]. 北京: 科学出版社, 1989: 4-9. https://www.zhangqiaokeyan.com/book-cn/08150144262.html [8] EARLEY E M. Chromosome preparations from monolayer cell cultures[J]. TCA Manual, 1975, 1(1): 31-35. doi: 10.1007/BF00914434
[9] HOWELL W, BLACK M. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: a 1-step method[J]. Experientia, 1980, 36(8): 1014-1015. doi: 10.1007/BF01953855
[10] SUMNER A T. A simple technique for demonstrating centromeric heterochromatin[J]. Exp Cell Res, 1972, 75 (1): 304-306. doi: 10.1016/0014-4827(72)90558-7
[11] 杨坤, 王子健, 祝东梅, 等. 麦穗鱼的组型分析和DNA含量测定[J]. 华中农业大学学报: 自然科学版, 2012, 31(3): 371-375. doi: 10.3969/j.issn.1000-2421.2012.03.019 [12] WOLF K, QUIMBY M C. Established eurythermic line of fish cells in vitro[J]. Science, 1962, 135(23): 1065-1066. doi: 10.1126/science.135.3508.1065
[13] FRYER J L, LANNAN C N. Three decades of fish cell culture: a current listing of cell lines derived from fishes[J]. Tissue Culture Methods, 1994, 16(2): 87-94. doi: 10.1007/BF01404816
[14] 张念慈, 杨广智. 草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立和特性观察[J]. 水产学报, 1981, 5(2): 111-119. http://qikan.cqvip.com/Qikan/Article/Detail?id=15124164 [15] 艾庆辉, 李庆飞, 麦康森. 鱼类细胞培养技术研究进展[J]. 渔业科学进展, 2012, 33(3): 122-128. doi: 10.3969/j.issn.1000-7075.2012.03.018 [16] 孙爱. 大黄鱼(Pseudosciaena crocea)三种组织细胞系的建立、鉴定及其应用的初步研究[D]. 青岛: 中国海洋大学, 2010. 10.7666/d.y1828771 [17] 常重杰, 杜启艳, 余其兴. 泥鳅的Ag-NORs带和C-带研究[J]. 河南师范大学学报: 自然科学版, 2000, 28(2): 71-73. doi: 10.3969/j.issn.1000-2367.2000.02.017 [18] 耿德贵, 朱玉山, 刘贤德. 鲶鱼染色体的显带研究[J]. 动物学杂志, 1999, 34(2): 54-57. doi: 10.3969/j.issn.0250-3263.1999.02.017 [19] 陈友铃, 吴文珊, 汪彦愔. 言密鲈(Colisa ladia)的核型和Ag-NORs带型的研究[J]. 福建师范大学学报: 自然科学版, 2006, 22(1): 87-90. doi: 10.3969/j.issn.1000-5277.2006.01.021 [20] 王佳君. 准格尔雅罗鱼的核型和带型研究[D]. 石河子: 石河子大学, 2011. https://www.cqvip.com/doc/journal/968275194 [21] 任修海, 崔建勋, 余其兴. 六种鲤科鱼类核仁组织者区的研究[J]. 遗传, 1993, 15(4): 11-13. https://www.cqvip.com/QK/92614X/19934/1218359.html [22] HENDERSON A S, WARBURTON D, ATWOOD K C. Localization of rDNA in the chromosome complement of the Rhesus (Macaca mulatta)[J]. Chromosoma, 1974, 44(4): 367-370. doi: 10.1007/BF00284896
[23] HSU T C, SPITITO S E, PARDUE M L. Distribution of 18+28S ribosomal genes in mammalian genomes[J]. Chromosoma, 1975, 53(1): 25-36. doi: 10.1007/BF00329388
[24] 任修海, 余其兴, 韦萍. 黄鳝染色体Ag-NORs多态性的研究[J]. 遗传学报, 1991, 18(4): 304-311. http://www.cqvip.com/qk/95085X/19911804/647079.html [25] TAKAI A, OJIMA Y. Some features on the nucleolus organizer regions in the chromosomes of the cyprinid fishes[J]. Proc Jpn Acad, Ser. B: Phys Biol Sci, 1984, 60(10): 410-413. doi: 10.2183/pjab.60.410
[26] AMEMIYA C T, GOLD J R. Cytogenetic studies in North American minnows (Cyprinidae) ⅩⅦ. chromosomal NOR phenotypes of 12 species, with comments on cytosystematic relationships among 50 species[J]. Hereditas, 1990, 112(3): 231-247. https://www.researchgate.net/publication/230076824_Cytogenetic_studies_in_North_American_minnows_Cyprinidae_XVII_Chromosomal_NOR_phenotypes_of_12_species_with_comments_on_cytosystematic_relationships_among_50_species
[27] 昝瑞光. 滇池两种类型鲫鱼的性染色体和C-带核型研究[J]. 遗传学报, 1982, 9(1): 32-39. https://www.cnki.com.cn/Article/CJFDTotal-YCXB198201005.htm [28] CUELLAR O, UYENO T. Triploidy in rainbow trout[J]. Cytogenetics, 1972, 11(6): 508-515. doi: 10.1159/000130217
[29] GARRIDO-RAMOS M A, JAMILENA M, LOZANO R, et al. Cytogenetic analysis of gilthead seabream Sparus aurata (Pisces, Perciforms), a deletion affecting the NOR in a hatchery stock[J]. Cytogenet Cell Genet, 1995, 68(1/2): 3-7. doi: 10.1159/000133877
[30] SHI L M, YE Y Y, DUAN X S. Comparative cytogenetic studies on the red muntjac, Chinese muntjac and their F1 hybrids[J]. Cytogenet Cell Genet, 1980, 26(1): 22-27. doi: 10.1159/000131417
[31] 郭明兰, 游欣欣, 苏永全, 等. 川纹笛鲷染色体核型、银染和C-带[J]. 热带海洋学报, 2011, 30(1): 91-95. doi: 10.3969/j.issn.1009-5470.2011.01.012 -
期刊类型引用(1)
1. 刘春晓,吕为群,杨志刚,陈阿琴. TGF-β/Smad信号通路响应光周期变化参与调控斑马鱼卵巢发育. 南方水产科学. 2019(03): 68-75 .  本站查看
本站查看
其他类型引用(10)



 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
