Growth traits research of the breeding group sub 2 generation of large yellow croaker (Larimichthys crocea)
-
摘要:
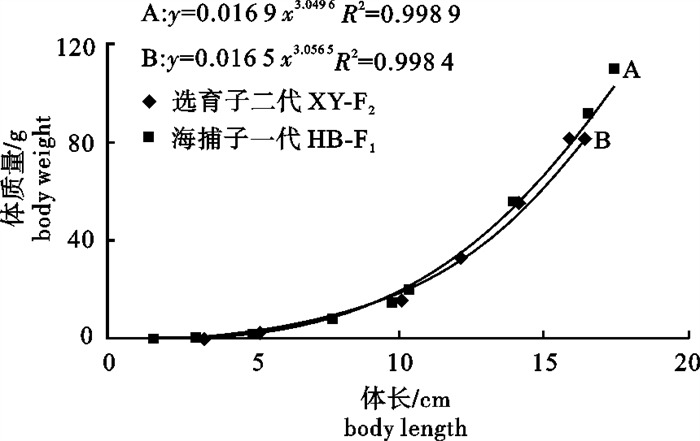
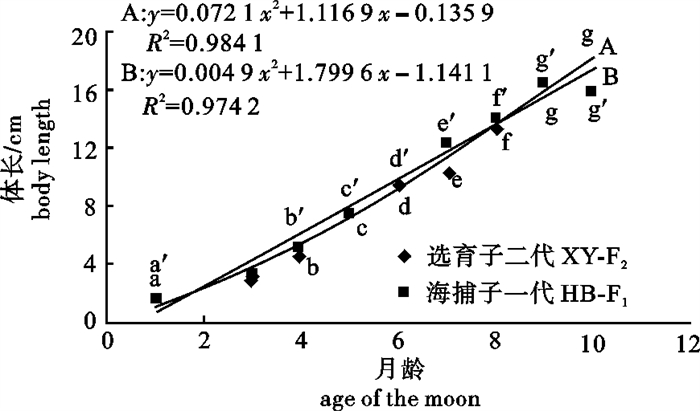
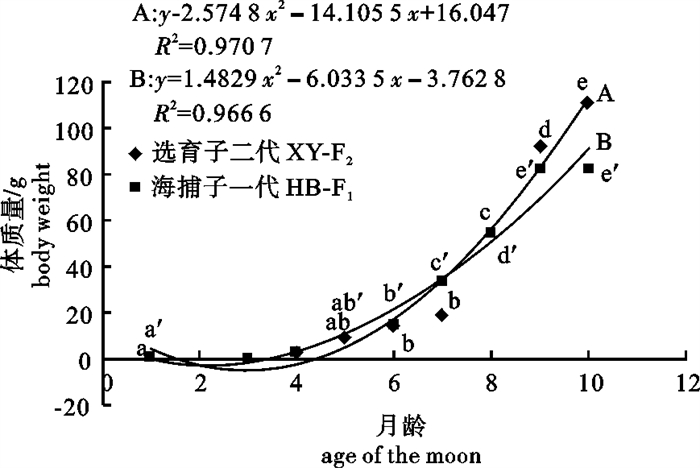
通过对选育和未选育2个群体大黄鱼(Larimichthys crocea)繁育得到的子代的卵径、油球径和口径进行测量,以及对其子代养殖过程中的生长性状进行测量比较,分析选育效果。结果显示,选育大黄鱼子代(XY-F2)和未经选育大黄鱼子代(HB-F1)平均卵径、平均油球径和平均口径之间差异不显著(P>0.05)。拟合1~10月龄XY-F2和HB-F1的体长(x)、体质量(y)的生长曲线及体长(x)与体质量(y)的关系表明,两群体间体长(x)与体质量(y)的关系存在差异;XY-F2在体长(x)和体质量(y)的生长在后期高于HB-F1。分析其数量性状,选育子一代(XY-F1)2龄鱼体长、体质量现实遗传力分别为0.26、0.18,而XY-F2的体长、体质量现实遗传力分别为0.029、0.134。结果说明选育具有一定的作用,今后选育应该结合家系选择和家系内选择进行。
Abstract:We measured the egg diameter, oil globule diameter and caliber of offspring of two groups of large yellow croaker (Larimichthys crocea), one breeding group and the other casual, and surveyed these offspring′s growth traits, based on which the breeding effect was analyzed. The results show that there is no significant difference (P>0.05) between breeding offspring(XY-F2)and not breeding(HB-F1)offspring of large yellow croaker in average egg diameter, oil ball diameter and caliber diameter. The curve of body length and body weight and the curve of body weight and age of moon are fitted for the two groups, indicating that body length and weight has a difference in each group, and that body length and weight of XY-F2 are higher than HB-F1 in the later stage. Body length and realized heritability of body weight of 2 years old breeding sub 1 generation (XY-F1) are 0.26, 0.18, respectively, while of XY-F2 are 0.029, 0.134, indicating that breeding promotes large yellow croaker cultivation. The results suggest combining family selection and within-family selection for breeding.
-
Keywords:
- large yellow croaker /
- breeding sub 2 generation /
- sea catch fish /
- growth type /
- heritability
-
转化生长因子β(transforming growth factor beta,TGF-β)超家族是一类多效应细胞因子,在抑制肿瘤、细胞增殖、细胞分化、组织形成、世系决定、细胞迁移和细胞凋亡等多种生理过程中发挥重要作用[1]。TGF-β超家族成员包括转化生长因子β(TGF-β)、活化素(activin)和节/骨形成蛋白(bone morphogenetic protein,BMP)3个家族。狭义上的TGF-β通常指的是TGF-β家族。TGF-β既能促进细胞增殖,又能抑制细胞增殖;能控制细胞外基质的形成,如促进胶原蛋白的合成;通过调节细胞外基质诱导细胞凋亡和调控形态发生;TGF-β也是一种神经蛋白,能刺激神经生长因子的形成[2]。研究表明,TGF-β系统与人类多种疾病有重大关联,如心脏疾病[3]、微血管疾病[4]和癌症[5]等。在哺乳动物中对TGF-β及其受体的报道每年有数百篇,足以说明TGF-β系统的重要性。近年来,有许多学者在低等脊椎动物中对TGF-β系统进行了研究,而鱼类具有其独特的生活环境和进化历史上的特殊意义,因此TGF-β系统在低等脊椎动物中的研究又集中在鱼类上。
1. TGF-β介绍
TGF-β第一次是从人胎盘中发现的[6],在哺乳动物中已发现了3种TGF-β(1/2/3),其中TGF-β1在免疫系统中发挥主要功能[7]。在鸟类中发现有3种TGF-β(TGF-β2/3/4),两栖类中发现有2种TGF-β(TGF-β2/5),已有证据表明鸟类的TGF-β4和两栖类的TGF-β5是TGF-β1进化的前体,因此也称之为TGF-β1[8]。到目前为止,在硬骨鱼中发现了4种TGF-β(TGF-β1/2/3/6)。
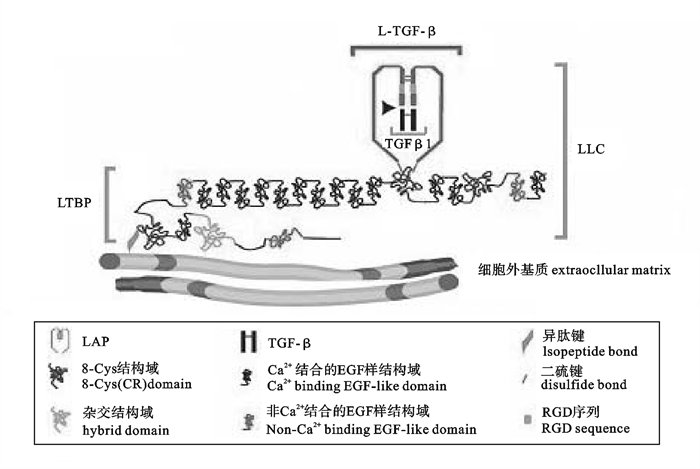
![]() 图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)
图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)哺乳动物TGF-β主要是由T细胞产生,但是在其他的细胞中都有表达。其他主要来源包括血小板、巨噬细胞、噬中性粒细胞、骨和软组织如胎盘、肾、子宫内膜和疾病细胞,通过自分泌和旁分泌的方式产生[2]。
哺乳动物中的3种TGF-β都可以在转录水平进行调控。TGF-β2和TGF-β3的启动子都包含有TATAA框和一个普通的近端CRE-ATF位点,这说明这些启动子都服从激素和发育调控[9]。TGF-β1的启动子缺少经典的TATAA框,但是有多元的调控位点,能够被c-jun、c-Fos和egr-1以及很多的致癌基因如abl、fos、jun、ras和src激活[10]。TGF-β1启动子的活性能被肿瘤抑制物所抑制[11]。低等脊椎动物中目前尚未见有关TGF-β转录调控方面的研究报道。
TGF-β是以前体蛋白的形式编码,每种TGF-β都是由一个单独的基因编码。TGF-β蛋白前体在细胞内经过一系列的加工过程后才分泌到细胞外。其中最重要的一步是前体蛋白的水解,将前体蛋白的N端切掉,是在高尔基体中由弗林蛋白酶(Furin-like peptidase)水解[12]。另有研究表明C型胶原蛋白酶也能裂解此位点[13],切掉的N端多肽又会形成二聚体,称为潜在关联蛋白(latency-associated protein,LAP),它与成熟TGF-β同型二聚体非共价结合,该复合体称为潜在的TGF-β(latent TGF-β,L-TGF-β)或小潜在复合体(small latent complex,SLC)。该复合体可以直接分泌到细胞外,或者再与潜在TGF-β结合蛋白(latent TGF-β binding protein,LTBP)相结合形成一个大的潜在复合体(large latent complex,LLC)而分泌,LTBP在使TGF-β靶向细胞外基质中发挥重要作用[14-15]。
哺乳类TGF-β1 LAP(LAP-1)的结构被广泛研究,LAP-1包含N端连接的糖链,其中2个含有甘露糖-6-磷酸基团,可以与细胞表面的甘露糖-6-磷酸盐/胰岛素样生长因子Ⅱ受体相互作用[16]。人类LAP-1含有3个半胱氨酸残基,223和225位置上的半胱氨酸对LAP形成链间二硫键十分重要。在223和225位置上的半胱氨酸用丝氨酸代替后,TGF-β1可直接以活性的形式分泌,表明这2个位置的半胱氨酸对LAP-1和TGF-β1的结合非常重要。此外,第33位的半胱氨酸与LTBP的结合有关[17]。LTBP具有15~19个表皮生长因子(EGF)样重复和多个半胱氨酸残基。LTBP的另一个功能是在高尔基体与L-TGF-β结合使SLC快速分泌。然而LTBP被广泛研究的功能是使L-TGF-β定位到细胞外基质,从而形成一个细胞外基质中的TGF-β库[18]。
TGF-β与LAP和LTBP结合时不能直接与受体结合,需要从复合物中释放出活性形式的TGF-β。在体外可以通过pH(2和8)、加热(100 ℃)或某些蛋白酶等条件使其释放[15]。至于在体环境是通过什么机制释放出活性的TGF-β,目前并没有确切的定论。但是学者们提出了几种假说,包括:1)通过反式谷氨酰胺酶水解活化假说[15];2)通过与血小板反应素物理接触改变LAP构想假说[19];3)表皮细胞αvβ6整联蛋白机械牵引假说[20-21]。
近期有报道MG63骨肉瘤细胞分泌到胞外的热休克蛋白HSP90β会抑制潜在TGF-β1的激活[22]。
2. TGF-β受体及信号通路
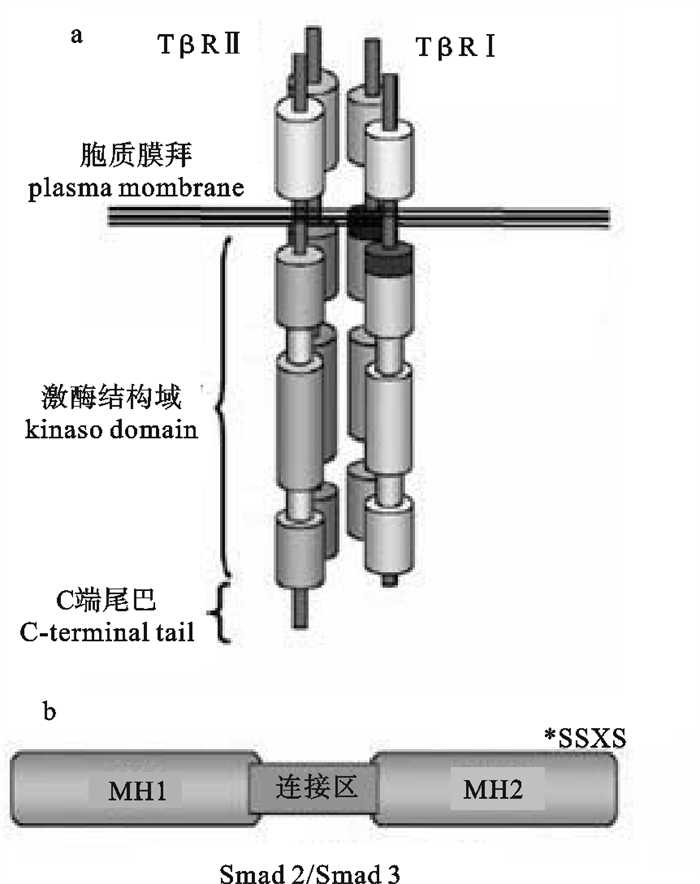
TGF-β受体的发现,最早是通过将125I-TGF-β化学交联到细胞表面的结合蛋白,再用凝胶电泳的方法分离交联上的配体受体复合体物,发现大多数细胞有3种膜表面的TGF-β结合蛋白,根据电泳的迁移率命名为Ⅰ型, Ⅱ型和Ⅲ型[23-24]。TGF-β Ⅰ型受体(TGF-β Receptor Ⅰ,TβRⅠ)和Ⅱ型受体(TGF-β Receptor Ⅱ,TβRⅡ)主要介导TGF-β的信号转导,这2种受体均为有单跨膜结构域的丝氨酸-苏氨酸激酶,氨基酸序列具有相当大的同源性[25]。一般TβRⅠ比TβRⅡ氨基酸序列要少。对人TβRⅡ氨基酸分析表明含有一个信号肽、一个136个氨基酸的N-糖基化的胞外结构域和一个主要是由激酶结构域组成的胞内结构域。2种受体胞外部分含有多个半胱氨酸,包括一个由3个半胱氨酸组成的半胱氨酸簇,表明受体自身的折叠和与配体的结合需要有很多二硫键。TβRⅠ和TβRⅡ均会形成同源二聚体,该二聚体的形成不依赖于配体结合。TβRⅠ在激酶结构域之前有一个SGSGSGLP的高度保守序列标签(GS结构域)[25]。TβRⅠ和TβRⅡ示意图见图 2-a。从目前研究结果来看,脊椎动物的TGF-β受体在结构上非常保守。
![]() 图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)
图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)TGF-β Ⅲ型受体(TGF-β Receptor Ⅲ,TβRⅢ),又称β蛋白聚糖,在很多种类的细胞中都有表达,是表达量最高的TGF-β受体。TβRⅢ也是跨膜受体,但是缺少酶的基序,不能直接与配体结合。因此认为TβRⅢ在TGF-β信号中发挥间接功能[25]。
成熟的TGF-β二聚体到达目标细胞表面时,与TβRⅡ同源二聚体结合,TβRⅡ激酶活性使其自身磷酸化,TGF-β-TβRⅡ复合物向TβRⅠ二聚体靠近,并磷酸化TβRⅠ而激活其激酶活性。因此活化的配体受体复合物是一个异源的六聚体,由1个TGF-β二聚体以及TβRⅠ和TβRⅡ各自的同源二聚体组成[27]。随后TβRⅠ磷酸化细胞内的Smad蛋白。脊椎动物Smad蛋白可以分为3个亚族:受体活化型Smad(R-Smad)、通用介导型Smad 4(Co-Smad)和抑制型Smad(Ⅰ-Smad,Smad 6和Smad 7)[28]。R-Smad包括BMP活化型(Smad 1、Smad 5、Smad 8)和TGF-β活化型(Smad 2、Smad 3)。R-Smad和Co-Smad是由2个Mad同源结构域(MH 1和MH 2)组成,通过连接区连接(图 2-b)。Ⅰ-Smad没有明显的MH1结构域,只有MH2结构域。非洲爪蟾(Xenopus laevis)有2种Smad 4,Smad 4α和Smad 4β,由2个基因编码。虽然2种Smad 4的氨基酸具有80%的同源性,但是其发育表达模式、亚细胞定位(Smad 4α主要在细胞质中,Smad 4β主要在细胞核中)和磷酸化水平截然不同。非洲爪蟾Smad 4β具有强的腹部形成诱导功能[29]。TβRⅠ磷酸化激活后使R-Smad C端SSXS基序磷酸化,SSXS基序在所有R-Smad中都是高度保守的,随后R-Smad与TβRI分离,与Smad 4形成复合物后进入细胞核,再与一些转录因子结合激活基因的转录[2]。尽管Co-Smad 4能够帮助R-Smad进入细胞核,但是R-Smad在没有Co-Smad 4的情况下也能进入到细胞核[20, 30]。R-Smad蛋白招募至受体复合物是由辅助蛋白介导的,例如Smad锚向受体活化蛋白(SARA)[31]。TGF-β与受体结合后,Smad 2和Smad 3被TβRⅠ磷酸化激活,再与Smad 4一起形成复合体进入细胞核,作用于Smad结合元件(Smad Binding Elements,SBE)。Ⅰ-Smad抑制TGF-β信号通过以下几种途径:1)与R-Smad竞争结合TβRⅠ;2)招募E3泛素连接酶Smurf 1/2使TβRⅠ泛素化而随之降解;3)与Smad 4作用,阻止R-Smad-Smad 4复合物的形成;4)直接抑制Smad引起的转录应答[20, 31]。一种重要抑制Smad功能的方式是招募Smad协同抑制因子,如c-Ski和SnoN[32-33]。
TGF-β信号的负调控有如下几个方面:1)通过Smurf途径使TGF-β受体降解;2)抑制TGF-β受体的活性;3)通过磷酸酶终结Smad信号;4)通过E3泛素连接酶关闭R-Smad和Smad 4;5)隔离Smad使其不参与活化的信号通路;6)抑制Smad的转录活性;7)Smad转录后修饰之间的竞争以及稳定性和活力之间的相互作用[31]。有些TGF-β的负调节因子,如Ⅰ-Smad和SnoN都是TGF-β直接作用的目的基因。
TGF-β除了能激活Smad依赖性通路外,也可以激活其他一些Smad非依赖性信号通路。已经证明,TGF-β刺激细胞后能快速激活Ras-Erk、TAK-MKK4-JNK、TAKMKK3/6-p38、Rho-Rac-cdc42 MAPK和PI3K-Akt通路,但是详细的机制目前并没有阐明[20]。TGF-β引起的Erk和JNK途径的激活可以导致Smad的磷酸化并调节Smad的激活。此外,TGF-β引起的Ras/Erk MAPK通路的激活会刺激TGF-β的表达,从而放大TGF-β的应答和导致二次TGF-β应答[34]。TGF-β1在CD4+T细胞中对IFN-γ引起的信号和Th1基因表达的抑制作用是Smad 3非依赖性的,但是MEK/ERK依赖性的[35]。最近又在小鼠(Mus muscculus)中发现TGF-β诱导IKK,p38和JNK的激活需要TAK1赖氨酸158残基[36]。
3. TGF-β及其受体在鱼类中的研究进展
3.1 TGF-β1在鱼类中的研究进展
TGF-β在鱼类中的研究还处于初步阶段,但是最近几年有关的研究也逐步增多,主要集中在TGF-β1。
3.1.1 与免疫和疾病相关
目前研究表明,TGF-β1与鱼类的免疫功能有着巨大的关系。ZHAN等[37]从鲤(Cyprinus carpio)活化的头肾淋巴细胞中克隆得到第一个鱼类的TGF-β1基因,其ORF编码376个氨基酸,包括与其他TGF-β蛋白一样的保守半胱氨酸。鲤TGF-β1在头肾、脾、卵和肝脏的表达量很少,但是用伴刀豆球蛋白A(Con A)激活头肾淋巴细胞后TGF-β1 mRNA水平会明显上升。HARMS等[38]从杂交狼鲈(Morone saxatilis×M.chrysops)头肾单核细胞中克隆到TGF-β1基因,其mRNA表达水平在外周血单核细胞中比脾和头肾中要高,初步显示TGF-β1的功能与免疫机制相关。笔者实验室也发现用聚肌胞苷酸(Poly I: C)或Con A刺激斜带石斑鱼(Epinephelus coioides)头肾淋巴细胞后,TGF-β1表达量明显上升,与在其他鱼中具有相似性[39]。YANG等[40]报道从草鱼(Ctenopharyngodon idellus)中克隆到TGF-β1 cDNA全长,组织分布表明TGF-β1 mRNA主要在胸腺、头肾和脾中大量分布,并发现重组人TGF-β1蛋白能诱导外周血淋巴细胞(PBL)增殖,但是也能显著抑制植物血凝集素(PHA)和脂多糖(LPS)刺激的PBL增殖,而且和脂多糖一样能显著上调草鱼MHCⅠmRNA表达。HADDAD等[41]从金鱼(Carassius auratus)中克隆到TGF-β1 cDNA序列。重组表达的金鱼TGF-β1成熟肽以剂量依存的方式促进金鱼成纤维细胞系(CCL71)的增殖。此外,重组的金鱼TGF-β1能够下调TNF-α活化的巨噬细胞一氧化氮应答。这是首次对硬骨鱼TGF-β1功能的报道。CAI等[42]报道真鲷(Pagrus major)的TGF-β1在诱导淋巴细胞迁移中具有两极特性。重组真鲷TGF-β1以剂量依赖的方式显著促进头肾和外周血淋巴细胞的迁移,但又能够抑制由LPS激活的淋巴细胞迁移。这是首次在鱼类中报道TGF-β1在调节鱼类免疫功能中具有天生的两极特性。最近,YANG等[43]又报道在草鱼白细胞中TGF-β1表现出对立的效应。TGF-β1能持续刺激外周血白细胞的活力和促炎症因子(TNF-α和IFN-γ)与T/B细胞标签[Cd4-like (Cd4l),Cd8α,Cd8β和Ig μ]的产生,但是在头肾白细胞中却相反。并表明TGF-β1可能通过下调ALK5 mRNA和蛋白水平,使草鱼白细胞对TGF-β1的敏感性下降。再次证明在硬骨鱼免疫功能中TGF-β1发挥正调控和负调控双重功能。
除了从理论上研究TGF-β1与免疫功能相关,有直接的研究表明TGF-β1与鱼类疾病有关。HARMS等[44]报道,用海鱼杆菌(Mycobacterium marinum)感染条纹狼鲈(M.saxatilis),其脾单核细胞TGF-β1 mRNA表达比未感染组要低,但是感染的杂交罗非鱼(Oreochromis spp.)和未感染鱼之间没有明显的变化。JOHNSON等[45]报道给大西洋油鲱(Brevoortia tyrannus)体腔注射去炎松导致其脾单核细胞TGF-β1 mRNA水平受到抑制,提示可能与大西洋油鲱发育过程中溃疡性皮肤损害的机制有关。LILLEENG等[46]报道在用大豆粉饲养大西洋鲑(Salmo salar)时TGF-β1明显下调,提示有可能和大西洋鲑大豆肠病的发病机理有关。已经报道用来源于欧鲶(Silurus glanis)和褐篮子鱼(Siganus fuscescens)的虹彩病毒(family Iridoviridae)刺激鱼的上皮瘤细胞后,引起TGF-β1短暂上升[47];嗜冷黄杆菌感染(Flavobacterium psychrophilum)的虹鳟(Oncorhynchus mykiss)脾脏TGF-β1下调,表明染病的鱼免疫系统变弱[48]。最近又发现TGF-β与藻毒素引起的免疫毒性效应有关,草鱼血和头肾淋巴细胞在藻毒素刺激后,TGF-β1 mRNA水平会上升[49]。这些证据表明很多鱼类在受到病害侵袭时,TGF-β1的表达水平都会有所变化,但是TGF-β1具体是如何参与到疾病的过程中,目前还没有阐明。
3.1.2 与生殖相关
TGF-β1除了与免疫和疾病相关之外,另一个主要功能是与生殖相关。KOULI等[50]从斑马鱼(Danio rerio)的卵巢中克隆到TGF-β1的cDNA序列,TGF-β1成熟肽区域与其他物种的相似度达到70%~85%。并发现TGF-β1能以剂量依赖和时间依赖的方式显著抑制促性腺激素和17α, 20β-二羟孕酮诱导的卵母细胞成熟,首次在鱼类中证明TGF-β1能调节卵母细胞的成熟。同时证明,TGF-β/Smad信号通路在斑马鱼卵巢中存在。TAN等[51]报道TGF-β1能够抑制膜黄体酮受体[membrane progestin receptors (mPRs)]β,而不能抑制受体α,以此来调节卵母细胞的成熟。JIN等[52]报道在斑马鱼卵泡细胞中TGF-β信号需要依赖动力蛋白轻链zkm23。研究TGF-β1在生殖中的作用对鱼类的繁殖育种有着重大意义。
3.1.3 与肝脏功能相关
最近,HOBBIE等[53]报道二甲基亚硝铵处理的青鳉(Oryzias latipes),肝脏TGF-β1表达升高,并且随着二甲基亚硝铵处理浓度的升高,胆囊上皮细胞、中间细胞、不成熟肝细胞和少量的成熟肝细胞中TGF-β1蛋白水平上升,显示TGF-β1与肝功能有关。
3.1.4 TGF-β1序列特点
从已经克隆到的鱼类TGF-β1cDNA序列分析发现,序列具有很高的保守性,与其他脊椎动物相似。它们均具有保守的9个半胱氨酸(草鱼和鲤在第7个保守半胱氨酸位点处被精氨酸代替),这也是TGF-β成员的一个标志性特征。其中的8个半胱氨酸以成对的方式形成分子中心区的4对链内二硫键,结合第9个半胱氨酸形成链间二硫键,一起形成TGF-β二聚体。前体肽均具有特征性标志成熟肽起始的KEX-Furin样蛋白酶识别位点RXXR。并且都具有整合素结合位点RGD,RGD能够与整合素特异结合,例如能够与αvβ6特异结合,从而使潜活型的TGF-β1活化[15]。而在大海马(Hippocampus kuda)TGF-β1序列中则由RSD取代了RGD[54],其中丝氨酸和甘氨酸具有相似的物理性质,都为亲水性的中性氨基酸,但转换的具体原因还不清楚。
3.2 TGF-β其他成员在鱼类中的研究进展
TGF-β家族的成员除了TGF-β1,常见的还有TGF-β2和TGF-β3。SUMATHY等[55]第一次从鲤中克隆得到TGF-β2基因,根据推测的氨基端列与人的TGF-β2基因比对,显示鲤TGF-β2前体蛋白和成熟蛋白与人的TGF-β2的前体蛋白和成熟蛋白相似度分别为81%和93%。LAING等[56]从钝吻鲟(Acipenser baeri)、虹鳟和欧洲鳗鲡(Anguilla anguilla)中克隆到部分核苷酸序列,证明TGF-β3在辐鳍亚纲的硬骨鱼中存在。LAING等[57]进一步在鲽(Pleuronectes platessa)中证明同时存在多种TGF-β基因。CHEAH等[58]报道在斑马鱼中克隆到TGF-β3 cDNA全长,显示该基因是由7个外显子组成,定位在14q24号染色体连锁群17的一部分。在转录起始位点的上游具有1个刺激蛋白1[Stimulating protein 1 (Sp1)]和2个TATA结合蛋白(TBP)的结合位点。TGF-β3在发育的胸鳍中大量表达,而没有在哺乳动物前肢中有类似的报道,表明TGF-β3在鱼类早期发育中具有新的功能。FUNKENSTEIN等[59]报道在金鲷(Sparus aurata)中发现一种新的TGF-β,其基因由7个外显子组成,预测编码420个氨基酸。基因组成与小鼠和鸡的TGF-β2相似,但氨基酸比对发现是一种新的在鱼类中特有的TGF-β,命名为TGF-β6,并发现TGF-β6能通过营养水平调节骨骼肌生长。目前还没有在其他脊椎动物中有关于TGF-β6的报道。
3.3 TGF-β受体在鱼类中的研究进展
对于鱼类TGF-β受体的研究还很少。最早是KOHLI等[50]在斑马鱼卵巢中克隆到TGF-β1的同时也克隆出TβRⅡ的cDNA序列,这是第一次在鱼类中报道的TβRⅡ,其激酶结构域与其他物种高度保守。MAEHR等[60]报道在虹鳟中克隆到2种TGF-β受体(TβRI和TβRⅡ)。从得到的虹鳟TβRI和TβRⅡ序列发现,其具备TβRI和TβRⅡ受体家族的所有特点,包括1个富含半胱氨酸的胞外结构域、1个跨膜结构域和1个丝氨酸/苏氨酸激酶结构域,并且激酶结构域高度保守。组织分布显示TβRI在胸腺和脾脏高表达;TβRⅡ在皮肤、胸腺和后肾中高表达,表明2种受体与免疫功能相关。同时2种受体在肌肉中都有很高表达,说明其与生长发育有关。同时,研究了各种刺激剂(LPS、Poly I: C、PHA、PMA、CI)刺激头肾淋巴细胞后对2种受体mRNA水平的影响,显示PHA、PMA、CI能下调2种受体的表达,首次深入了解2种受体在鱼类免疫过程中的调节情况。但是对TGF-β受体在鱼类中的研究还有待进一步深入。
4. 小结
TGF-β是一类非常重要的细胞因子,在脊椎动物的多种生理活动中都有所涉及。每年在哺乳动物中关于TGF-β系统相关的研究数以百计,其重要性可见一斑。而目前在硬骨鱼中对TGF-β通路的研究还处于初级阶段,其中大部分的研究都集中在TGF-β家族中的成员TGF-β1。对TGF-β1的研究主要集中在免疫疾病和生殖方面,最近也有涉及肝脏方面,而对TGF-β家族其他成员的研究较少。到目前为止,对于TGF-β受体在硬骨鱼中的研究只有在斑马鱼和虹鳟中有过报道。
由于进化过程中基因组复制的原因,鱼类中很多基因的拷贝数不同于哺乳动物。笔者实验室在尼罗罗非鱼(O.niloticus)中分离出2种TGF-β2和2种TGF-β3,并且在功能上也有差异(待发表)。因此,硬骨鱼中TGF-β系统还有很多是没有涉及到的,有待进一步研究。
由于TGF-β系统的重要性,未来在硬骨鱼中的研究,应该在理论研究的同时,紧密联系实际生产,向着抗病、促生长和繁殖育种等方向发展。
-
表 1 选育子二代与海捕子一代受精卵直径、油球直径和稚鱼口径之间的比较
Table 1 Comparison of fertilized egg diameter, oil globule diameter and juveniles caliber between XY-F2 and HB-F1
组别
group亲鱼规格 kiss fish size 卵子直径/μm the egg diameter 油球直径/μm oil ball diameter 口径/μm bore 平均体长/cm
average body length平均体质量/g
average body weight范围
scope平均
average范围
scope平均
average范围
scope平均
average选育子二代 XY-F2 32.67±1.26 686.7±126.90 1 134.77~1 389.84 1282.32±42.73 262.17~429.99 320.34±44.20 217.90~541.32 323.09±66.62 海捕子一代 HB-F1 32.19±3.22 734.2±167.60 1 186.64~1 390.06 1289.60±38.91 274.32~457.81 379.73±46.64 173.26~591.13 315.62±68.10 表 2 选育子一代与选育子二代数量性状的比较情况
Table 2 Quatitative trait comparison between XY-F2 and XY-F1
项目
project年龄
age体质量/g body mass 体长/mm body length S i h2 S i h2 选育子一代XY-F1 2年 198.7 1.63 0.180 43.5 2.15 0.26 选育子二代XY-F2 10月 212.9 1.82 0.134 49.9 2.02 0.029 表 3 选育子二代遗传力及与海捕子一代变异系数的比较情况
Table 3 Comparison of XY-F2 heritability and HB-F1 variation coefficient
月龄
age of the moon项目
item选育子二代XY-F2 海捕子一代HB-F1 样本数
sample size均值±标准差
X±SD遗传力 变异系数/%
variation coefficient样本数
sample number均值±标准差 X±SD 变异系数/%
variation coefficient1 体长/cm body length 30 1.57±0.21 13.38 30 1.55±0.21 13.55 体质量/g body mass 30 0.06±0.02 33.33 30 0.06±0.02 33.33 4 体长/cm body length 31 4.98±0.50 10.04 31 5.31±0.47 8.85 体质量/g body mass 31 2.32±0.63 27.16 31 2.42±0.67 27.69 5 体长/cm body length 59 7.74±1.05 13.57 59 7.72±1.19 15.41 体质量/g body mass 59 8.50±3.26 38.35 59 8.63±2.47 28.62 6 体长/cm body length 30 9.74±1.19 12.22 30 10.16±1.14 11.22 体质量/g body mass 30 14.97±6.22 41.55 30 15.37±4.24 27.59 7 体长/cm body length 32 10.37±1.13** 10.9 32 12.33±1.23** 9.98 体质量/g body mass 32 19.21±6.52** 33.94 32 33.37±10.02** 30.03 8 体长/cmbody length 30 13.99±2.46 17.58 30 14.19±2.05 14.45 体质量/g body mass 30 56.06±25.22 44.99 30 54.97±33.93 61.72 9 体长/cmbody length 38 16.59±2.06 12.42 38 16.47±1.89 11.48 体质量/g body mass 38 92.25±32.25 34.96 38 81.76±28.78 35.2 10 体长/cm body length 30 17.44±2.53* 0.029 14.51 30 15.99±2.77* 17.32 体质量/g body mass 30 110.38±46.05* 0.134 41.72 30 81.86±41.19* 50.32 注:*. 两群体间差异显著(P < 0.05),* *. 两群体间差异极显著(P < 0.01)
Note: *. significant difference between the two groups (P < 0.05). * *. very significant difference between the two groups (P < 0.01) -
[1] 丁诗华, 黄丽英, 张海琪, 等. 大黄鱼(Pseudosciaena crocea)岱衢洋选育群体和官井洋养殖群体的遗传差异分析[J]. 海洋与湖沼, 2006, 37(1): 41-46. doi: 10.3321/j.issn:0029-814X.2006.01.007 [2] 刘家富, 韩坤煌. 我国大黄鱼的产业发展现状与对策[J]. 福建水产, 2011, 33(5): 4-8. https://www.cqvip.com/QK/94635X/201105/40456533.html [3] 刘家富, 刘招坤. 福建闽东大黄鱼Larimichthys crocea (Richardson)产业展望[J]. 现代渔业信息, 2008, 23(12): 3-5. doi: 10.3969/j.issn.1004-8340.2008.12.001 [4] 刘家富. 人工育苗条件下的大黄鱼胚胎发育及其仔、稚鱼形态特征与生态习性的研究[J]. 海洋科学, 1996(6): 61-64. doi: 10.3969/j.issn.1000-3096.1999.06.024 [5] 陈慧, 陈武, 林国文, 等. 官井洋种群网箱养殖大黄鱼的形态特征与生长式型[J]. 海洋渔业, 2007, 29(4): 331-336. doi: 10.3969/j.issn.1004-2490.2007.04.008 [6] 张春晓, 麦康森, 艾庆辉, 等. 饲料中添加肽聚糖对大黄鱼生长和非特异性免疫力的影响[J]. 水产学报, 2008, 32(3): 411-416. doi: 10.3321/j.issn:1000-0615.2008.03.012 [7] 赵金柱, 艾庆辉, 麦康森, 等. 微粒饲料替代生物饵料对大黄鱼稚鱼生长、存活和消化酶活力的影响[J]. 水产学报, 2008, 32(1): 91-97. https://d.wanfangdata.com.cn/periodical/scxb200801015 [8] ALAMI-DURANTE H, DALE F M, CLUZEAUD M, et al. Skeletal muscle growth dynamics and expression of related genes in white and red muscles of rainbow trout fed diets with graded levels of a mixture of plant protein souces as substitutes for fishmeal[J]. Aquacuture, 2010, 303(1): 50-58. https://www.sciencedirect.com/science/article/pii/S0044848610001845
[9] ADAMIDOU S, NENGAS I, HENRY M, et al. Growth, feed utilization, health and organoleptic characteris stics of European seabass (Dicentrarchus labrax) fed extruded diets including low and high levels of three different legumes[J]. Aquaculture, 2009, 293(3): 263-271. https://www.sciencedirect.com/science/article/pii/S0044848609004463
[10] 张帆, 张文斌, 麦康森, 等. 饲料中豆粕替代鱼粉对大黄鱼生长、消化酶活性和消化道组织学的影响[J]. 中国海洋大学学报: 自然科学版, 2012, 42(增刊): 75-82. https://www.cqvip.com/QK/92605A/2012S1/1003451206.html [11] 林克冰, 周宸, 刘家富, 等. 海水网箱养殖大黄鱼病原菌研究[J]. 海洋科学, 1999(4): 58-62. doi: 10.3969/j.issn.1000-3096.1999.04.021 [12] 徐晓津, 徐斌, 王军, 等. 大黄鱼感染哈维氏弧菌后血液生化指标的变化及组织病理学观察[J]. 水产学报, 2010, 34(4): 618-625. doi: 10.3724/SP.J.1231.2010.06665 [13] 李思源, 葛明峰, 胡亚萍, 等. 三种致病弧菌感染对大黄鱼非特异性免疫功能的影响[J]. 台湾海峡, 2012(2): 202-209. doi: 10.3969/J.ISSN.1000-8160.2012.02.008 [14] 王晓清, 王志勇, 柳小春, 等. 大黄鱼人工诱导雌核发育后代的微卫星标记分析[J]. 遗传, 2006, 28(7): 831-837. doi: 10.3321/j.issn:0253-9772.2006.07.012 [15] 王晓清, 王志勇, 柳小春, 等. 人工雌核发育大黄鱼(Pseudosciaena crocea)的AFLP分析[J]. 海洋与湖沼, 2007, 38(1): 22-28. doi: 10.3321/j.issn:0029-814X.2007.01.004 [16] 许建和, 尤锋, 吴雄飞, 等. 冷休克法和静水压法人工诱导大黄鱼三倍体[J]. 中国水产科学, 2006, 13(2): 206-210. doi: 10.3321/j.issn:1005-8737.2006.02.007 [17] 黄良敏, 谢仰杰, 苏永全. 闽-粤东族与岱衢族养殖大黄鱼的遗传多样性研究[J]. 厦门大学学报: 自然科学版, 2006, 45(6): 836-840. doi: 10.3321/j.issn:0438-0479.2006.06.025 [18] 王德祥, 苏永全, 王世锋, 等. 不同地理种群大黄鱼染色体核型的比较研究[J]. 海洋学报, 2006, 28(6): 176-178. doi: 10.3321/j.issn:0253-4193.2006.06.026 [19] 黄勤, 陈曦, 杨金先, 等. 福建养殖大黄鱼(Pseudosciaena crocea)RAPD标记及多态性调查[J]. 福建农业学报, 2007, 22(2): 130-135. doi: 10.3969/j.issn.1008-0384.2007.02.004 [20] 黄振远, 苏永全, 张建设, 等. 闽粤群和岱衢群养殖大黄鱼(Pseudosciaena crocea)及其杂交子代遗传差异的SSR分析[J]. 海洋与湖沼, 2011, 42(4): 592-596. doi: 10.11693/hyhz201104020020 [21] 王军, 全成干, 苏永全, 等. 官井洋大黄鱼遗传多样性的RAPD分析[J]. 海洋学报, 2001, 23(3): 87-91. doi: 10.3321/j.issn:0253-4193.2001.03.010 [22] 王娟, 封永辉, 蔡立胜, 等. 来自大黄鱼(Pseudosciaena crocea)肠道的弧菌拮抗菌的筛选与鉴定[J]. 海洋与湖沼, 2010, 41(5): 707-713. doi: 10.11693/hyhz201005007007 [23] GRANT A, TYLER P A. The analysis of data in studies of invertebrate reproduction: Ⅰ. Introduction and statistical analysis of gonad indices and maturity indices[J]. Int J Inverebr Reprod, 1983, 6(5): 259-269. doi: 10.1080/01651269.1983.10510052
[24] 刘贤德, 蔡明夷, 王志勇, 等. 闽-粤东族大黄鱼生长性状与通径分析[J]. 中国海洋大学学报: 自然科学版, 2008, 38(6): 916-920. doi: 10.3969/j.issn.1672-5174.2008.06.030 [25] 吴仲庆. 水生生物遗传育种学[M]. 厦门: 厦门大学出版社, 2000: 138-140. [26] 徐恭昭, 罗秉征, 黄颂芳. 大黄鱼生殖季节体长体质量关系的种内变异[J]. 海洋科学集刊, 1984, 22(1): 1-8. [27] 陈成进. 人工养殖大黄鱼主要生长特征观察[J]. 现代渔业信息, 2011, 26(3): 24-29. doi: 10.3969/j.issn.1004-8340.2011.03.007 [28] AULSTAD D G, GJEDREM T, SKJERVOLD. Genetic and environmentalurces of variation in length and weight of rainbow trout (S. gairdneri)[J]. Fish Res Board Can, 1972, 29: 237-341. doi: 10.1139/f72-042
[29] REFSTIE T. Genetic and environmental, sources of variation in body weight and length of rainbow trout fingerlings[J]. Aquaculture, 1980, 19(4): 351-357. doi: 10.1016/0044-8486(80)90083-6
[30] GUNNES K, EDREM T. A genetix analysis of body weight and lengthin rainbow trout reared in seawater for 18 months[J]. Aquaculture, 1981, 24: 161-174. doi: 10.1016/0044-8486(81)90053-3
[31] MCKAY L R, IHSSEN P E, FRIARS G W. Genetic parameters of growth in rainbow trout, Salmmo gairdneri, as a function of age and maturity[J]. Aquaculture, 1986, 58(3/4): 241-254. doi: 10.1016/0044-8486(86)90089-X
[32] HYUMA K, NOBUYUKI I, AKIHIRO K. Estimation of herita-bility for growth by factorial mating system in rainbow trout (Oncorhynchus mykiss)[J]. Suisanzoshoku, 2001, 49(2): 243-251. https://www.semanticscholar.org/paper/Estimation-of-Heritability-for-Growth-by-Factorial-Kudo-Inoguchi/76ec82b9f20e6ef9127638a5717a178c80b838b1
[33] GUNNES K, EDREM T. Selection experiments with salmon Ⅳ: growth of Atlantic salmon during two years in the sea[J]. Aquaculture, 1978, 15(1): 19-33. doi: 10.1016/0044-8486(78)90069-8
[34] REFSTIE T, STEINE T A. Selection experiments with salmon Ⅲ: genetic and environmental sources of variation in length and weight of Atlantic salmon in the freshwater phase[J]. Aquaculture, 1978, 14(3): 221-234. doi: 10.1016/0044-8486(78)90096-0
[35] 王晓清, 王志勇, 何湘蓉. 大黄鱼(Larimichthys crocea)耐环境因子试验及其遗传力的估计[J]. 海洋与湖沼, 2009, 40(6): 781-785. doi: 10.3321/j.issn:0029-814X.2009.06.017 [36] 王晓清, 王志勇, 何湘蓉. 大黄鱼40日龄体长和体质量遗传力估计[J]. 集美大学学报: 自然科学版, 2010, 15(1): 7-10. doi: 10.3969/j.issn.1007-7405.2010.01.002 [37] 刘贤德, 蔡明夷, 王志勇, 等. 不同生长时期大黄鱼形态性状与体重的相关性分析[J]. 热带海洋学报, 2010, 29(5): 159-163. doi: 10.3969/j.issn.1009-5470.2010.05.025 -
期刊类型引用(1)
1. 刘春晓,吕为群,杨志刚,陈阿琴. TGF-β/Smad信号通路响应光周期变化参与调控斑马鱼卵巢发育. 南方水产科学. 2019(03): 68-75 .  本站查看
本站查看
其他类型引用(10)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
