Effects of temperature, irradiance level and nutritional history on the uptake of inorganic phosphorus in Hizikia fusiforme
-
摘要:
为了探讨温度、光照和营养史对羊栖菜(Hizikia fusiforme)无机磷吸收的影响,在不同条件下培养藻体,于第0小时、第0.5小时、第1小时、第2小时、第4小时、第6小时和第9小时分别测定培养海水中磷(P)浓度,以此来计算藻体对P的吸收速率。培养条件设置为10 ℃、20 ℃和30 ℃3个温度梯度;0、1 500 lx和6 500 lx 3个光照强度梯度;营养史通过藻体在不同营养盐浓度下培养96 h后获得,其中不同P营养史设0、5 μmol·L-1和50 μmol·L-1 3个梯度,不同氮(N)营养史设0、10 μmol·L-1和200 μmol·L-13个梯度。结果表明,羊栖菜对P的吸收速率在20 ℃时达到最大值(0.197±0.005) μmol·(h·g)-1,在10 ℃时最小值为(0.105±0.001) μmol·(h·g)-1;随着培养光强的升高,P吸收速率逐渐递增;随着营养史中P饥饿程度的增加,P的吸收速率递增;而不同N营养史处理的藻体,无氮(0 μmol·L-1)和低氮(10 μmol·L-1)处理之间无显著差异,高氮营养史(200 μmol·L-1)的藻体具有最高的P吸收速率。
Abstract:To investigate the effects of temperature, irradiance level and nutritional history of nitrogen or phosphorus on inorganic phosphorus uptake in Hizikia fusiforme, we cultivated thalli under different conditions, measured the concentration of inorganic phosphorus in media at 0, 0.5th, 1st, 2nd, 4th, 6th and 9th hour, and determined the uptake rate. We set the temperature at 10 ℃, 20 ℃ and 30 ℃, and irradiance levels at 0, 1 500 lx and 6 500 lx in different experiments respectively. Different nutritional histories were obtained by growing thalli at different concentrations of nutrient for 96 h, including 3 levels of phosphorus (0, 5 μmol·L-1and 50 μmol·L-1) and 3 levels of nitrogen (0, 10 μmol·L-1 and 200 μmol·L-1), respectively. The results show that the uptake rate of inorganic phosphorus reaches maximum at 20 ℃, while the minimum at 10 ℃. With the enhancement of irradiance level, uptake rate increases. Thalli with nutritional history of lower phosphorus concentration show a higher uptake rate of phosphorus, and vice versa. For different nitrogen histories, higher uptake rate is found in alga with higher nitrogen history, and there is no significant difference between 0 and 10 μmol·L-1 nitrogen histories.
-
Keywords:
- Hizikia fusiforme /
- phosphorus /
- uptake rate /
- temperature /
- irradiance level /
- nutritional history
-
随着近年来海洋动物养殖业的迅猛发展,加上陆源污染的持续注入,中国近海富营养化现象日益严重[1-3]。由于大型海藻能够快速吸收并移出海水中的氮(N)、磷(P)等营养物质,因此国内外学者普遍认为大型海藻的规模化栽培是延缓近海富营养化进程、修复近海生态环境的有效途径之一[4-6],而对大型海藻营养盐吸收特点和生物修复功能的研究也受到了广泛的关注[7-10]。P是海藻生长的必需元素,是核蛋白和磷脂的重要成分,同时参与海藻细胞内很多生化反应过程,具有非常重要的生理地位[11]。但是,由于海洋中存在着能够将有机磷转化为无机磷的碱性磷酸酶[12-14],因此在自然海域中P通常不被认为是海藻的生长限制因子。然而,随着近海富营养化现象的加重,N浓度的急剧升高往往使得P被动的成为海藻生长的限制因素,对大型海藻P吸收的研究也因此逐渐受到关注[7, 10, 15]。
羊栖菜(Hizikia fusiforme)是一种大型经济褐藻,在中国近海潮间带广泛分布。由于具有较高的营养和药用价值[16],人们对其的过度采集已造成当前羊栖菜自然资源的严重锐减。近年来国内学者对羊栖菜的人工繁育进行了初步的研究并取得一定的进展[17-18],其人工繁育和栽培在浙江近海形成了一定的规模,这使羊栖菜成为近海富营养化海水修复的潜在品种。文章以羊栖菜为研究材料,在实验室可控条件下探讨温度、光照和营养史等环境因子对其无机磷吸收的影响,试图为其在海水富营养化生物修复功能中的应用提供理论依据。
1. 材料与方法
1.1 材料
野生羊栖菜采自汕头南澳岛潮间带,采集时选择健康一致、体长5 cm左右的孢子体,放于4 ℃保温箱3 h内运到实验室,暂养在经高压灭菌的自然海水中备用。暂养海水pH为8.2,盐度为33,无机氮浓度为10 μmol·L-1,无机磷浓度为0.5 μmol·L-1。培养温度为20 ℃,光照强度为10 000 lx,光照周期为亮(L) ∶暗(D)=12 ∶ 12,24 h充气。
1.2 不同培养条件的设置
1.2.1 不同温度条件的设置
光照控温培养箱设置10 ℃、20 ℃和30 ℃ 3个温度梯度,不同温度下培养光照强度(photons)均为10 000 lx,培养密度(湿质量,FW)为10 g·L-1,培养海水(2 L)初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。初始N、P浓度分别通过向自然海水中添加硝酸钠(NaNO3)和磷酸二氢钠(NaH2PO4)获得。
1.2.2 不同光照强度条件的设置
光照控温培养箱设置0、1 500 lx和6 500 lx 3个光照强度梯度,不同光强下温度均为20 ℃,培养密度(FW)为10 g·L-1,培养海水(2 L)初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。初始N、P浓度分别通过向自然海水添加NaNO3和NaH2PO4获得。
1.2.3 不同营养史的获得
1) F/2加富人工海水的配制。首先在蒸馏水中溶解氯化钠(NaCl)450 mmol·L-1、氯化钾(KCl)10 mmol·L-1、氯化钙(CaCl2)10 mmol·L-1、硫酸镁(MgSO4)30 mmol·L-1、碳酸氢钠(NaHCO3)2.2 mmol·L-1,获得人工海水[19],然后参照BOROWITZKA[20]的方法进行F/2配方营养加富,其中不添加N和P,使培养水体中不缺乏其他营养元素而保证N和P浓度为零。
2) 不同P营养史的获得。健康一致的羊栖菜孢子体于0、5 μmol·L-1或50 μmol·L-13种P浓度条件下分别适应培养96 h,获得具有不同P营养史的试验材料。培养温度为20 ℃,光照强度为10 000 lx,光照周期为L ∶ D=12 ∶ 12,N浓度为200 μmol·L-1。培养密度(FW)为10 g·L-1,不间断充气,每24 h分别更换培养海水。培养海水使用如1)配制的人工海水,通过添加NaH2PO4获得不同的P浓度。
3) 不同N营养史的获得。孢子体于0、10 μmol·L-1或200 μmol·L-13种N浓度条件下分别适应培养96 h,获得具有不同N营养史的试验材料。培养温度为20 ℃,光照强度为10 000 lx,光照周期为L ∶ D=12 ∶ 12,P浓度为50 μmol· L-1。培养密度(FW)为10 g·L-1,不间断充气,每24 h分别更换培养海水。培养海水使用如1)配制的人工海水,通过添加NaNO3获得不同的N浓度。
4) 培养后P吸收的测定。具有不同营养史的孢子体材料,转入相同的培养条件的2 L培养海水中分别测定其P吸收情况。培养条件为温度20 ℃,光照强度10 000 lx,培养密度(FW)为10 g·L-1,培养海水初始N浓度为200 μmol·L-1,初始P浓度为31 μmol·L-1。
1.3 P吸收速率的测定
不同温度、光照强度或营养史条件下培养的羊栖菜,分别于第0小时、第0.5小时、第1小时、第2小时、第4小时、第6小时和第9小时测定培养海水中的P浓度,以P浓度的变化来表示羊栖菜对P的吸收情况。吸收速率计算公式为:
$$ 吸收速率=\left(N_0-N_t\right) \times V \times\left(t \times W_0\right)^{-1} $$ 其中,N0为初始培养海水中的P浓度,Nt为测量结束时的P浓度(μmol·L-1),V为培养海水的体积(L),W0为初始时藻体的湿质量(FW,g),t为试验时间(h),吸收速率(FW)的单位为μmol·(h·g)-1。培养海水中P浓度的测定采用磷钼蓝分光光度法[21]。
1.4 数据处理和统计分析
所有测定结果表示为平均数±标准差(X ±SD)(n=4),用单因子方差分析(One-way ANOVA)和t检验进行差异显著性分析,以P < 0.05作为差异的显著性水平。
2. 结果
2.1 不同温度下羊栖菜对P的吸收
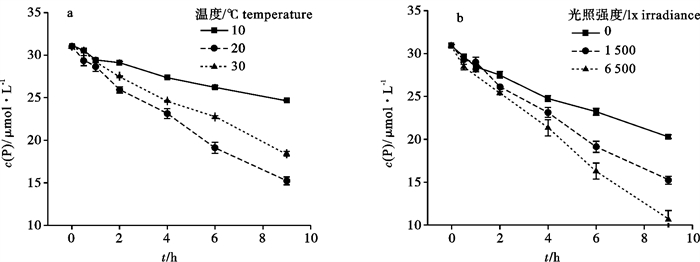
不同温度培养下羊栖菜培养海水中P浓度随时间变化情况见图 1-a。培养液中P浓度随时间逐渐下降,20 ℃时下降最快,10 ℃最慢,说明羊栖菜对P的吸收速率在20 ℃时达到最大,在10 ℃时最小。9 h内羊栖菜对P的平均吸收速率在不同温度条件之间存在显著性差异(P < 0.001),吸收速率(FW)分别为10 ℃时(0.105±0.001) μmol·(h·g)-1;20 ℃时(0.197±0.005) μmol·(h·g)-1;30 ℃时(0.169±0.001) μmol·(h·g)-1。
2.2 不同光照强度下羊栖菜对P的吸收
不同光照强度条件下羊栖菜培养海水中P浓度的变化情况见图 1-b。随着光照强度的增加,P浓度的下降速度与程度都明显增加,说明羊栖菜对P的吸收速率随着光强升高而显著增大(P < 0.001),9 h内各光强下羊栖菜对P的平均吸收速率为无光照(0)时(0.148±0.002) μmol·(h·g)-1;1 500 lx时(0.197±0.005) μmol·(h·g)-1;6 500 lx时(0.241±0.010) μmol·(h·g)-1。
2.3 不同营养史的羊栖菜对P的吸收
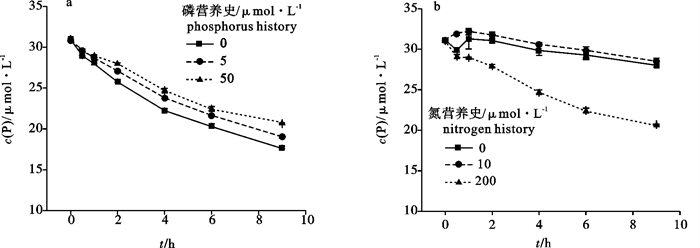
具有不同P营养史的羊栖菜,在相同培养条件下藻体对于P的吸收速率呈现出显著的差异(P < 0.05),其培养海水中P浓度的变化见图 2-a。不同营养史的羊栖菜对P的吸收速率的特点为营养史中培养海水P浓度越高,其吸收速率则越低,9 h内平均吸收速率分别为无磷(0)营养史的藻体P吸收速率为(0.173±0.001) μmol·(h·g)-1;5 μmol·L-1营养史的藻体P吸收速率为(0.160±0.001) μmol·(h·g)-1;50 μmol·L-1营养史的藻体P吸收速率为(0.144±0.000) μmol·(h·g)-1。
具有不同N营养史的羊栖菜,在相同培养条件下其培养海水中P浓度的变化见图 2-b。高氮(200 μmol·L-1)营养史藻体的P浓度随时间下降显著,而低氮(10 μmol·L-1)和无氮(0)营养史的藻体培养海水中P浓度随时间变化不明显,并且两者在9 h内对P的平均吸收速率之间无显著性差异(P>0.1)。无氮(0)、低氮(10 μmol·L-1)和高氮(200 μmol·L-1)3种N营养史的藻体9 h内对P的平均吸收速率分别为(0.072±0.003) μmol·(h·g)-1、(0.068±0.004) μmol·(h·g)-1和(1.155±0.007) μmol·(h·g)-1。
3. 讨论
P是大型海藻生长的必需元素,海藻对P的吸收为主动吸收[22],一般情况下其吸收特点符合典型的酶促反应动力学曲线特征[15, 22]。P的吸收代谢与细胞的核酸合成、膜结构组装、识别调节蛋白和酶活性等生化过程密切相关[11],与海藻的生长以及光合作用紧密联系[23-24],因此,影响海藻生长和光合作用的环境因子也必将影响海藻对P的吸收代谢过程。
PEDERSEN等[25]研究了温度对几种紫菜(Porphyra)营养盐吸收速率的影响,结果表明,在P供应充足的条件下海藻对P的吸收速率随温度的升高而加快,温度每升高10 ℃吸收速率就增为2倍,即温度系数Q10=2。笔者研究中温度从10 ℃升到20 ℃时羊栖菜对P的吸收速率从(0.105±0.001) μmol·(h·g)-1升高到(0.197±0.005) μmol·(h·g)-1,Q10约为1.88,这与PEDERSEN等[25]的研究结果相似。其原因可能是由于在较高的温度下P主动吸收需要的各种酶的活性增强,同时随温度而加快的呼吸作用也能为其提供充足的能力,因此能够保持藻体较快的P吸收速率。但当温度为30 ℃时羊栖菜对P的吸收反而出现了一定程度的降低[(0.169±0.001) μmol·(h·g)-1],这可能是高温对P吸收作用相关酶的活性产生了影响。许忠能等[7]早在2002年在对细基江蓠(Gracilaria tenuistipitata)的研究中就发现温度的升高没有使藻体对P的吸收增强,而徐智广等[15]对龙须菜(Gracilaria lemaneiformis)P吸收的研究结果显示,在不同的底物浓度下温度对P吸收特性各个参数的影响也存在差别。温度变化对P吸收影响的差异,除了与不同的海藻种类相关外,很可能受到不同条件下海藻其他生理活动的影响,如光合作用、N的代谢等[23]。
光照对营养盐吸收代谢的影响一般通过光合作用的变化实现。光合作用可以为P吸收提供代谢和相关酶合成所需的碳骨架,保证主动运输过程所需的能量供应[22],因此,光照强度的变化与P吸收具有一定的相关性。有研究表明,在一定条件下光照强度与海藻的P吸收速率呈近似的直角双曲线关系[26]。笔者研究证实,随着光照强度的增强,羊栖菜对P的吸收速率逐渐增强,而此前在对龙须菜的研究中却发现当光强较高(10 000 lx)时,海藻对P的吸收受到抑制[15]。羊栖菜与龙须菜P吸收对于光照强度的不同响应,可能是因为红藻特有的天线色素的高效捕光能力使龙须菜更能适应低光生活,而较高光照强度反而容易引起光抑制,对藻体的生理产生不利的影响。从此研究结果可以看出,羊栖菜更能有效抵制高光带来的光抑制等不利影响,从而可以为P吸收提供更多的能量和碳骨架。此试验结果也和羊栖菜分布于潮间带的中潮位,龙须菜分布于潮间带的低潮位,适应不同的光照强度的自然现象相一致。
大型海藻对P的吸收不仅与光合作用联系紧密,同时也与海藻本身的N、P营养史密切相关。LUNDBERG等[27]通过核磁共振的方法研究了绿藻石莼(Ulva lactuca)对N和P的吸收利用关系,结果显示当硝氮的供应增加时,藻体内的多聚磷酸盐含量反而降低,海藻对P的吸收也受到抑制。这一现象的原因可能是硝氮的代谢争夺光合作用供应的能量和碳骨架,从而抑制多聚磷酸盐的合成,最终反馈抑制P的吸收。而李再亮等[28]对羊栖菜的研究表明,P吸收速率与N/P比密切相关,在特定的N/P比下达到最大。笔者研究中高浓度的硝氮刺激了羊栖菜对P的吸收,与LUNDBERG等[27]的结果不同,而与李再亮等[28]的研究结果相似。这一结果也符合大型海藻生长对N、P按一定比例需求的规律[29]。另外,海藻对P的吸收与细胞内磷库的含量呈典型的负相关关系,这在很多微藻的研究中已经得到了证实[30]。笔者研究中也发现了类似的结论:羊栖菜对P的吸收速率与营养史中P的培养浓度刚好呈相反的趋势(图 2-a)。而HURD和DRING[31]对5种墨角藻(Fucus)P吸收动力学的研究表明,在开始的30 min内有一个快吸收,随后的30 min内几乎不吸收,然后维持稳定的中等吸收速率。这种吸收速率随时间变化的原因可能是藻体细胞内的营养库导致,开始的快吸收(10~60 min)用于充盈细胞内的磷库,随后吸收速率下降则是胞内磷库反馈调节的结果,最后的稳定速率则说明在保持一定磷库含量的情况下磷的吸收与同化速率达到了平衡[32]。
综上所述,羊栖菜对无机磷的吸收受到温度、光照强度以及N、P营养史的显著影响。因而在利用羊栖菜规模化栽培来修复富营养化海水时,要充分考虑海藻的栽培季节、挂养水深以及修复周期等与温度、光照强度、营养史相关的环境因素,根据不同的栽培海区条件,选择适宜的栽培方式,以达到理想的修复效果。
-
-
[1] 姚云, 沈志良. 胶州湾海水富营养化水平评价[J]. 海洋科学, 2004, 28(6): 14-17, 22. doi: 10.3969/j.issn.1000-3096.2004.06.004 [2] 徐明德, 韦鹤平, 张海平. 黄海南部近岸海域水质现状分析[J]. 中北大学学报: 自然科学版, 2006, 27(1): 66-70. doi: 10.3969/j.issn.1673-3193.2006.01.017 [3] 赵俊, 过锋, 张艳, 等. 胶州湾湿地海水中营养盐的时空分布与富营养化[J]. 渔业科学进展, 2011, 32(6): 107-114. doi: 10.3969/j.issn.1000-7075.2011.06.017 [4] 杨宇峰, 费修绠. 大型海藻对富营养化海水养殖区生物修复的研究与展望[J]. 青岛海洋大学学报, 2003, 33(1): 53-57. doi: 10.3969/j.issn.1672-5174.2003.01.026 [5] FEI X. Solving the costal eutrophication problem by large scale seaweed cultivation [J]. Hydrobiologia, 2004, 512 (1): 145-151. doi: 10.1023/B:HYDR.0000020320.68331.ce
[6] 何培民, 徐珊楠, 张寒野. 海藻在海洋生态修复和海水综合养殖中的应用研究简况[J]. 渔业现代化, 2005, 32(4): 15-16. doi: 10.3969/j.issn.1007-9580.2005.04.006 [7] 许忠能, 林小涛, 林继辉, 等. 营养盐因子对细基江篱繁枝变种氮、磷吸收速率的影响[J]. 生态学报, 2002, 22(3): 366-374. doi: 10.3321/j.issn:1000-0933.2002.03.012 [8] 汤坤贤, 游秀萍, 林亚森, 等. 龙须菜对富营养化海水的生物修复[J]. 生态学报, 2005, 25(11): 3044-3051. doi: 10.3321/j.issn:1000-0933.2005.11.035 [9] ZHOU Y, YANG H, HU H, et al. Bioremediation potential of the macroalga Gracilaria lemaceiformis (Rhodophyta) integrated into fed fish culture in coastal waters of north China [J]. Aquaculture, 2006, 252(2/3/4): 264-276. https://www.sciencedirect.com/science/article/abs/pii/S0044848605004564
[10] 王翔宇, 詹冬梅, 李美真, 等. 大型海藻吸收氮磷营养盐能力的初步研究[J]. 渔业科学进展, 2011, 32(4): 67-71. doi: 10.3969/j.issn.1000-7075.2011.04.011 [11] IRIHIMOVITCH V, YEHUDAI-RESHEFF S. Phosphate and sulfur limitation responses in the chloroplast of Chlamydomonas reinhardtii [J]. FEMS Microbiol Lett, 2008, 283(1): 1-8. doi: 10.1111/j.1574-6968.2008.01154.x
[12] TYRRELL T. The relative influence of nitrogen and phosphorus on oceanic primary production [J]. Nature, 1999, 400(6744): 525-531. doi: 10.1038/22941
[13] HERNÁNDEZ I, NIELL F X, WHITTON B A. Phosphatase activity of benthic marine algae [J]. J Appl Phycol, 2002, 14(6): 475-487. doi: 10.1023/A:1022370526665
[14] HOPPE H G. Phosphatase activity in the sea [J]. Hydrobiologia, 2003, 493(1/2/3): 187-200. doi: 10.1023/A:1025453918247
[15] 徐智广, 邹定辉, 高坤山, 等. 不同温度、光照强度和硝氮浓度下龙须菜对无机磷吸收的影响[J]. 水产学报, 2011, 35(7): 1023-1029. doi: 10.3724/SP.J.1231.2011.17070 [16] 阮积惠. 羊栖菜的药用功能研究现状[J]. 中国野生植物资源, 2001, 20(6): 8-10. doi: 10.3969/j.issn.1006-9690.2001.06.003 [17] 张鑫, 邹定辉, 徐智广, 等. 不同光照周期对羊栖菜有性繁殖过程的影响[J]. 水产科学, 2008, 27(9): 452-454. doi: 10.3969/j.issn.1003-1111.2008.09.005 [18] 李生尧, 许曹鲁, 李建榜, 等. 羊栖菜"鹿丰1号"人工选育及养殖中试[J]. 渔业科学进展, 2010, 31(2): 88-94. doi: 10.3969/j.issn.1000-7075.2010.02.013 [19] LARSSON C, AXELSSON L, RYBERG H, et al. Photosynthetic carbon utilization by Enteromorpha intestinalis (Chorophyta) from a Swedish rockpool [J]. Eur J Phycol, 1997, 32(1): 49-54. doi: 10.1080/09541449710001719365
[20] BOROWITZKA M A. Microalgal biotechnology [M]. New York: Cambridge University Press, 1988: 457-465. doi: 10.1016/0167-7799(87)90037-0
[21] HARRISON P J. Determining phosphate uptake rates of phytoplankton[M]//LOBBAN C S, CHAPMAN D J, KREMER B P. Experimental phycology: a laboratory manual. New York: Cambridge University Press, 1988: 186-195.
[22] LOBBAN C S, HARRISON P J. Seaweed ecology and physiology [M]. New York: Cambridge University Press, 1994: 75-110. doi: 10.1017/CBO9780511626210
[23] XU Z, ZOU D, GAO K. Effects of elevated CO2 and phosphorus supply on growth, photosynthesis and nutrient uptake in the marine macroalga Gracilaria lemaneiformis (Rhodophyta) [J]. Bot Mar, 2010, 53(2): 123-129. doi: 10.1515/BOT.2010.012
[24] 李恒, 李美真, 徐智广, 等. 不同营养盐浓度对3种大型红藻氮、磷吸收及其生长的影响[J]. 中国水产科学, 2012, 19(3): 462-470. doi: 10.3724/SP.J.1118.2012.00462 [25] PEDERSEN A, KRAEMER G, YARISH C. The effects of temperature and nutrient concentrations on nitrate and phosphate uptake in different species of Porphyra from Long Island Sound (USA) [J]. J Exp Mar Biol Ecol, 2004, 312(2): 235-252. doi: 10.1016/j.jembe.2004.05.021
[26] FLOC′H J Y. Uptake of inorganic ions and their long distance transport in Fucales and Laminariales[M]//SRIVASTAVA L M. Synthetic and degratative processes in marine macrophytes. Berlin: Walter de Gruyter, 1982: 139-165. https://www.semanticscholar.org/paper/UPTAKE-OF-INORGANIC-IONS-AND-THEIR-LONG-DISTANCE-IN-Flex/30b784d2502f596fc9709218c51ef6f0fa350295
[27] LUNDBERG P, WEICH R G, JENSÉN P, et al. 31P and 14N NMR studies of the uptake of phophorus and nitrogen compounds in the marine macroalgae Ulva lactuca [J]. Plant Physiol, 1989, 89(4): 1380-1387. doi: 10.1104/pp.89.4.1380
[28] 李再亮, 申玉春, 谢恩义, 等. 羊栖菜对氮、磷的吸收速率研究[J]. 河南农业科学, 2011, 40(3): 73-77. http://qikan.cqvip.com/Qikan/Article/Detail?id=37814412&from=Qikan_Search_Index [29] SANUDO-WILHELMY S A, TOVAR-SANCHEZ A, FU F X, et al. The impact of surface-adsorbed phosphorus on phytoplankton redfield stoichiometry [J]. Nature, 2004, 432(7019): 897-901. doi: 10.1038/nature03125
[30] 朱小明, 沈国英. 几种浮游单胞藻类P代谢的初步研究[J]. 厦门大学学报, 1996, 635(4): 619-624. doi: 10.3321/j.issn:0438-0479.1996.04.030 [31] HURD C L, DRING M J. Phosphate uptake by intertidal fucoid algae in relation to zonation and season [J]. Mar Biol, 1990, 107(2): 281-289. doi: 10.1007/BF01319827
[32] PEDERSON M F, PALING E I, WALKER D I. Nitrogen uptake and allocation in the seagrass Amphibolis antarctica [J]. Aquat Bot, 1997, 56(2): 105-117. doi: 10.1016/S0304-3770(96)01100-X
-
期刊类型引用(11)
1. 周庆澔,许曹鲁,权伟. 不同条件下羊栖菜溶解有机碳(DOC)分泌特征. 渔业研究. 2023(03): 271-279 .  百度学术
百度学术
2. 陈泽宇,丁雨豪,王静文,倪嘉璇,何昊林,徐加涛,蒋书英,王津果. 温度和氮营养盐对龙须菜生长与光合生理的影响. 湖北农业科学. 2023(12): 94-101 .  百度学术
百度学术
3. Jin Xu,Zhixin Guo,Xiaochun Jiang,Golam Jalal Ahammed,Yanhong Zhou. Light regulation of horticultural crop nutrient uptake and utilization. Horticultural Plant Journal. 2021(05): 367-379 .  必应学术
必应学术
4. 韩婷婷,齐占会,黄洪辉,梁庆洋. 3种氮源加富对半叶马尾藻幼苗生长和生化组成的影响. 渔业科学进展. 2018(04): 159-166 .  百度学术
百度学术
5. 刘棋琴,羊芃,马明婕,周丽亚,李亚鹤,杨锐. 温度对4种大型海藻氮磷吸收效率及光合生理特性的影响. 水生生物学报. 2018(05): 1050-1056 .  百度学术
百度学术
6. 杨安强,史定刚,陈少波,张鹏,王铁杆,关万春. 高CO_2条件下温度和光照对铜藻吸收N、P的短期影响. 浙江农业科学. 2017(02): 303-307 .  百度学术
百度学术
7. 刘迎超,李景玉,宫庆礼. 羊栖菜的生长和生化组成的影响因素. 河北渔业. 2016(08): 55-60 .  百度学术
百度学术
8. 张文文,郭永坚,李俊伟,朱长波,陈素文,颉晓勇. 营养盐对海萝生长和藻体生化成分的影响. 南方水产科学. 2016(02): 30-35 .  本站查看
本站查看
9. 芦薇薇,王巧晗,宫庆礼. 光照强度和温度对巨藻幼孢子体的生长和生化组成的影响. 中国海洋大学学报(自然科学版). 2016(01): 40-48 .  百度学术
百度学术
10. 李钠钾,许安定,单沛祥,江厚龙,杨超,王红锋,沈铮,马浩. 不同双棚管理对烟草漂浮育苗生长发育的影响. 广东农业科学. 2015(14): 36-40 .  百度学术
百度学术
11. 徐智广,朱安成,吴海一. 硝氮和紫外辐射对龙须菜碳氮利用的影响. 广西科学院学报. 2015(03): 219-227 .  百度学术
百度学术
其他类型引用(11)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
