In silico cloning and bioinformatics analysis of the cDNA encoding a PGRP in Homarus americanus
-
摘要:
利用电子克隆方法,获得编码美洲螯龙虾(Homarus americanus)肽聚糖识别蛋白(peptidoglycan recognition protein, PGRP)的cDNA序列及相应的氨基酸序列;采用生物信息学方法对其进行基本理化性质、亲疏水性、信号肽、二级结构、三级结构、细胞定位等的分析。结果获得一段长920 bp的编码美洲螯龙虾PGRP的cDNA序列,包含一个长834 bp的开放阅读框,编码277个氨基酸;编码蛋白是含有信号肽的分泌蛋白,含有1个C端PGRP结构域,表明是一种PGRP;分析结果显示该蛋白与黑腹果蝇(Drosophila melanogaster)短型PGRP-SC2和PGRP-SD比较相似。
Abstract:We obtained a cDNA sequence that encoding a putative peptidoglycan recognition protein (PGRP) of American lobster, Homarus americanus, by in silicon cloning in this study; and analyzed the deduced protein by bioinformatics methods in terms of its general physical and chemical properties, hydrophobicity, signal peptide, secondary / tertiary structure and localization sites in cells. The results show that the obtained 920 bp long cDNA contains an open reading frame (834 bp) which encoding a protein with 277 amino acids. The protein has a signal peptide in its N terminal, a PGRP domain in its C terminal, which means that the protein maybe is a secretory protein, short type PGRP. Phylogeny analysis indicates that the protein is more like the PGRP-SC2 and PGRP-SD in Drosophila melanogaster.
-
转化生长因子β(transforming growth factor beta,TGF-β)超家族是一类多效应细胞因子,在抑制肿瘤、细胞增殖、细胞分化、组织形成、世系决定、细胞迁移和细胞凋亡等多种生理过程中发挥重要作用[1]。TGF-β超家族成员包括转化生长因子β(TGF-β)、活化素(activin)和节/骨形成蛋白(bone morphogenetic protein,BMP)3个家族。狭义上的TGF-β通常指的是TGF-β家族。TGF-β既能促进细胞增殖,又能抑制细胞增殖;能控制细胞外基质的形成,如促进胶原蛋白的合成;通过调节细胞外基质诱导细胞凋亡和调控形态发生;TGF-β也是一种神经蛋白,能刺激神经生长因子的形成[2]。研究表明,TGF-β系统与人类多种疾病有重大关联,如心脏疾病[3]、微血管疾病[4]和癌症[5]等。在哺乳动物中对TGF-β及其受体的报道每年有数百篇,足以说明TGF-β系统的重要性。近年来,有许多学者在低等脊椎动物中对TGF-β系统进行了研究,而鱼类具有其独特的生活环境和进化历史上的特殊意义,因此TGF-β系统在低等脊椎动物中的研究又集中在鱼类上。
1. TGF-β介绍
TGF-β第一次是从人胎盘中发现的[6],在哺乳动物中已发现了3种TGF-β(1/2/3),其中TGF-β1在免疫系统中发挥主要功能[7]。在鸟类中发现有3种TGF-β(TGF-β2/3/4),两栖类中发现有2种TGF-β(TGF-β2/5),已有证据表明鸟类的TGF-β4和两栖类的TGF-β5是TGF-β1进化的前体,因此也称之为TGF-β1[8]。到目前为止,在硬骨鱼中发现了4种TGF-β(TGF-β1/2/3/6)。
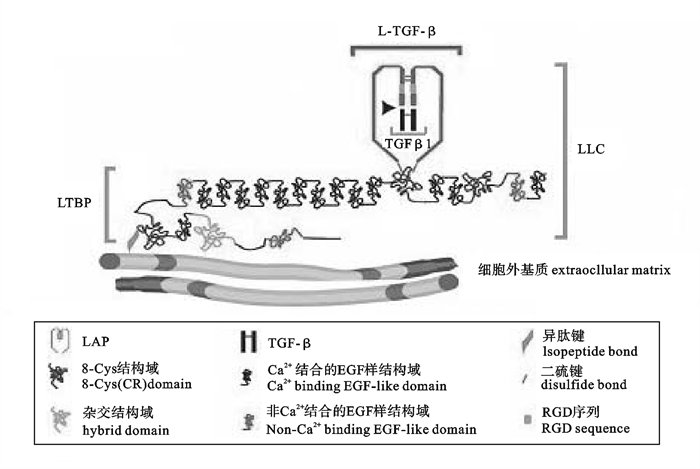
![]() 图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)
图 1 TGF-β大潜在复合物(LLC)示意图[15]Figure 1. TGF-β large latent complex(LLC)哺乳动物TGF-β主要是由T细胞产生,但是在其他的细胞中都有表达。其他主要来源包括血小板、巨噬细胞、噬中性粒细胞、骨和软组织如胎盘、肾、子宫内膜和疾病细胞,通过自分泌和旁分泌的方式产生[2]。
哺乳动物中的3种TGF-β都可以在转录水平进行调控。TGF-β2和TGF-β3的启动子都包含有TATAA框和一个普通的近端CRE-ATF位点,这说明这些启动子都服从激素和发育调控[9]。TGF-β1的启动子缺少经典的TATAA框,但是有多元的调控位点,能够被c-jun、c-Fos和egr-1以及很多的致癌基因如abl、fos、jun、ras和src激活[10]。TGF-β1启动子的活性能被肿瘤抑制物所抑制[11]。低等脊椎动物中目前尚未见有关TGF-β转录调控方面的研究报道。
TGF-β是以前体蛋白的形式编码,每种TGF-β都是由一个单独的基因编码。TGF-β蛋白前体在细胞内经过一系列的加工过程后才分泌到细胞外。其中最重要的一步是前体蛋白的水解,将前体蛋白的N端切掉,是在高尔基体中由弗林蛋白酶(Furin-like peptidase)水解[12]。另有研究表明C型胶原蛋白酶也能裂解此位点[13],切掉的N端多肽又会形成二聚体,称为潜在关联蛋白(latency-associated protein,LAP),它与成熟TGF-β同型二聚体非共价结合,该复合体称为潜在的TGF-β(latent TGF-β,L-TGF-β)或小潜在复合体(small latent complex,SLC)。该复合体可以直接分泌到细胞外,或者再与潜在TGF-β结合蛋白(latent TGF-β binding protein,LTBP)相结合形成一个大的潜在复合体(large latent complex,LLC)而分泌,LTBP在使TGF-β靶向细胞外基质中发挥重要作用[14-15]。
哺乳类TGF-β1 LAP(LAP-1)的结构被广泛研究,LAP-1包含N端连接的糖链,其中2个含有甘露糖-6-磷酸基团,可以与细胞表面的甘露糖-6-磷酸盐/胰岛素样生长因子Ⅱ受体相互作用[16]。人类LAP-1含有3个半胱氨酸残基,223和225位置上的半胱氨酸对LAP形成链间二硫键十分重要。在223和225位置上的半胱氨酸用丝氨酸代替后,TGF-β1可直接以活性的形式分泌,表明这2个位置的半胱氨酸对LAP-1和TGF-β1的结合非常重要。此外,第33位的半胱氨酸与LTBP的结合有关[17]。LTBP具有15~19个表皮生长因子(EGF)样重复和多个半胱氨酸残基。LTBP的另一个功能是在高尔基体与L-TGF-β结合使SLC快速分泌。然而LTBP被广泛研究的功能是使L-TGF-β定位到细胞外基质,从而形成一个细胞外基质中的TGF-β库[18]。
TGF-β与LAP和LTBP结合时不能直接与受体结合,需要从复合物中释放出活性形式的TGF-β。在体外可以通过pH(2和8)、加热(100 ℃)或某些蛋白酶等条件使其释放[15]。至于在体环境是通过什么机制释放出活性的TGF-β,目前并没有确切的定论。但是学者们提出了几种假说,包括:1)通过反式谷氨酰胺酶水解活化假说[15];2)通过与血小板反应素物理接触改变LAP构想假说[19];3)表皮细胞αvβ6整联蛋白机械牵引假说[20-21]。
近期有报道MG63骨肉瘤细胞分泌到胞外的热休克蛋白HSP90β会抑制潜在TGF-β1的激活[22]。
2. TGF-β受体及信号通路
TGF-β受体的发现,最早是通过将125I-TGF-β化学交联到细胞表面的结合蛋白,再用凝胶电泳的方法分离交联上的配体受体复合体物,发现大多数细胞有3种膜表面的TGF-β结合蛋白,根据电泳的迁移率命名为Ⅰ型, Ⅱ型和Ⅲ型[23-24]。TGF-β Ⅰ型受体(TGF-β Receptor Ⅰ,TβRⅠ)和Ⅱ型受体(TGF-β Receptor Ⅱ,TβRⅡ)主要介导TGF-β的信号转导,这2种受体均为有单跨膜结构域的丝氨酸-苏氨酸激酶,氨基酸序列具有相当大的同源性[25]。一般TβRⅠ比TβRⅡ氨基酸序列要少。对人TβRⅡ氨基酸分析表明含有一个信号肽、一个136个氨基酸的N-糖基化的胞外结构域和一个主要是由激酶结构域组成的胞内结构域。2种受体胞外部分含有多个半胱氨酸,包括一个由3个半胱氨酸组成的半胱氨酸簇,表明受体自身的折叠和与配体的结合需要有很多二硫键。TβRⅠ和TβRⅡ均会形成同源二聚体,该二聚体的形成不依赖于配体结合。TβRⅠ在激酶结构域之前有一个SGSGSGLP的高度保守序列标签(GS结构域)[25]。TβRⅠ和TβRⅡ示意图见图 2-a。从目前研究结果来看,脊椎动物的TGF-β受体在结构上非常保守。
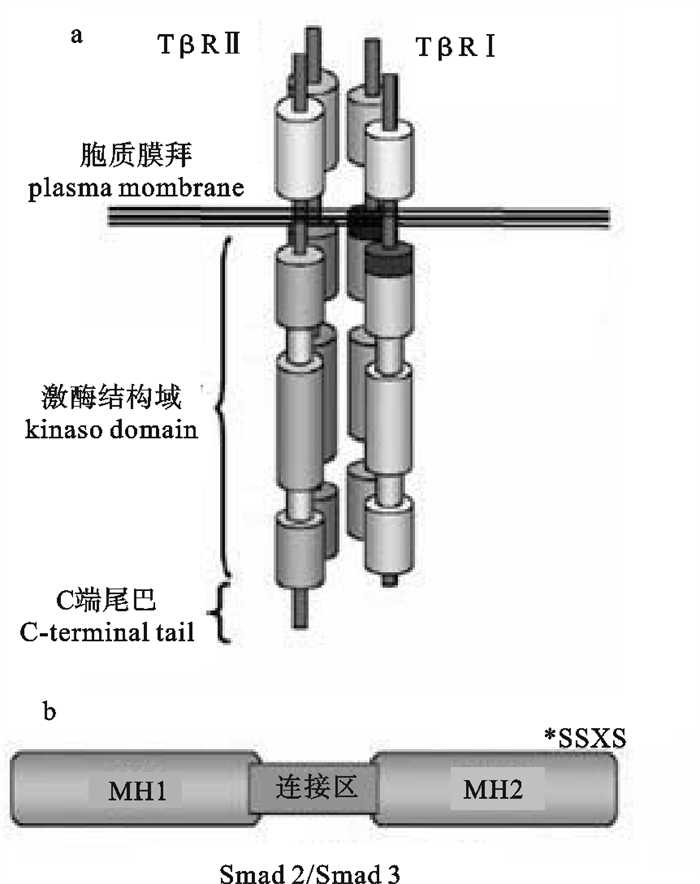
![]() 图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)
图 2 TβRI/TβRⅡ四聚体示意图(a),R-Smad 2和R-Smad 3结构示意图[26],MH,Mad同源结构域(b)Figure 2. Proposed basic tetrameric complex of TβRI/TβRⅡ(a), basic schematic of R-Smad 2 and R-Smad 3 structure, MH, Mad Homology domain(b)TGF-β Ⅲ型受体(TGF-β Receptor Ⅲ,TβRⅢ),又称β蛋白聚糖,在很多种类的细胞中都有表达,是表达量最高的TGF-β受体。TβRⅢ也是跨膜受体,但是缺少酶的基序,不能直接与配体结合。因此认为TβRⅢ在TGF-β信号中发挥间接功能[25]。
成熟的TGF-β二聚体到达目标细胞表面时,与TβRⅡ同源二聚体结合,TβRⅡ激酶活性使其自身磷酸化,TGF-β-TβRⅡ复合物向TβRⅠ二聚体靠近,并磷酸化TβRⅠ而激活其激酶活性。因此活化的配体受体复合物是一个异源的六聚体,由1个TGF-β二聚体以及TβRⅠ和TβRⅡ各自的同源二聚体组成[27]。随后TβRⅠ磷酸化细胞内的Smad蛋白。脊椎动物Smad蛋白可以分为3个亚族:受体活化型Smad(R-Smad)、通用介导型Smad 4(Co-Smad)和抑制型Smad(Ⅰ-Smad,Smad 6和Smad 7)[28]。R-Smad包括BMP活化型(Smad 1、Smad 5、Smad 8)和TGF-β活化型(Smad 2、Smad 3)。R-Smad和Co-Smad是由2个Mad同源结构域(MH 1和MH 2)组成,通过连接区连接(图 2-b)。Ⅰ-Smad没有明显的MH1结构域,只有MH2结构域。非洲爪蟾(Xenopus laevis)有2种Smad 4,Smad 4α和Smad 4β,由2个基因编码。虽然2种Smad 4的氨基酸具有80%的同源性,但是其发育表达模式、亚细胞定位(Smad 4α主要在细胞质中,Smad 4β主要在细胞核中)和磷酸化水平截然不同。非洲爪蟾Smad 4β具有强的腹部形成诱导功能[29]。TβRⅠ磷酸化激活后使R-Smad C端SSXS基序磷酸化,SSXS基序在所有R-Smad中都是高度保守的,随后R-Smad与TβRI分离,与Smad 4形成复合物后进入细胞核,再与一些转录因子结合激活基因的转录[2]。尽管Co-Smad 4能够帮助R-Smad进入细胞核,但是R-Smad在没有Co-Smad 4的情况下也能进入到细胞核[20, 30]。R-Smad蛋白招募至受体复合物是由辅助蛋白介导的,例如Smad锚向受体活化蛋白(SARA)[31]。TGF-β与受体结合后,Smad 2和Smad 3被TβRⅠ磷酸化激活,再与Smad 4一起形成复合体进入细胞核,作用于Smad结合元件(Smad Binding Elements,SBE)。Ⅰ-Smad抑制TGF-β信号通过以下几种途径:1)与R-Smad竞争结合TβRⅠ;2)招募E3泛素连接酶Smurf 1/2使TβRⅠ泛素化而随之降解;3)与Smad 4作用,阻止R-Smad-Smad 4复合物的形成;4)直接抑制Smad引起的转录应答[20, 31]。一种重要抑制Smad功能的方式是招募Smad协同抑制因子,如c-Ski和SnoN[32-33]。
TGF-β信号的负调控有如下几个方面:1)通过Smurf途径使TGF-β受体降解;2)抑制TGF-β受体的活性;3)通过磷酸酶终结Smad信号;4)通过E3泛素连接酶关闭R-Smad和Smad 4;5)隔离Smad使其不参与活化的信号通路;6)抑制Smad的转录活性;7)Smad转录后修饰之间的竞争以及稳定性和活力之间的相互作用[31]。有些TGF-β的负调节因子,如Ⅰ-Smad和SnoN都是TGF-β直接作用的目的基因。
TGF-β除了能激活Smad依赖性通路外,也可以激活其他一些Smad非依赖性信号通路。已经证明,TGF-β刺激细胞后能快速激活Ras-Erk、TAK-MKK4-JNK、TAKMKK3/6-p38、Rho-Rac-cdc42 MAPK和PI3K-Akt通路,但是详细的机制目前并没有阐明[20]。TGF-β引起的Erk和JNK途径的激活可以导致Smad的磷酸化并调节Smad的激活。此外,TGF-β引起的Ras/Erk MAPK通路的激活会刺激TGF-β的表达,从而放大TGF-β的应答和导致二次TGF-β应答[34]。TGF-β1在CD4+T细胞中对IFN-γ引起的信号和Th1基因表达的抑制作用是Smad 3非依赖性的,但是MEK/ERK依赖性的[35]。最近又在小鼠(Mus muscculus)中发现TGF-β诱导IKK,p38和JNK的激活需要TAK1赖氨酸158残基[36]。
3. TGF-β及其受体在鱼类中的研究进展
3.1 TGF-β1在鱼类中的研究进展
TGF-β在鱼类中的研究还处于初步阶段,但是最近几年有关的研究也逐步增多,主要集中在TGF-β1。
3.1.1 与免疫和疾病相关
目前研究表明,TGF-β1与鱼类的免疫功能有着巨大的关系。ZHAN等[37]从鲤(Cyprinus carpio)活化的头肾淋巴细胞中克隆得到第一个鱼类的TGF-β1基因,其ORF编码376个氨基酸,包括与其他TGF-β蛋白一样的保守半胱氨酸。鲤TGF-β1在头肾、脾、卵和肝脏的表达量很少,但是用伴刀豆球蛋白A(Con A)激活头肾淋巴细胞后TGF-β1 mRNA水平会明显上升。HARMS等[38]从杂交狼鲈(Morone saxatilis×M.chrysops)头肾单核细胞中克隆到TGF-β1基因,其mRNA表达水平在外周血单核细胞中比脾和头肾中要高,初步显示TGF-β1的功能与免疫机制相关。笔者实验室也发现用聚肌胞苷酸(Poly I: C)或Con A刺激斜带石斑鱼(Epinephelus coioides)头肾淋巴细胞后,TGF-β1表达量明显上升,与在其他鱼中具有相似性[39]。YANG等[40]报道从草鱼(Ctenopharyngodon idellus)中克隆到TGF-β1 cDNA全长,组织分布表明TGF-β1 mRNA主要在胸腺、头肾和脾中大量分布,并发现重组人TGF-β1蛋白能诱导外周血淋巴细胞(PBL)增殖,但是也能显著抑制植物血凝集素(PHA)和脂多糖(LPS)刺激的PBL增殖,而且和脂多糖一样能显著上调草鱼MHCⅠmRNA表达。HADDAD等[41]从金鱼(Carassius auratus)中克隆到TGF-β1 cDNA序列。重组表达的金鱼TGF-β1成熟肽以剂量依存的方式促进金鱼成纤维细胞系(CCL71)的增殖。此外,重组的金鱼TGF-β1能够下调TNF-α活化的巨噬细胞一氧化氮应答。这是首次对硬骨鱼TGF-β1功能的报道。CAI等[42]报道真鲷(Pagrus major)的TGF-β1在诱导淋巴细胞迁移中具有两极特性。重组真鲷TGF-β1以剂量依赖的方式显著促进头肾和外周血淋巴细胞的迁移,但又能够抑制由LPS激活的淋巴细胞迁移。这是首次在鱼类中报道TGF-β1在调节鱼类免疫功能中具有天生的两极特性。最近,YANG等[43]又报道在草鱼白细胞中TGF-β1表现出对立的效应。TGF-β1能持续刺激外周血白细胞的活力和促炎症因子(TNF-α和IFN-γ)与T/B细胞标签[Cd4-like (Cd4l),Cd8α,Cd8β和Ig μ]的产生,但是在头肾白细胞中却相反。并表明TGF-β1可能通过下调ALK5 mRNA和蛋白水平,使草鱼白细胞对TGF-β1的敏感性下降。再次证明在硬骨鱼免疫功能中TGF-β1发挥正调控和负调控双重功能。
除了从理论上研究TGF-β1与免疫功能相关,有直接的研究表明TGF-β1与鱼类疾病有关。HARMS等[44]报道,用海鱼杆菌(Mycobacterium marinum)感染条纹狼鲈(M.saxatilis),其脾单核细胞TGF-β1 mRNA表达比未感染组要低,但是感染的杂交罗非鱼(Oreochromis spp.)和未感染鱼之间没有明显的变化。JOHNSON等[45]报道给大西洋油鲱(Brevoortia tyrannus)体腔注射去炎松导致其脾单核细胞TGF-β1 mRNA水平受到抑制,提示可能与大西洋油鲱发育过程中溃疡性皮肤损害的机制有关。LILLEENG等[46]报道在用大豆粉饲养大西洋鲑(Salmo salar)时TGF-β1明显下调,提示有可能和大西洋鲑大豆肠病的发病机理有关。已经报道用来源于欧鲶(Silurus glanis)和褐篮子鱼(Siganus fuscescens)的虹彩病毒(family Iridoviridae)刺激鱼的上皮瘤细胞后,引起TGF-β1短暂上升[47];嗜冷黄杆菌感染(Flavobacterium psychrophilum)的虹鳟(Oncorhynchus mykiss)脾脏TGF-β1下调,表明染病的鱼免疫系统变弱[48]。最近又发现TGF-β与藻毒素引起的免疫毒性效应有关,草鱼血和头肾淋巴细胞在藻毒素刺激后,TGF-β1 mRNA水平会上升[49]。这些证据表明很多鱼类在受到病害侵袭时,TGF-β1的表达水平都会有所变化,但是TGF-β1具体是如何参与到疾病的过程中,目前还没有阐明。
3.1.2 与生殖相关
TGF-β1除了与免疫和疾病相关之外,另一个主要功能是与生殖相关。KOULI等[50]从斑马鱼(Danio rerio)的卵巢中克隆到TGF-β1的cDNA序列,TGF-β1成熟肽区域与其他物种的相似度达到70%~85%。并发现TGF-β1能以剂量依赖和时间依赖的方式显著抑制促性腺激素和17α, 20β-二羟孕酮诱导的卵母细胞成熟,首次在鱼类中证明TGF-β1能调节卵母细胞的成熟。同时证明,TGF-β/Smad信号通路在斑马鱼卵巢中存在。TAN等[51]报道TGF-β1能够抑制膜黄体酮受体[membrane progestin receptors (mPRs)]β,而不能抑制受体α,以此来调节卵母细胞的成熟。JIN等[52]报道在斑马鱼卵泡细胞中TGF-β信号需要依赖动力蛋白轻链zkm23。研究TGF-β1在生殖中的作用对鱼类的繁殖育种有着重大意义。
3.1.3 与肝脏功能相关
最近,HOBBIE等[53]报道二甲基亚硝铵处理的青鳉(Oryzias latipes),肝脏TGF-β1表达升高,并且随着二甲基亚硝铵处理浓度的升高,胆囊上皮细胞、中间细胞、不成熟肝细胞和少量的成熟肝细胞中TGF-β1蛋白水平上升,显示TGF-β1与肝功能有关。
3.1.4 TGF-β1序列特点
从已经克隆到的鱼类TGF-β1cDNA序列分析发现,序列具有很高的保守性,与其他脊椎动物相似。它们均具有保守的9个半胱氨酸(草鱼和鲤在第7个保守半胱氨酸位点处被精氨酸代替),这也是TGF-β成员的一个标志性特征。其中的8个半胱氨酸以成对的方式形成分子中心区的4对链内二硫键,结合第9个半胱氨酸形成链间二硫键,一起形成TGF-β二聚体。前体肽均具有特征性标志成熟肽起始的KEX-Furin样蛋白酶识别位点RXXR。并且都具有整合素结合位点RGD,RGD能够与整合素特异结合,例如能够与αvβ6特异结合,从而使潜活型的TGF-β1活化[15]。而在大海马(Hippocampus kuda)TGF-β1序列中则由RSD取代了RGD[54],其中丝氨酸和甘氨酸具有相似的物理性质,都为亲水性的中性氨基酸,但转换的具体原因还不清楚。
3.2 TGF-β其他成员在鱼类中的研究进展
TGF-β家族的成员除了TGF-β1,常见的还有TGF-β2和TGF-β3。SUMATHY等[55]第一次从鲤中克隆得到TGF-β2基因,根据推测的氨基端列与人的TGF-β2基因比对,显示鲤TGF-β2前体蛋白和成熟蛋白与人的TGF-β2的前体蛋白和成熟蛋白相似度分别为81%和93%。LAING等[56]从钝吻鲟(Acipenser baeri)、虹鳟和欧洲鳗鲡(Anguilla anguilla)中克隆到部分核苷酸序列,证明TGF-β3在辐鳍亚纲的硬骨鱼中存在。LAING等[57]进一步在鲽(Pleuronectes platessa)中证明同时存在多种TGF-β基因。CHEAH等[58]报道在斑马鱼中克隆到TGF-β3 cDNA全长,显示该基因是由7个外显子组成,定位在14q24号染色体连锁群17的一部分。在转录起始位点的上游具有1个刺激蛋白1[Stimulating protein 1 (Sp1)]和2个TATA结合蛋白(TBP)的结合位点。TGF-β3在发育的胸鳍中大量表达,而没有在哺乳动物前肢中有类似的报道,表明TGF-β3在鱼类早期发育中具有新的功能。FUNKENSTEIN等[59]报道在金鲷(Sparus aurata)中发现一种新的TGF-β,其基因由7个外显子组成,预测编码420个氨基酸。基因组成与小鼠和鸡的TGF-β2相似,但氨基酸比对发现是一种新的在鱼类中特有的TGF-β,命名为TGF-β6,并发现TGF-β6能通过营养水平调节骨骼肌生长。目前还没有在其他脊椎动物中有关于TGF-β6的报道。
3.3 TGF-β受体在鱼类中的研究进展
对于鱼类TGF-β受体的研究还很少。最早是KOHLI等[50]在斑马鱼卵巢中克隆到TGF-β1的同时也克隆出TβRⅡ的cDNA序列,这是第一次在鱼类中报道的TβRⅡ,其激酶结构域与其他物种高度保守。MAEHR等[60]报道在虹鳟中克隆到2种TGF-β受体(TβRI和TβRⅡ)。从得到的虹鳟TβRI和TβRⅡ序列发现,其具备TβRI和TβRⅡ受体家族的所有特点,包括1个富含半胱氨酸的胞外结构域、1个跨膜结构域和1个丝氨酸/苏氨酸激酶结构域,并且激酶结构域高度保守。组织分布显示TβRI在胸腺和脾脏高表达;TβRⅡ在皮肤、胸腺和后肾中高表达,表明2种受体与免疫功能相关。同时2种受体在肌肉中都有很高表达,说明其与生长发育有关。同时,研究了各种刺激剂(LPS、Poly I: C、PHA、PMA、CI)刺激头肾淋巴细胞后对2种受体mRNA水平的影响,显示PHA、PMA、CI能下调2种受体的表达,首次深入了解2种受体在鱼类免疫过程中的调节情况。但是对TGF-β受体在鱼类中的研究还有待进一步深入。
4. 小结
TGF-β是一类非常重要的细胞因子,在脊椎动物的多种生理活动中都有所涉及。每年在哺乳动物中关于TGF-β系统相关的研究数以百计,其重要性可见一斑。而目前在硬骨鱼中对TGF-β通路的研究还处于初级阶段,其中大部分的研究都集中在TGF-β家族中的成员TGF-β1。对TGF-β1的研究主要集中在免疫疾病和生殖方面,最近也有涉及肝脏方面,而对TGF-β家族其他成员的研究较少。到目前为止,对于TGF-β受体在硬骨鱼中的研究只有在斑马鱼和虹鳟中有过报道。
由于进化过程中基因组复制的原因,鱼类中很多基因的拷贝数不同于哺乳动物。笔者实验室在尼罗罗非鱼(O.niloticus)中分离出2种TGF-β2和2种TGF-β3,并且在功能上也有差异(待发表)。因此,硬骨鱼中TGF-β系统还有很多是没有涉及到的,有待进一步研究。
由于TGF-β系统的重要性,未来在硬骨鱼中的研究,应该在理论研究的同时,紧密联系实际生产,向着抗病、促生长和繁殖育种等方向发展。
-
表 1 以美洲螯龙虾PGRP为查询序列对GenBank蛋白质非冗余数据库(nr)BLAST搜索获得的部分结果
Table 1 Result of BLAST research in protein database (nr) of GenBank using PGRP of H.americanus as query
描述
description最大值
Max score总体值
total score覆盖率
query cover期望值
E value最大一致性
Max ident查询号
accession夏威夷短尾乌贼 PGRP3 precursor [Euprymna scolopes] 184 184 59% 1e-53 46% AAY27975.1 夏威夷短尾乌贼 PGRP2 precursor [E.scolopes] 181 181 64% 5e-53 46% AAY27974.1 长牡蛎 PGRPS3 [Crassostrea gigas] 179 179 60% 2e-51 48% BAG31899.1 长牡蛎 PGRP S1S [C.gigas] 181 181 60% 2e-51 48% BAG31896.1 夏威夷短尾乌贼 PGRP4 [E.scolopes] 178 178 65% 6e-51 45% AAY27976.1 长牡蛎 PGRPS1L [C.gigas] 179 179 59% 2e-50 48% BAG31897.1 长牡蛎 PGRP SC2 [C.gigas] 174 174 60% 7e-50 46% EKC26200.1 大竹蛏 PGRP[Solen grandis] 174 174 74% 3e-49 42% AEW43446.1 长牡蛎 PGRPS2 [C.gigas] 170 170 59% 1e-48 47% BAG31898.1 文昌鱼 short PGRP[Branchiostoma japonicum] 169 169 64% 1e-47 45% AFH35135.1 夏威夷短尾乌贼 PGRP1 [E.scolopes] 167 167 60% 1e-47 44% AAY27973.1 蜜蜂 PGRP S2 precursor [Apis mellifera] 166 166 58% 3e-47 46% NP_001157188.1 囊螺 PGRP[Physella acuta] 166 166 60% 4e-47 46% AEH26026.1 沙巴蜂 PGRP S2 [A.koschevnikovi] 164 164 56% 6e-47 48% ACT66890.1 黑小蜜蜂 PGRP S2 [A.andreniformis] 164 164 56% 7e-47 48% ACT66891.1 达氏按蚊 PGRP[Anopheles darlingi] 165 165 65% 9e-47 44% ACI30152.1 表 2 美洲螯龙虾PGRP亚细胞定位
Table 2 Subcellular localization of PGRP of H.americanus
亚细胞定位
subcellular localization可能性/%
probability细胞外(包括细胞壁)
extracellular,including cell wall66.7 囊泡 vacuolar 11.1 内质网 endoplasmic reticulum 11.1 线粒体 mitochondrial 11.1 表 3 美洲螯龙虾PGRP功能预测结果
Table 3 Functional prediction results of PGRP of H.americanus
基因本体论类别
gene ontology category可能性
Prob机率
odds信号转导 signal_transducer 0.131 0.611 受体 receptor 0.188 1.104 激素 hormone 0.001 0.206 结构蛋白 structural_protein 0.001 0.044 转运蛋白 transporter 0.025 0.226 离子通道 ion_channel 0.010 0.175 电压门控离子通道 voltage-gated_ion_channel 0.002 0.101 阳离子通道 cation_channel 0.010 0.215 转录 transcription 0.044 0.346 转录调控 transcription_regulation 0.031 0.247 应激蛋白 stress_response 0.151 1.714 免疫反应 immune_response => 0.171 2.015 生长因子 growth_factor 0.022 1.584 金属离子运输 metal_ion_transport 0.025 0.054 -
[1] MCTAGGART S J, CONLON C, COLBOURNE J K, et al. The components of the Daphnia pulex immune system as revealed by complete genome sequencing [J]. BMC Genomics, 2009, 10: 175. doi: 10.1186/1471-2164-10-175
[2] 陈杨, 凌尔军. 斯氏按蚊肽聚糖识别蛋白基因PGRP-LC1的克隆及功能分析[J]. 昆虫学报, 2010, 53 (2): 131-138. https://d.wanfangdata.com.cn/periodical/kcxb201002002 [3] 毛勇, 王军, 张之文, 等. 眼斑拟石首鱼肽聚糖识别蛋白2的基因克隆与组织表达特性[J]. 厦门大学学报: 自然科学, 2010, 49 (6): 850-857. https://d.wanfangdata.com.cn/periodical/xmdxxb201006020 [4] 齐志涛, 高谦, 黄贝, 等. 非洲爪蟾短型肽聚糖识别蛋白基因的克隆与鉴定[J]. 水生生物学报, 2010, 34 (5): 922-926. doi: 10.3724/SP.J.1035.2010.00922 [5] 刘贵生, 袁芳艳, 罗青平. 哺乳动物固有免疫中肽聚糖识别蛋白研究进展[J]. 国际免疫学杂志, 2011, 34 (6): 332-336. doi: 10.3760/cma.j.issn.1673-4394.2011.06.002 [6] 韦嵩, 宋晓玲, 李赟, 等. 肽聚糖识别蛋白研究进展[J]. 动物医学进展, 2007, 28 (1): 61-64. doi: 10.3969/j.issn.1007-5038.2007.01.017 [7] JOHNSON M, ZARETSKAYA I, RAYTSELIS Y, et al. NCBI BLAST: a better web interface[J]. Nucleic Acids Res, 2008, 36(Web Server issue): W5-W9. doi: 10.1093/nar/gkn201
[8] HUANG X, MADAN A. CWAP3: a DNA sequence assembly program [J]. Genome Res, 1999, 9(9): 868-877. doi: 10.1101/gr.9.9.868
[9] ROMBEL I T, SYKES K F, RAYNER S, et al. ORF-FINDER: a vector for high-throughput gene identification [J]. Gene, 2002, 282(1/2): 33-41. doi: 10.1016/S0378-1119(01)00819-8
[10] WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASy server[J]. Methods Mol Biol, 1999, 112: 531-552. doi: 10.1385/1-59259-890-0:571
[11] PETERSEN T N, BRUNAK S, VON HEIJNE G, et al. SignalP 4.0: discriminating signal peptides from transmembrane regions[J]. Nat Methods, 2011, 8(10): 785-786. doi: 10.1038/nmeth.1701
[12] SCHULTZ J, MILPETZ F, BORK P, et al. SMART, a simple modular architecture research tool: identification of signaling domains[J]. Proc Natl Acad Sci USA, 1998, 95(11): 5857-5864. doi: 10.1073/pnas.95.11.5857
[13] GUEX N, PEITSCH M C, SCHWEDE T. Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer: a historical perspective[J]. Electrophoresis, 2009, 30(Suppl 1): S162-173. doi: 10.1002/elps.200900140
[14] KANG D, LIU G, LUNDSTROM A, et al. A peptidoglycan recognition protein in innate immunity conserved from insects to humans [J]. Proc Natl Acad Sci USA, 1998, 95(17): 10078-10082. doi: 10.1073/pnas.95.17.10078
[15] KISELEV S L, KUSTIKOVA O S, KOROBKO E V, et al. Molecular cloning and characterization of the mouse tag7 gene encoding a novel cytokine[J]. J Biol Chem, 1998, 273(29): 18633-18639. doi: 10.1074/jbc.273.29.18633
[16] HOFFMANN J A, KAFATOS F C, JANEWAY C A, et al. Phylogenetic perspectives in innate immunity [J]. Science, 1999, 284(5418): 1313-1318. doi: 10.1126/science.284.5418.1313
[17] EVANS J D, ARONSTEIN K, CHEN Y P. Immune pathways and defence mechanisms in honey bees Apis mellifera[J]. Insect Mol Biol, 2006, 15(5): 645-656. doi: 10.1111/j.1365-2583.2006.00682.x
[18] ZOU Z, EVANS J D, LU Z, et al. Comparative genomic analysis of the Tribolium immune system[J]. Genome Biol, 2007, 8(8): R177. doi: 10.1186/gb-2007-8-8-r177
[19] CHARROUX B, RIVAL T, NARBONNE-REVEAU K, et al. Bacterial detection by Drosophila peptidoglycan recognition proteins [J]. Microbes Infect, 2009, 11(6/7): 631-636. doi: 10.1016/j.micinf.2009.03.004
[20] LIU H, WU C, MATSUDA Y, et al. Peptidoglycan activation of the proPO-system without a peptidoglycan receptor protein (PGRP)? [J]. Dev Comp Immunol, 2011, 35(1): 51-61. doi: 10.1016/j.dci.2010.08.005
-
期刊类型引用(1)
1. 刘春晓,吕为群,杨志刚,陈阿琴. TGF-β/Smad信号通路响应光周期变化参与调控斑马鱼卵巢发育. 南方水产科学. 2019(03): 68-75 .  本站查看
本站查看
其他类型引用(10)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
