Study on LC-MS/MS method for determination of Tylosin residues in aquatic products
-
摘要:
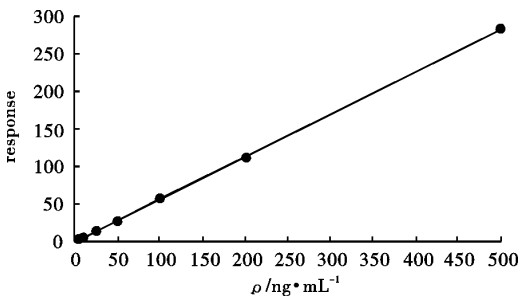
为了建立鱼、虾中泰乐菌素残留量的液相色谱串联质谱检测方法,文章通过对液相色谱和质谱条件、预处理、分离、纯化方法的探讨,确定了以罗红霉素为内标,先用乙腈提取,中性氧化铝柱净化,加异丙醇旋转蒸发至干,定容,过膜,上机测试。所建立的分析方法,泰乐菌素在1.0~500 ng·mL-1质量浓度范围内呈良好的线性关系,相关系数均大于0.998,检出限为0.5 μg·kg-1,定量限为1.0 μg·kg-1。经过验证,在鲫(Carassius auratus)、对虾(Penacus orientalis)和草鱼(Ctenopharyngodon idellus)3种样品中的加标试验,3个不同质量浓度水平的加标回收率为82.40%~100.70%,相对标准偏差为0.86%~5.82%,符合对水产品中药物残留检测的技术要求。
Abstract:To establish LC-MS/MS method for the determination of Tylosin residues in aquatic products, we optimized the LC and MS conditions, pretreatment, separation and purification, used roxithromycin as internal standard and acetonitrile as extraction solution, purified the neutral alumina column, rotarily evaporated with isopropyl alcohol, dissolved and filtered, and finally injected into the instrument.The established method has a good linear relationship in the concentration range from 1.0 ng·mL-1 to 500 ng·mL-1 with coefficient greater than 0.998.The LOD and LOQ are 0.5 μg·kg-1 and 1.0 μg·kg-1, respectively.Moreover, we designed 3 spike tests with different concentrations in Carassius auratus, Penacus orientalis and Ctenopharyngodon idellus, and it is proved that their recoveries of standard addition and RSDs are 82.40%~100.70% and 0.86%~5.82%, respectively.
-
Keywords:
- Tylosin /
- drug residues /
- determination
-
海洋双壳类贝壳的颜色过去仅被作为分泌产物而一直被忽视。事实上双壳类贝壳的颜色不仅与它们的生态和行为有关,还与其生长、存活等性状有关[1-9]。目前,对贝类壳色多态现象的研究有一些相关报道[10-11],但对于不同壳色贝类间的杂交研究很少。INNES和HALEV[12]通过单体杂交,研究了贻贝(Mytilus edulis)壳色多态的可遗传性,发现少见的棕壳色个体受一对显性等位基因控制,而常见的黑壳色个体受另外一对等位基因控制,并且认为壳色主要受基因决定,环境只是起到影响作用;NEWKIRK[13]通过杂交,研究了贻贝壳色的可遗传性,确认贻贝的壳色的确是由简单的遗传基因决定的,这与INNES和HALEV的观点一致,且杂交后代表现出一定的杂种优势。TAKI[14]报道了菲律宾蛤仔(Ruditapes philippinarum)壳面花纹的变异现象及左右壳花纹的不对称性;PEIGNON等[15]通过相同壳色蛤仔的近缘杂交,分析了菲律宾蛤仔壳色的决定机制,并主要研究了壳色、壳面花纹的遗传变异和出现壳色纯合的原理。闫喜武等[16-18]发现,不同壳色蛤仔生长存在显著差异,壳色可以稳定的遗传给后代,并通过“海洋红(ocean red,R)”与“斑马蛤(zebra,Z)”的群体杂交,获得子一代“红斑马(red zebra,RZ)”。菲律宾蛤仔壳型变化很大,壳面颜色和花纹变化各异[19],这为不同壳色蛤仔间的杂交奠定了基础。此试验利用F1代海洋红、斑马蛤为材料,开展了品系间的群体杂交,旨在评价F2代杂种优势,为种质改良,培育壳色新品系及杂种优势利用提供理论依据。
1. 材料与方法
1.1 亲贝的来源
亲贝为2006年10月繁育的苗种,在大连海量水产食品有限公司生态虾池中养成。通过定期检测其性腺发育程度,将处于临产状态的F1代海洋红、斑马蛤各100个作为繁殖群体。
1.2 试验设计
2007年10月初,将临产状态的亲贝阴干12 h,4 h后亲贝开始产卵排精,将正在产卵排精的个体取出,用自来水冲洗干净,单独放到盛有新鲜海水的2.0 L红色塑料桶中继续产卵排精。分别选取海洋红、斑马蛤雌雄各25个,收集的精卵分别单独放置,采用双列杂交法,建立RR和ZZ 2个自交组,RZ和ZR 2个正反交组,共4个试验组(表 1)。受精前检查卵子是否已经受精,已受精个体的卵子弃掉,换取未受精的个体进行杂交,将获得的精卵按照表 1组合受精,在事先处理好的100 L白色塑料桶中迅速混合,搅拌均匀,调整密度10~12 ind · L-1,充气孵化。在水温20.8~21.6℃,盐度为25,pH 7.96的条件下,大约经过25 h,发育至D形幼虫。整个操作过程中,各试验组严格隔离,防止混杂。
表 1 2种壳色品系蛤仔群体杂交的试验设计Table 1 The design of double-hybrids for two shell color strains on clam亲本
parents海洋红
ocean red(R,♂)斑马蛤
zebra(Z,♂)海洋红
ocean red(R,♀)RR RZ 斑马蛤
zebra(Z,♀)ZR ZZ 1.3 幼虫及稚贝的培育
幼虫在100 L的白塑料桶中培育,密度为3~4 ind · mL-1,各试验组分别设3个重复。每2天换1次水,换水量为100%。饵料每天投喂2次,前期为绿色巴夫藻(Pavloca viridis),后期为绿色巴夫藻和小球藻(Chlorella vulgaris) (1 : 1)混合投喂,投饵量视幼虫摄食情况而定。为防止不同试验组幼虫之间混杂,换水网箱单独使用。幼虫培育期间,水温为18.2~20.6℃,盐度为25~28,pH 7.96~8.04。为了消除培育密度的影响,在幼虫期定期对密度进行调整,使每个重复密度保持一致。幼虫变态后,稚贝培育水温为16.4~18.2℃,投饵量随着稚贝摄食量增大而增加,其它管理同幼虫培育。
1.4 杂种优势的计算
参照CRUZ和IBARRA[20]与郑怀平[21]使用的方法,用下面公式计算杂种优势(heterosis,H):
$$ H(\%)=\frac{(\mathrm{RZ}+\mathrm{ZR})-(\mathrm{RR}+\mathrm{ZZ})}{\mathrm{RR}+\mathrm{ZZ}} \times 100 $$ (1) $$ H_{\mathrm{RZ}}(\%)=\frac{\mathrm{RZ}-\mathrm{RR}}{\mathrm{RR}} \times 100 $$ (2) $$ H_{\mathrm{ZR}}(\%)=\frac{\mathrm{ZR}-\mathrm{ZZ}}{\mathrm{ZZ}} \times 100 $$ (3) 式中RR、RZ、ZR和ZZ表示各试验组的F2在同一日龄的表型值(生长、存活)。公式(1)表示双列杂交的杂种优势;公式(2)和(3)分别表示双列杂交中正、反交组的杂种优势。
1.5 数据处理
用SPSS 13.0统计软件对数据进行分析处理,差异显著性设置为P<0.05。
2. 结果
2.1 亲贝形态、壳色表现及产卵量
如表 2所示,海洋红与斑马蛤亲贝的壳长、重量及产卵量差异显著(P<0.05)。壳色表现见图 1、图 2。海洋红经过一代的纯化,背景颜色全部为红色;斑马蛤的壳面花纹均为斑马条纹,且纹路间距一致。
表 2 海洋红与斑马蛤亲贝形态及产卵量Table 2 Shell length, weight and fecundity of ocean red, and zebra strainsMean±SD 类别
items海洋红
ocean red(R)斑马蛤
zebra(Z)壳长/mm
shell length17.12a±0.79 14.76b±1.30 重量/g·ind-1
weight0.85a±0.11 0.55b±0.14 产卵量/×103·ind-1
fecundity45a 36b 注:同行有相同字母表示没有显著性差异(P>0.05)
Notes:The same letters in each line mean no significant difference (P>0.05).2.2 卵径、受精率、孵化率、D形幼虫大小
如表 3所示,2个壳色品系的卵径无显著差异(P>0.05);自交组与杂交组间的受精率近乎100%,无显著差异(P>0.05),但杂交组RZ和ZR的孵化率显著高于相应对照组(P<0.05);D形幼虫大小各试验组间无显著差异(P>0.05)。
表 3 菲律宾蛤仔各试验组卵径、受精率、孵化率、D形幼虫大小比较Table 3 Comparison of egg-diameter, fertilized rate, hatching rate, size of D larvae of each experimental groupsMean±SD 试验组
experiment groups测定指标measuring iterms 卵径/μm
egg-diameter受精率/%
fertilized rate孵化率/%
hatching rateD形幼虫/μm
the size of D larvaeRR 70.23a±0.56 99.96a±0.28 85.67a±5.27 100.15a±1.20 RZ 70.23a±0.56 99.82a±0.32 90.28b±4.65 100.09a±1.11 ZR 70.08a±0.63 99.67a±0.19 92.95b±3.88 100.28a±1.05 ZZ 70.08a±0.63 99.89a±0.25 80.54a±6.15 100.32a±1.94 注:同一列中上标具有相同字母表示差异不显著(P>0.05),下同
Notes:The same letters in each column mean no significant difference (P>0.05), the same below.2.3 浮游期幼虫的生长、存活
各试验组幼虫在3、6、9日龄的平均壳长、生长速度和杂种优势见表 4。浮游期间,幼虫生长尚未表现出明显的生长优势和母本效应。0~3日龄,各试验组幼虫大小无显著差异,杂种优势值为0,6~9日龄,杂交组RZ和ZR的幼虫大小显著大于相应对照组(P<0.05),其生长的杂种优势分别为(1.63±0.81)%和(2.58±0.67)%。RZ和ZR的生长速度分别为(8.64±0.32)和(8.67±0.31)μm · d-1,显著高于对照组,杂种优势分别为5.10%和4.96%。
表 4 浮游期各试验组幼虫的平均壳长、生长速度和杂种优势Table 4 Mean shell length, growth rate and heterosis of larvae for experiment groups during the pelagic periodMean±SD 试验组
experiment groups幼虫日龄/d age of larvae 生长速度/μm·d-1
growth rate3 6 9 平均壳长/μm
average shell
lengthRR 130.17a±2.45 155.67a±4.87 174.00a±3.57 8.22a±0.40 RZ 130.00a±3.22 157.33b±5.68 177.83b±2.84 8.64b±0.32 ZR 130.33a±2.25 158.00b±3.85 178.00b±2.82 8.67b±0.31 ZZ 130.83a±2.65 153.33a±4.22 174.33a±3.88 8.26a±0.43 杂种优势/%
heterosisH 0 1.40 2.15 5.04 HRZ 0 1.06 2.20 5.10 HZR 0 3.05 2.10 4.96 4个试验组幼虫在3、6、9日龄的存活及杂种优势见表 5。将D形幼虫的存活率定义为100%,3~9日龄期间,幼虫的存活率均在60%以上,RZ和ZR存活率显著高于相应的对照组(P<0.05),其杂种优势平均值分别为(10.30±1.92)%和(16.30±1.04)%。
表 5 浮游期各试验组幼虫的存活率和杂种优势Table 5 Survival rate and heterosis of larvae for experiment groups during the pelagic periodMean±SD; % 试验组
experiment groups幼虫日龄/d age of larvae 3 6 9 存活率
survival rateRR 65.52a±3.47 63.50a±4.18 60.35a±2.22 RZ 72.66b±2.27 68.68b±3.92 67.50b±1.57 ZR 80.62b±2.34 72.30b±2.22 70.57b±1.93 ZZ 69.69a±2.86 62.47a±2.74 60.04a±2.34 杂种优势
heterosisH 13.36 11.92 14.69 HRZ 10.90 8.15 11.84 HZR 15.68 15.73 17.50 2.4 室内培育期稚贝的生长与存活
各试验组稚贝的平均壳长、生长速度和杂种优势见表 6。室内培育期间,稚贝表现出明显的生长优势。24~40日龄,RZ和ZR的生长优势平均值分别为(11.25±2.98)%和(20.31±2.10)%;RZ和ZR的生长速度分别为(9.88±1.45)和(10.79±1.32)μm · d-1,其杂种优势为25.86%和30.16%,显著高于对照组(P<0.05)。
表 6 室内培育期各试验组稚贝的平均壳长、生长速度和杂种优势Table 6 Mean shell length, growth rate and heterosis of juvenile for experiment during the indoor periodMean±SD 试验组
experiment groups稚贝日龄/d age of juvenile 生长速度/μm·d-1
growth rate平均壳长/μm
mean shell lengthRR 246.33a±17.12 340.08a±25.23 372.00a±45.14 7.85a±1.41 RZ 266.33b±18.85 379.46b±27.52 424.33b±46.36 9.88b±1.45 ZR 296.00ab±28.84 415.07ab±40.41 468.67ab±42.08 10.79ab±1.32 ZZ 249.33a±12.02 347.23a±26.90 382.00a±46.94 8.29a±2.93 杂种优势/%
heterosisH 13.45 15.60 18.44 28.07 HRZ 8.12 11.58 14.06 25.86 HZR 18.72 19.53 22.69 30.16 各试验组稚贝的存活率和杂种优势见表 7。将刚刚完成变态的稚贝存活率定义为100%,此时的存活优势值为0。24~40日龄,RZT ZR稚贝表现出较高的存活率,约90%左右,显著高于相应对照组(P<0.05);其存活优势平均值分别为(40.85±9.90)%和(57.08±11.98)%,且ZR>RZ。
表 7 室内培育期各试验组稚贝的存活率和杂种优势Table 7 Survival rate and heterosis of juvenile for experiment groups during the indoor periodMean±SD; % 试验组
experiment groups稚贝日龄/d age of juvenile 存活率
survival rateRR 75.55a±4.21 68.48a±3.27 60.44a±3.37 RZ 99.29b±4.45 95.85b±4.87 91.37b±4.40 ZR 90.48b±2.76 90.06b±3.51 89.58b±2.72 ZZ 62.30a±2.52 57.42a±2.82 52.95a±2.15 杂种优势
heterosisH 37.66 47.66 52.95 HRZ 31.42 39.97 51.17 HZR 45.23 56.84 69.18 3. 讨论
3.1 2个壳色品系的遗传差异
杂种优势是一种复杂的生物学现象,亲本间的遗传差异无疑是重要的原因之一,如果2个基础群体的基因频率不同,那么它们之间的杂交有可能表现出杂种优势。当一个种的不同群体能够用来进行人工杂交时,必须评估2个群体间是否有足够的差异[21]。菲律宾蛤仔由于壳色和壳面花纹各异,曾经被分类学家定义为许多不同的种[19]。闫喜武等[16-17]发现,菲律宾蛤仔存在壳色多态现象,在天然群体中,斑马蛤仅占0.20%~0.25%,海洋红占0.4%~0.43%。如此稀少的种群密度却能保存下来,且很少与其它壳色和壳面花纹的蛤仔发生自然杂交,说明它们有很强的抗逆性和生存能力,这种抗逆性和生存能力或许与不同壳色和壳面花纹蛤仔间遗传差异有关。2003~2006年间对不同壳色菲律宾蛤仔品系生长发育研究结果表明,虽然不同壳色的蛤仔的产卵期相同,但是产卵的时间段不同[18],这可能是其自然杂交很难发生的原因;虽然海洋红和斑马蛤有很强的抗逆性和生存能力,但由于在天然群体中所占比例很低,繁殖时相同壳色蛤仔精卵在水中的密度和受精的机会远低于杂色的菲律宾蛤仔,因此,它们在天然群体中所占比例也不会增大。海洋红与斑马蛤在生长、存活2个性状上存在差异,从生长上看,海洋红>对照组(杂色的菲律宾蛤仔)>斑马蛤,尤其到成体阶段,彼此间个体大小差异极显著;从存活情况上划分,斑马蛤>对照组>海洋红,且彼此间差异显著,这与对天然群体中菲律宾蛤仔调查结果一致。说明海洋红与斑马蛤仔2品系间存在遗传差异,这奠定了壳色间群体杂交的基础。在试验条件相同的情况下,可以排除环境对性状的影响,不同壳色品系间的差异主要来自于遗传差异[22]。
3.2 群体杂交对子二代的影响
2个或2个以上不同遗传类型的物种、品种、品系或自交系杂交产生的子一代,在生长、生活力、抗病力、产量和质量超过双亲的现象,称为杂种优势[22]。从试验结果上看,杂交使得各杂交组个体在生长、存活表现出不同程度的杂种优势。就生长而言,杂种优势的平均水平在不同阶段表现不同,随着个体发育,生长这一性状在不同壳色之间差异越来越明显,生长优势不断增大,幼虫期(1.78±0.53)%<稚贝期(15.83±2.50)%,这与闫喜武等[16-18]对不同壳色蛤仔生长发育的研究结果一致。对于杂交是否会提高受精率、孵化率,大多学者没有报道,可能是受精率和孵化率的高低不仅反映精、卵质量,也反映精、卵之间的亲和力。精、卵不熟或过熟都会影响受精率和孵化率及以后的发育[23]。由于杂交时精、卵亲和性不同,卵的受精率和孵化率一般不会表现出杂种优势,此试验结果显示,卵的受精率没有表现出杂种优势,但孵化率表现出一定的杂种优势,其原因尚有待进一步探讨。就存活而言,在幼虫期和室内培育期表现出明显的杂种优势,且幼虫期(13.32±1.39)%<稚贝期(46.09±7.76)%。综合生长、存活的杂种优势,正反杂交组的杂种优势大小顺次为ZR>RZ。由于不同壳色蛤仔间存在着一定的遗传差异,这些结果与FALCONER和MACKAY[24]提出的“如果2个基础群体的基因频率不同,那么它们之间的杂交将表现出杂种优势”、“不同群体配对表现出不同的杂种优势大小”等观点相吻合。通过建立正反杂交组合,从中筛选出有效的杂交组,为改良贝类的种质,充分利用杂种优势奠定了基础。
-
表 1 定性离子对、定量离子对碰撞能量
Table 1 Collision energy of qualitative and quantitive ion pairs
表 2 不同提取剂对泰乐菌素的提取效率的比较
Table 2 Comparison of Tylosin extraction efficiency using different extractants
提取剂
extratant样品
sample回收率/%
recovery平均回收率/%
average recovery甲醇 methyl alcohol 对虾 74.2/72.4/72.7 73.1 鲫 72.3/69.6/68.4 70.1 草鱼 79.6/76.2/79.1 78.3 乙腈 acetonitrile 对虾 75.2/70.3/71.7 72.4 鲫 72.2/69.3/69.4 70.3 草鱼 78.7/76.8/82.7 79.4 1%酸化乙腈 1% acidified acetonitrile 对虾 82.1/80.8/83.1 82.0 鲫 80.4/82.1/78.7 82.4 草鱼 80.2/80.4/83.0 81.2 表 3 不同洗脱剂条件下泰乐菌素的回收率
Table 3 Recovery of methaqualone under different elute solutions
% 样品
sampleV(乙腈)/mL acetonitrile volume 0 5 10 20 草鱼 C.idellus 81.3 90.0 91.7 90.2 鲫 C.auratus 79.1 91.8 90.5 92.3 表 4 定性离子对、定量离子对及碰撞能量
Table 4 Collision energy of qualitative and quantitive ion pairs
化合物
compound母离子/m/z
parent ion子离子/m/z
daughter ion碰撞能量/eV
collision energy泰乐菌素 Tylosin 916.875 145.100 173.848* 50 罗红霉素 Roxithromycin 837.594 679.314 42 表 5 泰乐菌素的加标回收验证结果
Table 5 Results of Tylosin spiked sample
序号
No.添加量/μg·kg-1
added amount加标样品
sample测得值/μg·kg-1
measured value回收率/%
recovery平均回收率/%
average recovery相对标准偏差/%
RSD1 10.0 鲫 8.84/9.00/8.93 /8.99/8.84 88.45/90.50/89.30 /89.90/88.45 89.23 0.86 2 对虾 9.34/9.64/9.75 /9.26/9.09 93.35/96.40/97.50 92.60/90.90 94.15 2.90 3 草鱼 10.01/9.26/9.66 /9.02/9.10 100.15/92.60/96.55/90.15/90.95 94.08 4.46 4 5.0 鲫 4.12/4.46/4.43 /4.20/4.51 82.40/89.20/88.60 /83.90/90.20 86.86 4.00 5 对虾 4.96/4.38/5.04 /4.56/4.86 99.20/87.60/100.70/91.30/97.10 95.18 5.82 6 草鱼 4.33/4.28/4.44 /4.36/4.42 86.60/85.60/88.80 /87.20/88.30 87.30 1.48 7 1.0 鲫 0.98/0.91/0.96 /0.91/0.96 98.50/90.75/96.25 /91.00/96.25 94.55 3.68 8 对虾 0.96/0.97/0.92 /0.97/0.88 96.00/97.00/92.25 /97.25/87.50 94.00 4.41 9 草鱼 0.97/1.00/0.94 /0.90/0.88 97.00/100.00/94.50/89.75/88.25 93.90 5.23 -
[1] 张眉. 高效液相色谱仪检测饲料中泰乐菌素方法的研究[D]. 杨凌: 西北农林科技大学, 2008. https://d.wanfangdata.com.cn/thesis/Y1284465 [2] 中国兽药典委员会. 中华人民共和国兽药典第一部[M]. 北京: 化学工业出版社, 2000: 11. http://www.1mpi.com/doc/cb62c8d359a4998ec67e0858/2 [3] 王秀珍, 刘国印. 北里霉素防治草鱼"三病"试验[J]. 淡水渔业, 1994, 24(6): 18-19. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq58CWXG7pT_Jic6TcWVMjmRB-snb21ReuOFuu9OEnpgjTUBV-5T3-kkrujtmssexz8RX_HHYwdxIZyw-N6118xJYCWMnlMEuoTCX7bNN2NSXU0bBaeHv-_-W6G_xyRZ448-ocwjCRUy-JyyduTlp5rb&uniplatform=NZKPT [4] 张建军, 任惠丽, 阎军, 等. 泰乐菌素饲料添加剂对鱼类促长的研究[J]. 西北大学学报, 2002, 32(5): 576-578. doi: 10.3321/j.issn:1000-274X.2002.05.038 [5] HORIE M, TAKEGAMI H, TOYA K, et al. Determination of macrolide antibiotics in meat and fish by liquid chromatography electrospray mass spectrometry[J]. Analytica Chimica Acta, 2003, 492(1/2): 187-197. doi: 10.1016/S0003-2670(03)00891-2
[6] 杨方, 李耀平, 方宇, 等. 高效液相色谱法同时检测水产品中螺旋霉素与泰乐菌素药物残留[J]. 理化检验: 化学分册, 2007, 43(4): 272-274. doi: 10.3321/j.issn:1001-4020.2007.04.007 [7] 中华人民共和国农业部. NY 5071-2002中华人民共和国农业行业标准《无公害食品渔用药物使用准则》[S]. 北京: 中国标准出版社, 2002. https://faolex.fao.org/docs/pdf/chn178988.pdf [8] 赵红梅, 马玉龙, 谢丽, 等. 高效液相色谱法检测泰乐菌素残留[J]. 化学与生物工程, 2010, 27(5): 86-88. doi: 10.3969/j.issn.1672-5425.2010.05.025 [9] JUHEL-GAUGAIN M, ANGER B, LAURENTIE M. Multiresidue chromatographic method for the determination of macrolide residues in muscle by high-performance liquid chromatography with UV detection[J]. J AOAC Int, 1999, 82(5): 1046-1053. doi: 10.1093/jaoac/82.5.1046
[10] 刘素英, 赵东豪. HPLC-ECD对尿中10种大环内酯类抗生素的多残留检测[J]. 中国动物检疫, 2006, 23(12): 28-30. https://xueshu.baidu.com/usercenter/paper/show?paperid=13430m704k2w0mp0h65j04c02v684849&site=xueshu_se&hitarticle=1 [11] 谢丽琪, 岳振峰, 唐少冰, 等. 高效液相色谱串联质谱法测定牛奶中林可酰胺类和大环内酯类抗生素残留量的研究[J]. 分析试验室, 2008, 27(3): 5-8. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq7tIlqUafGiojyU9ESl5pAdx_uUhlxI_7ogIqdJ1oxhbBdiJvxg2DMfQRyyoipzRs7UZCPlgFGT6LzyWqpRGnN0uFpYjUh1-O-XWEMixVOuQI1hCle1Yi5HZqpVp_L6UsMpeppSMjY-BBWJ_kG1kCXrOXGrT0kJA9Uf35BpW6S5ceUVz3cNh-9l&uniplatform=NZKPT&language=CHS [12] 谢文, 丁慧瑛, 奚君阳, 等. 蜂王浆产品中5种大环内酯类抗生素残留量的高效液相色谱-质谱/质谱检测方法[J]. 色谱, 2007, 25(3): 404-407. doi: 10.3321/j.issn:1000-8713.2007.03.026 [13] 刘晔, 王洪新, 戴军, 等. 固相萃取-高效液相色谱法测定猪肝中的大环内酯类抗生素[J]. 食品与发酵工业, 2008, 34(5): 162-165. [14] 王凤美, 陈军辉, 林黎明, 等. UPLC-MS/MS法对动物源性食品中12种大环内酯类抗生素残留的测定[J]. 分析测试学报, 2009, 28(7): 784-788. doi: 10.3969/j.issn.1004-4957.2009.07.006 [15] 赵东豪, 贺利民, 聂建荣, 等. HPLC-MS/MS检测猪肉中六种大环内酯类抗生素[J]. 分析试验室, 2009, 28(1): 117-119. doi: 10.3969/j.issn.1000-0720.2009.01.030 [16] 孙雷, 张骊, 王树槐, 等. 超高效液相色谱-串联质谱法对动物源食品中13种林可胺类及大环内酯类药物残留的检测[J]. 分析测试学报, 2009, 28(9): 1058-1061. doi: 10.3969/j.issn.1004-4957.2009.09.015 [17] 王敏, 林维宣, 郭德华, 等. 高效液相色谱-串联质谱法同时检测动物性食品中多种大环内酯类药物[J]. 分析测试学报, 2007, 26(5): 675-678. doi: 10.3969/j.issn.1004-4957.2007.05.018 [18] 李岩. 液相色谱-电喷雾质谱法测定动物源食品中残留大环内酯类抗生素[D]. 大连: 大连交通大学, 2006. https://xueshu.baidu.com/usercenter/paper/show?paperid=6695c6addb51b6e038ce5491ed67b84d&site=xueshu_se&hitarticle=1 [19] 张骏豪, 谭艾娟, 吕世明, 等. HPLC法同时检测猪肉中泰乐菌素和泰妙菌素[J]. 山地农业生物学报, 2011 (1): 91-94. [20] 刘永涛, 艾晓辉, 邹世平, 等. 水产品中螺旋霉素、替米考星、泰乐菌素与北里霉素残留量的超高效液相色谱-紫外检测法同时测定[J]. 分析测试学报, 2010, 29(3): 108-112. doi: 10.3969/j.issn.1004-4957.2010.03.023 [21] 任惠丽, 杨元昊, 田强兵, 等. 高效液相色谱法测定水产品中泰乐菌素残留量[J]. 中国卫生检验杂志, 2011 (10): 21-22, 26. [22] 崔阳, 王冰, 徐刚, 等. 超高效液相色谱-串联质谱法检测猪血清中泰乐菌素残留的建立[J]. 东北农业大学学报, 2011, 42(9): 131-136. doi: 10.3969/j.issn.1005-9369.2011.09.025 [23] LEE J B, CHUNG H H, CHUNG Y H, et al. Development of an analytical protocol for detecting antibiotic residues in various foods[J]. Food Chem, 2007, 105(4): 1726-1731. doi: 10.1016/j.foodchem.2007.05.030
[24] NAGATA T, ASHIZAWA E, HASHIMOTO H. Simultaneous determination of residual fourteen kinds of beta-lactam and macrolide antibiotics in bovinemuscles by high-performance liquid chromatography with a diode array detector[J]. J Food Hyg Soc Jpn, 2004, 45(3): 161-164.
[25] HORIE M, SAITO K, ISHII R, et al. Simultaneous determination of five macrolide antibiotics in meat by high-performance liquid chromatography[J]. J Chromatogr A, 1998, 812(1): 295-302. doi: 10.1016/S0021-9673(98)00004-1
[26] GARCIA-MAYOR M A, GARCINUNO R M, FERNANDEZ-HEMANDO P. Liquid chromato-graphy-UV diodearray detection method for multi-residue determination of macrolide antibiotics in sheep's milk[J]. J Chromatogr A, 2006, 1122(1/2): 76-83. doi: 10.1016/j.chroma.2006.04.019
[27] DRAISCI R, PALLESCHI L, FERRETTI E, et al. Confirmatory method for macrolide residues in bovine tissues by micro-liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2001, 926(1): 97-104. doi: 10.1016/S0021-9673(01)00838-X
-
期刊类型引用(8)
1. 欧利国,蓝振峰,刘必林,陈新军,陈勇. 基于计算机视觉的鱼类形态轮廓特征自动提取. 水产学报. 2024(12): 63-73 .  百度学术
百度学术
2. 李伟畅,朱国平,王雪辉,林龙山,李渊,杜飞雁. 南海中南部金带细鲹与长体圆鲹矢耳石外型比较分析. 生物学杂志. 2023(05): 54-60 .  百度学术
百度学术
3. 庄文鑫,吴荔生,刘巧红,柳淑芳,丁少雄. 基于地标点法的3种眶灯鱼耳石形态种间差异性. 海洋学报. 2023(09): 119-127 .  百度学术
百度学术
4. 欧利国,顾心雨,王冰妍,刘必林. 6种大型海洋掠食性鱼类胃含物角质颚分类研究. 渔业科学进展. 2022(04): 105-115 .  百度学术
百度学术
5. 欧利国,力清影,刘必林. 中国南海东沙群岛海域7种鲹科鱼类矢耳石形态特征. 上海海洋大学学报. 2021(01): 155-162 .  百度学术
百度学术
6. 刘梦娜,王雪辉,刘玉,邱永松,何映霖,贝伟烈,朱江峰,杜飞雁. 汕头—台湾浅滩渔场中国枪乌贼形态学初步分析. 应用海洋学学报. 2021(02): 208-219 .  百度学术
百度学术
7. 欧利国,王冰妍,刘必林,陈新军,陈勇,吴峰,刘攀. 基于计算机视觉的3种金枪鱼属鱼类形态指标自动测量研究. 海洋学报. 2021(11): 105-115 .  百度学术
百度学术
8. 欧利国,刘必林. 基于地标点法的4种鲹科鱼类矢耳石形态分类. 大连海洋大学学报. 2020(01): 114-120 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
