Determination of five arsenic species in seafood using high performance liquid chromatography (HPLC) coupled with inductively coupled plasma mass spectrometry (ICP-MS)
-
摘要:
建立了海产品中5种形态砷(As)的高效液相色谱-电感耦合等离子体质谱联用测定方法。将样品冷冻干燥后采用V(甲醇)∶V(水)=3∶1溶液,70 ℃水浴振摇30 min提取1次,再用V(甲醇)∶V(水)=1∶1溶液提取2次,提取液用阴离子交换柱分离,以20 mmol·L-1碳酸铵[碳酸氢铵(NH4HCO3)+氨基甲酸铵(NH2COONH4)]为流动相,用电感耦合等离子体质谱检测。5种As的检出限为0.057~0.13 μg·L-1,定量限为0.19~0.43 μg·kg-1。添加回收率为83.2%~115%,相对标准偏差小于10%。实际海产品样品测定结果表明,海产品中的As主要以砷甜菜碱和二甲基砷酸为主,5种形态As的和与总As相比,总体提取率达90%以上。
-
关键词:
- 海产品 /
- 砷形态 /
- 高效液相色谱 /
- 电感耦合等离子体质谱 /
- 测定
Abstract:A method was established to determine five arsenic species in seafood using high performance liquid chromatography coupled with inductively coupled plasma mass spectrometry (HPLC-ICP-MS).Freeze dried samples were extracted with methanol-water (3∶1) shaking in 70 ℃ water bath for the first time, and extracted with methanol-water(1∶1) for the second and third time.Then we separated the extract by anion exchange column using 20 mmol·L-1 NH4HCO3+NH2COONH4 mobile phase, and detected the compounds with plasma mass spectrometry.The detection limit and quantification limit of five arsenic speciations in seafood varied from 0.057~0.13 μg·L-1and from 0.19~0.43 μg·kg-1.The average recovery of five species arsenic spiked in tested samples at 3 levels ranged from 83.2%~115% with the relative standard deviation (RSD) between 2.15% and 9.97%.The proposed method had been applied to the analysis of seafood came from Australia, indicating that arsenobetaine (AsB) and dimethylarsinic acid (DMA) were main species of arsenic in seafood, and the extraction efficiency of five arsenic speciations were more than 90%, which was higher than of total arsenic.
-
广谱抗生素氟甲砜霉素属于第二代氯霉素类动物专用药物,是甲砜霉素的氟化衍生物。氟甲砜霉素不仅体外抗菌活性良好,抑菌效果非常显著,而且使用安全,不会引起人类的再生障碍性贫血。因此,目前氟甲砜霉素已广泛应用于水产养殖业。
在氟甲砜霉素残留检测方面,Nagata等[1]报道了动物肌肉和养殖鱼类肌肉中的氟甲砜霉素残留的HPLC法。虽然该方法灵敏度高,但是耗时多,处理样品过程中化学试剂用量大。Hormazabal等[2]报道了虹鳟组织内氟甲砜霉素的HPLC法,方法亦相当繁琐。在血浆中的药物残留分析方面,Martinsen等[3]报道了大西洋鲑鱼血浆内氟甲砜霉素的液相色谱测定方法。方法耗时,繁琐,进样量为500 μL。van de Riet等[4]应用液相色谱-质谱联用方法对多种鱼类中的氯霉素类药物进行多残留分析,可用于多种水产动物中氯霉素、甲砜霉素、氟甲砜霉素及氟甲砜霉素胺的检测。除HPLC法外,Lavy等[5]曾采用微生物法检测了山羊乳汁和血清中的氟甲砜霉素。
根据前人研究并结合本实验室条件,本研究旨在建立一种准确简便而经济的分析方法,以测定罗非鱼血浆、肌肉和肝脏内氟甲砜霉素残留,以便为水生动物药物动力学和残留研究提供分析手段,进一步为水产养殖合理用药提供依据,并确保水产品食用安全。
1. 材料与方法
1.1 实验动物
健康奥尼罗非鱼(Oreochromis niloticus×O.aureus)由广东省罗非鱼良种场提供,平均体重125 g。实验前,在实验室驯养1周。实验水温27℃,所用玻璃水族箱为50 cm×30 cm×30 cm(45 L)。
1.2 药品、试剂及配制方法
氟甲砜霉素标准品,Sigma公司;氯霉素标准品,99.6%,中国生物制品检定所;乙腈,色谱纯,Dikma公司;乙酸乙脂,分析纯;正己烷,分析纯;磷酸氢二钠(Na2HPO4·12H2O),磷酸二氢钠(NaH2PO4·2H2O),为分析纯;氟甲砜霉素水溶性粉,华南农业大学实验兽药厂提供。
标准液配制方法: 准确称取0.050 g干燥恒重的氟甲砜霉素标准品,置于50 mL烧杯中,用适量乙醇溶解后,转移到50 mL容量瓶中,用流动相乙腈-水(27:73,v/v)稀释至刻度,即成1 000 μg·mL-1母液,-20℃避光保存备用。准确称取0.050 g氯霉素标准品,于100 mL烧杯中用流动相溶解,转移到100 mL容量瓶中,配制成500 μg·mL-1溶液,-20℃保存。
磷酸盐缓冲液(pH 7.0)配制: 准确称取磷酸氢二钠(Na2HPO4·12H2O)71.64 g和磷酸二氢钠(NaH2PO4·2H2O)27.6 g,分别溶于1 L蒸馏水中配成0.2 mol·L-1的溶液,然后按61:39的比例混合即成。
1.3 药饵配制及给药方法
首先将水溶性粉用蒸馏水溶解,搅拌均匀,配制成5 mg·mL-1的水溶性粉悬浊液。将1 mL注射器输出端切除,抛光,装入0.2~0.3 g空白颗粒饲料(Φ3 mm),然后用定量加液器将配制好的水溶性粉悬浊液加入注射器,每g鱼体重2 μL,相当于剂量10 mg·kg-1鱼体重,使药液充分浸入饲料。小心地将注射器插入食道推动活塞强制灌胃给药,注意观察注射器插入食道的长度,以免将鱼胃捅破。给药后将鱼单独放入一个水盆中观察5 min,将反胃回吐药饵的鱼弃去。
1.4 样品的采集与制备
每尾鱼用2.5 mL静脉注射器(肝素钠抗凝剂处理),尾静脉采血,以3 000 r·min-1离心10 min,分离血浆。将鱼处死,取肝和肌肉(背脊两侧肌肉)。将同一类组织的各样品合并,-20℃保存至分析。
1.5 仪器及色谱条件
日本日立LC-6200高效液相色谱仪,包括紫外检测器,智能泵,反应泵,微处理机,积分仪等;KL512型氮吹仪(配备数控恒温水浴装置);活动砂心过滤装置(包括0.45 μm微孔滤膜);FJ-200高速分散均质机;QL-901涡旋混合器;-20℃低温冰箱;TGL-16 C离心机,74B-4000型电动离心沉淀器;往返振荡器等。
流动相乙腈-水(27:73,v/v),经0.45 μm滤膜过滤后,置于棕色试剂瓶中,超声波脱气10 min,备用;流速1.0 mL·min-1;Waters SpherisorbⓇ ODS2色谱柱(4.6×150 mm,粒度5 μm),柱温25℃;紫外检测波长223 nm。
1.6 样品处理
1.6.1 血浆样品处理方法
精确量取1 mL血浆样品于25 mL试管(具塞)中,加入10 μL氯霉素(500 μg·mL-1)作为内标和1 mL的磷酸缓冲液(pH 7.0),用旋涡混合器涡动混匀1 min。然后加入4 mL乙酸乙酯,用摇床水平机械振荡20 min,静置10 min后吸取上层乙酸乙酯于10 mL离心管中。加入4 mL乙酸乙酯,同样方法重复提取一次,合并乙酸乙酯提取液。60℃水浴氮气蒸干,加入1 mL流动相,再加入0.5 mL正己烷,涡动2 min溶解残留物。16 000 r·min-1离心20 min,弃去正己烷层,过滤,20 μL进样检测。
1.6.2 组织样品处理方法
称取1 g组织(肌、肝预先剪碎)于20 mL玻璃管中,加入10 μL氯霉素(500 μg·mL-1),加入1 mL的磷酸缓冲液(pH 7.0),加入4 mL乙酸乙酯,16 000 r·min-1匀浆10 s,转入10 mL离心管中,于旋涡振荡器上振荡1 min,4 000 r·min-1离心20 min,吸取全部上清液于10 mL具塞离心管中;再用4 mL乙酸乙酯于20 mL玻璃离心管中清洗残留,提取液转移转入10 mL离心管中,再震荡离心合并上清液;其余同“血浆样品处理方法”。
1.7 标准曲线制备
配制系列标准液(含5 μg·mL-1的氯霉素),浓度为16~0.03 μg·mL-1(n=8)。进样量20 μL,依色谱条件,HPLC测定,以氟甲砜霉素的峰高与氯霉素内标的峰高之比值H,对相应的氟甲砜霉素浓度Ci作线性回归,求标准曲线回归方程以及回归系数。
1.8 工作曲线制备
准确量取1 mL血浆或称取1 g组织(肌、肝)于10 mL玻璃管中,加入浓度为800~1.56 μg·mL-1的标准液系列(n=8),使样品中的药物浓度为16~0.03 μ·mL-1,其余同“样品处理”。进样量20 μL,HPLC测定,以氟甲砜霉素的峰高与氯霉素内标的峰高之比值H,对相应的氟甲砜霉素浓度Ci作线性回归,求工作曲线回归方程以及回归系数。
1.9 回收率
求绝对回收率,按下式计算:
绝对回收率=预处理后的加标样品药物峰高/溶于流动相的药物峰高100%。
准确量取1 mL血浆或称取1g组织(肌、肝),分别加入浓度为6.25, 50和400 μg·mL-1的氟甲砜霉素标准液20 μL,其浓度分别为0.125,1和8 μg·mL-1,其余同“样品处理”。HPLC测定氟甲砜霉素浓度,每个浓度平行测定5次,同批测定0.125、1和8 μg·mL-1标准液中的药物峰高,计算绝对回收率。
1.10 精密度
准确量取1 mL血浆或称取1 g组织(肌、肝),分别加入浓度为6.25、50和400 μg·mL-1的氟甲砜霉素标准液20 μL(见表 1),其浓度分别为0.125,1和8 μg·mL-1,其余同“样品处理”。同一批内平行测定5次,记录氟甲砜霉素和氯霉素峰高,计算峰高比值及批内精密度即各变异系数(RSD)。批间精密度: 测定2个批次,各浓度样品平行测定3次,计算批间精密度(RSD)。
表 1 血浆、肌肉和肝脏样品工作曲线Table 1. The calibration curves for florfenicol in plasma, muscle and liver samples样品
sample线性范围/μg·mL-1
concentration range标准曲线回归方程
calibration equation相关系数
R血浆 plasma 0.03~16 C血=2.729 H-0.06 0.9998 肌肉 muscle 0.03~16 C肌=2.939 H-0.1121 0.9995 肝脏 liver 0.03~16 C肝=2.8336 H-0.1326 0.9986 1.11 药物稳定性
将浓度分别为8和1 μg·mL-1的工作标准液保存在0~5℃冰箱中,在48 d内对其进行4次测定。0.125 μg·mL-1的标准液在2 d内2次测定。
将添加浓度为1 μg·mL-1的罗非鱼血浆、肌肉和肝脏样品提取液放置在实验台上,分别于第2天和第11天测定。记录峰高值,计算实测浓度,比较药物的浓度变化情况。
2. 结果
2.1 氟甲砜霉素的色谱行为
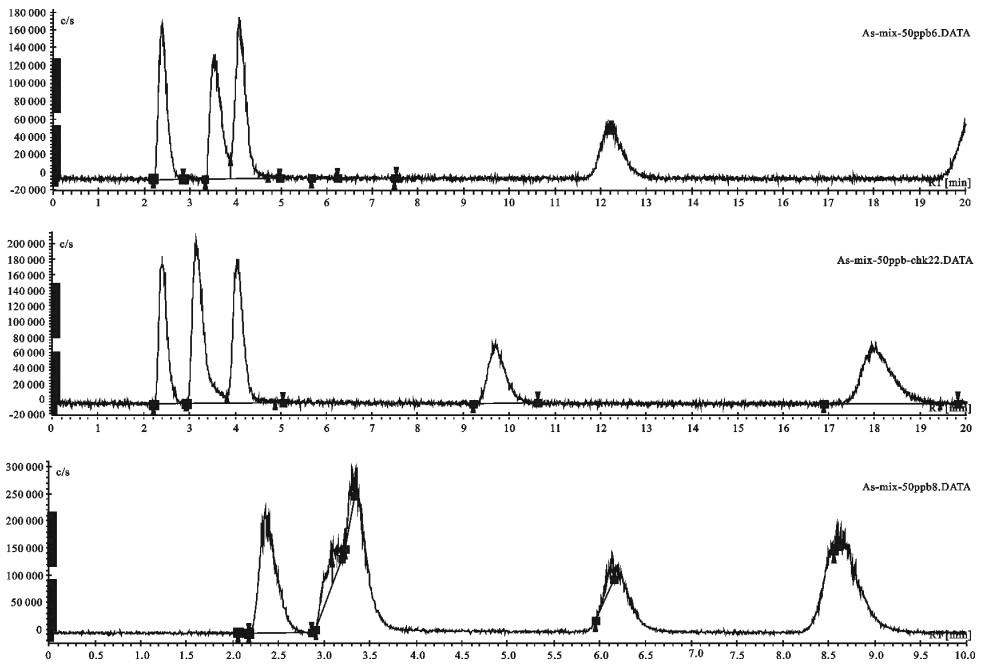
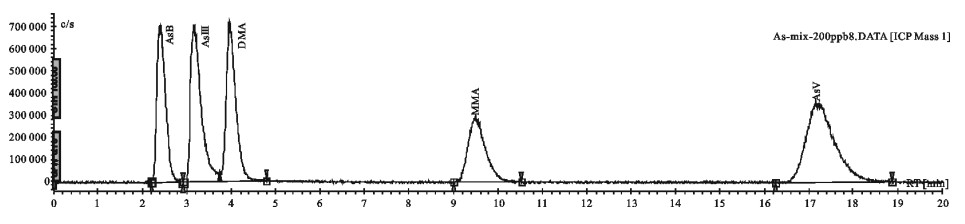
在上述色谱条件下,基线走动平稳,血浆、肌肉和肝脏样品中虽有杂质峰出现,但无干扰峰,并且与药物分离良好(见图 1)。
2.2 标准曲线和灵敏度
基线峰高(噪音)最大值为0.0193 mAU,按信噪比(S/N)为2计算,得出仪器检出限为0.0146 μg·mL-1。标准曲线为Ci=2.797H-0.0339,相关系数R=0.9999,线性范围为0.03~16 μg·mL-1。根据线性范围,确定本方法的检出限为0.03 μg·mL-1。
2.3 样品工作曲线(药物HPLC定量标准曲线)
各样品工作曲线测定结果见表 1,线性范围为0.03~16 μg·mL-1,相关系数范围为0.9986~0.9998,线性关系满足分析要求。
2.4 回收率
各样品在3个浓度水平的平均回收率结果见表 2,其中血浆的平均回收率为92.86%~96.13%,肌肉的平均回收率为91.70%~96.09%,肝脏的的平均回收率为89.16%~89.52%,结果能够满足分析要求。
表 2 不同组织样品在3个浓度水平的平均回收率(平均值±标准差%)Table 2. The recovery of florfenicol in the plasma, muscle and liver samples of tilapia浓度/μg·mL-1
concentration血浆
plasma肌肉
muscle肝脏
liver0.125 94.79±2.81 91.70±5.41 89.52±4.32 1 96.13±2.35 96.09±1.91 89.17±3.97 8 92.86±1.22 92.72±2.59 89.16±3.71 2.5 精密度
各样品在3个浓度水平的批内精密度和批间结果分别见表 3和表 4,批内和批间精密度最大均不超过7.7%,符合分析要求。
表 3 不同组织样品中药物在3个浓度水平的批内精密度(RSD%)Table 3. The intra-batch precision of a liquid chromatographic method to determine florfenicol in the plasma, muscle and liver samples of tilapia浓度/μg·mL-1
concentration血浆
plasma肌肉
muscle肝脏
liver0.125 3.75 6.45 5.61 1 2.21 3.07 6.55 8 2.37 2.65 4.71 表 4 不同组织样品中药物在3个浓度水平的批间精密度(RSD %)Table 4. The inter-batch precision of florfenicol in the plasma, muscle and liver samples of tilapia浓度/μg·mL-1
concentration血浆
plasma肌肉
muscle肝脏
liver0.125 6.27 6.26 2.92 1 2.11 4.39 7.71 8 2.39 4.46 3.72 2.6 药品稳定性
对于标准液,在评价期内,以第1天测定结果为标准,其他各次测定结果与之相比较,计算出药物的浓度变化,结果在0.5%~1.9%之间。对于血浆、肌肉和肝脏样品,药物浓度的变化率分别为1.4%、0.8%和5.8%。
表 5 工作标准液中氟甲砜霉素的稳定性Table 5. Stability of florfenicol in the working standard solutions(0~5℃)浓度/μg·mL-1
concentration变化率/% change percent 第2天 第46天 第48天 8 1.3 1.2 1.2 1 1.0 1.9 0.5 0.125 1.5 表 6 罗非鱼样品中氟甲砜霉素的稳定性Table 6. Stability of florfenicol in the plasma, muscle and liver samples fortified at nominal concentrations of 1 μg·mL-1 florfenicol样品
sample浓度/μg·mL-1 concentration 变化率/%
change percent第2天 第11天 血浆 1.006 1.020 1.4 肌肉 1.049 1.107 5.8 肝脏 1.056 1.064 0.8 3. 讨论
水产动物体内药物含量的分析测定方法有微生物测定法、气相色谱法(GC)、高效液相色谱法(HPLC)、酶联免疫法、薄层色谱法、分光光度法、比色法和同位素法等。目前,HPLC法应用最多。如Tyrpenou等[6],Meinertz等[7]和Samuelsen等[8]学者分别在研究盐酸沙拉沙星,OTC和Romet30在金头鲷、银大麻哈鱼和大西洋鲑体内的分布和消除规律或药物动力学时,均采用了HPLC法。
本研究建立的HPLC法具有进样量(20μL)少,所需样品量(1g)少,试剂消耗少和样品预处理简便的特点,结果是满意的。
(1) 内标法定量准确。在HPLC法分析过程中,由于样品和内标是混合在一起注入色谱柱的,因此只要混合溶液中被测组分与内标的量的比值恒定,进样量的变化不会影响定量结果。用外标法虽然操作简便,但是要求满足的条件较高,要求进样量(每次应一致)准确及实验条件恒定。而内标法抵消了上样体积,乃至流动相、检测器等条件的影响,因此比外标法精确。
(2) 方法灵敏度较高,相关系数较高,线性范围较宽。本方法的检出限为0.03 μg·mL-1。标准曲线相关系数R为0.9999,各样品工作曲线相关系数在0.9986~0.9998之间,线性范围均为0.03~16 μg·mL-1。标准曲线以及各样品工作曲线相关系数较高。线性范围较宽,其高低浓度相差达2个数量级,表明该方法具有较宽的测定范围。
色谱法一般要求相关系数大于0.99,药物动力学实验方法要求线性范围为10-2。本方法标准曲线和各样品工作曲线的相关系数在0.9986~0.9999之间,线性范围为0.03~16 μg·mL-1,完全满足分析要求。
(3) 方法回收率高。Vue等[12]对多种淡水鱼血浆研究发现,药物的回收率为84%~104%。在鸡、猪、牛和五条鰤鱼肌肉中,氟甲砜霉素的回收率为74.5%~81.5%[1]。Hormazabol等[2]的结果为,肌肉和肝脏药物的回收率分别为99%~105%和100%~107%。van de Riet等[4]应用液相色谱-质谱连用多残留检测多种鱼类中的氯霉素类残留,鲑组织中氟甲砜霉素胺与氟甲砜霉素回收率分别为71%和107%。
本实验各样品在3个浓度水平的平均回收率为(89.16±3.71)%~(96.13±2.35)%,说明方法准确度良好。与血浆和肌肉相比,肝脏中的回收率相对稍低,原因在于作为代谢器官,肝脏中的成分比较复杂,药物的回收率受杂质峰的影响比较大。这与王群等[9]的报道结果一致。
(4) 精密度良好。Vue等[12]多种淡水鱼血浆氟甲砜霉素精密度1.4%~8.1%。鸡血浆氟甲砜霉素含量为0.125、1和8 μg·mL-1,日内变异系数分别为5.1%、2.1%和3.5%;日间变异系数分别为6.2%、4.1%和3.4%[10]。鲤血浆中诺氟沙星的绝对回收率85.96%,日内和日间精密度均小于10%[11]。
药物动力学实验要求精密度在10%以内(检测限为μg·mL-1水平时)。本实验的批内和批间精密度均在8%以下,为2.11%~7.71%,说明方法可靠性较高,完全满足分析要求。
(5) 药物稳定性良好。在一定的保存时间内,对配制好的标准液进行测定,其结果变化不大。在本次实验期内,药物在标准液中浓度变化范围为0.5%~1.9%。Vue等[1]报道,14 d内,工作标准液(浓度为0.1、1和10 μg·mL-1)中药物的浓度变化不大于1.9%。与本研究结果一致。
本实验罗非鱼血浆、背肌和肝脏样品中药物浓度在10 d后均稍有升高,其范围在0.8%~5.8%之间。Vue等[1]在研究中发现,7 d内,添加浓度为1 μg·mL-1的血浆样品药物的回收率升高幅度小于8%,其原因是样品存放时间长,血浆内的(一些)未知化合物会发生分解,产生杂峰干扰。并且指出,利用HPLC法分析血浆样品,最好在提取后12 h以内进样分析。结果与本实验一致。
致谢: 澳大利亚SYMBIO ALLIANCE实验室提供试验所需的仪器设备、场所及样品,谨此致谢! -
表 1 电感耦合等离子体质谱工作参数
Table 1 Instrumental conditions and data acquisition parameters of ICP-MS
参数
parameters设置
settings等离子体气流量/L·min-1 plasma flow 17.0 辅助气流量/L·min-1 auxiliary flow 1.70 雾化气流量/L·min-1 nebulizer flow 0.92 稀释气流量/L·min-1 sheath flow 0.27 RF功率/kW F power 1.40 采样深度/mm sampling depth 5 蠕动泵转速/r·min-1 pump rate 15 喷雾室温度/℃ spray chamber temperature 3 单次测量时间/ms dwell time 350 总测量时间/s total measuring time 1 200 扫描方式 scan mode 跳峰扫描 检测质量数/m/z testing amount 75(As) 表 2 4种提取方法的提取率(干质量)
Table 2 Recoveries of five arsenic speciations in seafood using different extraction methods (dry weight)
样品类型
sample提取方法
extraction methods砷甜菜碱/μg·kg-1
AsB亚砷酸盐/μg·kg-1
As(ⅠⅡ)二甲基砷酸/μg·kg-1
DMA一甲基砷酸/μg·kg-1
MMA砷酸盐/μg·kg-1
As(Ⅴ)合计/μg·kg-1
sum总提取率/%
total recovery海苔 seaweed 水浴摇床30 min 268.6 0 276.9 0 0 545.5 98.1 Hot block 30 min 252.1 0 252.3 0 0 504.4 90.7 震荡30 min 122.2 0 257.6 0 0 379.7 68.3 振摇2 min 125.2 0 242.4 0 0 367.6 66.1 剑鱼 swordfish 水浴摇床30 min 801.9 196.6 0 31.6 0 1 030.1 96.4 Hot block 30 min 790.3 198.6 0 32.0 0 1 020.9 95.5 震荡30 min 779.0 99.3 0 33.0 0 911.3 85.2 振摇2 min 712.2 79.3 0 31.9 0 823.4 77.0 表 3 方法的线性范围与检出限
Table 3 Linear ranges and detection limits of the method
砷化合物
arsenic species线性关系
linear regression equation相关系数
R检出限/μg·L-1
limit of detection定量限(干质量)/μg·kg-1
limit of quantification (dry weight)砷甜菜碱AsB y=247.47x-397.7 0.999 8 0.096 0.32 亚砷酸盐As(Ⅲ) y=304.53x-460.73 0.999 8 0.082 0.27 二甲基砷酸DMA y=289.28x-334.91 0.999 9 0.090 0.30 一甲基砷酸MMA y=208.2x-333.36 0.999 7 0.130 0.43 砷酸盐As(Ⅴ) y=414.89x-840.68 0.999 5 0.057 0.19 表 4 鱼中5种形态砷的加标回收结果(n=3)
Table 4 Recovery data of five arsenic speciations from spiked fish
砷化合物
arsenic species添加水平/μg·L-1
spiking level平均回收率/%
average recovery相对标准偏差/%
RSD砷甜菜碱AsB 0.5 103.0 9.97 5.0 99.7 9.42 50.0 97.4 5.11 亚砷酸盐As(Ⅲ) 0.5 89.9 9.21 5.0 93.2 5.33 50.0 99.5 3.59 二甲基砷酸DMA 0.5 92.2 3.27 5.0 89.3 7.69 50.0 94.2 7.39 一甲基砷酸MMA 0.5 104.0 5.66 5.0 100.0 5.73 50.0 97.2 4.52 砷酸盐As(Ⅴ) 0.5 94.0 7.32 5.0 98.4 2.15 50.0 93.6 6.73 表 5 不同海产品中5种形态砷质量分数
Table 5 Concentrations of five arsenic speciations in different seafood
样品类型
sample砷甜菜碱 AsB 亚砷酸盐 As(ⅠⅡ) 二甲基砷酸 DMA 一甲基砷酸 MMA 砷酸盐 As(Ⅴ) 5种As总量/μg· kg-1
sum总As /μg· kg-1
total总提取率/%
total recovery测定值/μg· kg-1
content占总量比例/%
percentage测定值/μg· kg-1
content占总量比例/%
percentage测定值/μg· kg-1
content占总量比例/%
percentage测定值/μg· kg-1
content占总量比例/%
percentage测定值/μg· kg-1
content占总量比例/%
percentage斑节对虾(P.monodon) 69 474.6 99.4 454.3 0.6 < LOQ 0 < LOQ 0 < LOQ 0 69 928.8 68 790.0 101.7 金枪鱼( T.albacares) 7 733.2 99.9 4.9 0.06 < LOQ 0 1.3 0.04 < LOQ 0 7 739.5 7 750.0 99.8 澳洲肺鱼(L.calcarifer) 20 519.7 99.7 56.4 0.3 2.2 0.01 < LOQ 0 < LOQ 0 20 578.3 20 400.0 100.9 速食海苔( P.umbilicalis) 541.9 65.6 < LOQ 0 284. 4 34.4 < LOQ 0 < LOQ 0 826.3 916.0 90.2 注: < LOQ.低于定量限
Note: < LOQ. limit of quantification -
[1] 张华, 王英锋, 施燕支, 等. 高效液相色谱及联用技术在砷形态分析中的应用[J]. 光谱学与光谱分析, 2007, 27(2): 386-390. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq6GJNLog2I24O5ixMbnHHZJFVz2kly7_0Zm3GzZVVLw95sqzuYexIb2VPG0eV2NQLV5IkDdWytLBAGxIyILJqphZNFg6CaPKvcaPUkrm5y7Iwag3UadhQREvVhKyX3M1qQJ2Er90P649WcpOEKaPclliI3A_6Ha8hnEoa3LQnBKwvyAG7stHgty&uniplatform=NZKPT&language=CHS [2] KURTTIO H K P, HAKALA E, KAHELIN H, et al. Urinary excretion of arsenic species after exposure to arsenic present in drinking water[J]. Arch Environ Contam Toxicol, 1998, 34(3): 297-305. doi: 10.1007/s002449900321
[3] KALMAN D A J H, BELLE G V, BURBACHER T, et al. The effect of variable environmental arsenic contamination on urinary concentrations of arsenic species[J]. Environ Health Perspect, 1990, 89(11): 145-151. doi: 10.1289/ehp.9089145
[4] DEVESA V, VELEZ D, MONTORO R. Effect of thermal treatments on arsenic species contents in food[J]. Food Chem Toxicol, 2008, 46(1): 1-8. doi: 10.1016/j.fct.2007.08.021
[5] HYMER C B, CARUSO J A. Arsenic and its speciation analysis using high performance liquid chromatography and in ductively coupled plasma mass spectromet[J]. Chromatogr, 2004, 1045(1/2): 1-13. doi: 10.1016/j.chroma.2004.06.016
[6] KAISE T O-OY, OCHI T, OKUBO T, et al. Toxicological study of organic arsenic compound in marine algae using mammalian cell culture technique[J]. J Food Hyg Soc Jpn, 1996, 37(3): 135-141. doi: 10.3358/shokueishi.37.135
[7] 吕超, 刘丽萍, 董慧茹, 等. 高效液相色谱-电感耦合等离子体质谱联用技术测定水产类膳食中5种砷形态的方法研究[J]. 分析测试学报, 2010, 29(5): 465-468. doi: 10.3969/j.issn.1004-4957.2010.05.008 [8] 殷学锋, 徐光明, 谷雪, 等. 因子分析——氢化物发生原子吸收法分析砷的形态[J]. 分析化学, 1999, 27(7): 798-801. doi: 10.3321/j.issn:0253-3820.1999.07.013 [9] 杨慧, 王富华, 王旭, 等. 蔬菜中砷的形态分析技术研究与应用[J]. 湖北农业科学, 2010, 49(9): 2230-2233. https://www.doc88.com/p-6292924368811.html [10] SHAH A Q, KAZI T G, BAIG J A, et al. Accumulation of arsenic in different fresh water fish species-potential contribution to high arsenic intakes[J]. Food Chem, 2010, 119(2): 840-844. doi: 10.1016/j.foodchem.2009.08.041
[11] HEITLAND P, KOSTER H D. Comparison of different medical cases in urinary arsenic speciation by fast HPLC-ICP-MS[J]. Int J Hyg Environ Health, 2009, 212(4): 432-438. doi: 10.1016/j.ijheh.2008.09.003
[12] GARCIA S S, QUIJANO N MA, BONILLA SIMON M M. Determination of soluble toxic arsenic species in alga samples by microwave-assisted extraction and high performance liquid chromatography-hydride generation-inductively coupled plasma-atomic emission spectrometry[J]. J Chromatogr A, 2006, 1129(1): 54-60. doi: 10.1016/j.chroma.2006.06.083
[13] WALTER G D K, CLAUDIA S, ZDENKA S, et al. Arsenobetaine and other arsenic compounds in the National Research Council of Canada Certified Reference Materials DORM 1 and DORM 2[J]. J Anal Atomic Spectrom, 1998, 13(3): 183-187. doi: 10.1039/a705634f
[14] RATTANACHONGKIAT S G. Determination of arsenic species in fish, crustacean and sediment samples from Thailand using high performance liquid chromatography (HPLC) coupled with inductively coupled plasma mass spectrometry (ICP-MS)[J]. J Environ Monitoring, 2004, 6(4): 254-261. doi: 10.1039/B312956J
[15] UTE K J K, ECKARD J. Simultaneous separation of 17 inorganic and organic arsenic compounds in marine biota by means of high-performance liquid chromatography/inductively coupled plasma mass spectrometry[J]. Rapid Commun Mass Spectrom, 2002, 16(10): 965-974. doi: 10.1002/rcm.671
[16] 郝春莉, 曹煊, 荆淼, 等. 鱿鱼丝中砷的形态分析[J]. 分析科学学报, 2007, 23(6): 621-626. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq588V80p5X2X580ppy61MQzLqqYeRc20VVPhKLzjc0hElLk1R-FEGoPN8Wg9-ZV2LxzTD19BmtPo8vdJQvnya_ObC7a3vSD20jwibndi6kamNROs9EPbxzTN8SSH5kW9Ua1I4ujsHfkXsC_jcW-7RB7&uniplatform=NZKPT [17] Van JOHANNES T, ŠLEJKOVEC Z. Ion-exchange separation of eight arsenic compounds by high-performance liquid chromatography-UV decomposition-hydride generation-atomic fluorescence spe-ctrometry and stability tests for food treatment procedures[J]. J Chromatogr A, 1997, 789(1/2): 339-348. doi: 10.1016/S0021-9673(97)00703-6
[18] DAGNAC T A P, RUBIO R, RAURET G. Speciation of arsenic in mussels by the coupled system liquid chromatography-UV irradiation-hydride generation-inductively coupled plasma mass spectrometry[J]. Talanta, 1999, 48(4): 763-772. doi: 10.1016/S0039-9140(98)00093-9
[19] KATHRYN L A CBH, KAREN L S J A C. Speciation of arsenic in fish tissue using microwave-assisted extraction followed by HPLC-ICP-MS[J]. J Anal Atom Spectrom, 1999, 14(5): 845-850. doi: 10.1039/a807466f
[20] 张普敦, 许国旺, 魏复盛. 砷形态分析方法进展[J]. 分析化学, 2001, 28(8): 971-977. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq7SpJGtncKc1krjMilpjy7m4Svj3CrKz8QHMFrBSDpWTnQFUdREI8pligvgDYDevArUffICJxm4LcTERDsbVSaWVNCxlBKAIEuXR-COrQbrwITx28ZtoQWCuR1FxM3N240NE8lsLykFUo9CkTvBs8wf&uniplatform=NZKPT [21] 于振花, 荆淼, 陈登云, 等. 微波消解ICP-MS同时测定海产品中的15种元素含量[J]. 海洋科学, 2009, 33(1): 8-11. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq6RjjpgVSnbznHmHqCs__-LR66f2gBnucEUYoy_CoUEstNMYCTy1XUj_IBp2nse11mIIfRbU9Ys3bMf6s7l_aSmIZkFE8vo7JXcw9WZnsEsWRhga5T4cU3XuHJMzZ7D9bWhYawYSL-t3eve_cD5pI1t&uniplatform=NZKPT



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
