Distribution characteristics and health risk assessment of cadmium in abalone from various coastal waters
-
摘要:
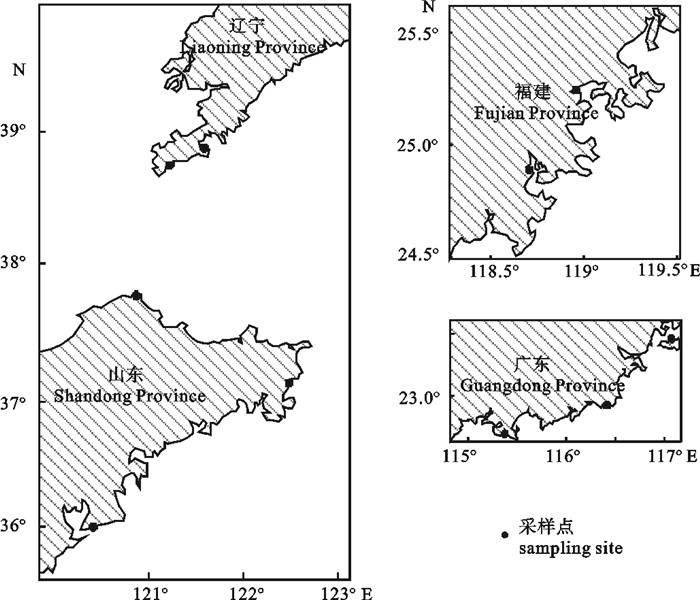
文章对中国部分海域鲍体镉(Cd)的质量分数与分布特征进行了分析讨论,并对鲍体Cd对人体的健康风险进行了评价。结果表明,1) 鲍体w(Cd)总体上呈正态分布,其平均值为0.88 mg·kg-1,变化范围为0.06~2.02 mg·kg-1,其中广东、福建、山东和辽宁海域鲍体w(Cd)分别为(0.42 ±0.21)mg·kg-1、(0.61±0.27)mg·kg-1、(1.21±0.35)mg·kg-1和(1.52±0.20)mg·kg-1,不同海域鲍体w(Cd)差异显著(P < 0.05)。2) 鲍体w(Cd)高于鱼类、头足类和甲壳类海洋生物,与贝类产品w(Cd)相当;鲍体w(Cd)与栖息环境中Cd的污染程度有密切关系。3) 鲍体Cd对人体的致癌性年风险指数低于国际辐射防护委员会推荐的风险水平,通过鲍膳食途径的人体Cd暴露量低于世界卫生组织/联合国粮食和农业组织的食品添加剂联合专家委员会推荐的暂定每周耐受摄入量推荐值。研究结果对于鲍的健康养殖和安全消费具有指导意义。
Abstract:We described the content and distribution of cadmium (Cd) in abalone in some coastal waters in China, and assessed its health risk to human beings. The results show that: 1) The distribution of Cd content in abalone is accord with normal distribution, and the average Cd content is 0.88 mg·kg-1, ranging from 0.06 mg·kg-1 to 2.02 mg·kg-1. The Cd contents (wet weight, mg·kg-1) in abalone from provinces of Guangdong, Fujian, Shandong and Liaoning are (0.42±0.21) mg·kg-1, (0.61± 0.27) mg·kg-1, (1.21±0.35) mg·kg-1 and (1.52±0.20) mg·kg-1, respectively, with significant difference (P < 0.05);2) The Cd content in abalone, which is related with the extent of Cd pollution, is equal to that in shellfish, higher than that in fish, cephalopod and crustacean; 3) The yearly carcinogenic hazard index of Cd residue in abalone is lower than the value recommended by the International Commission on Radiological Protection (ICRP), and the Cd content is lower than the provisional tolerated weekly intake (PTWI) recommended by JECFA. The research provides references for the healthy culture and safe consumption of abalone.
-
Keywords:
- abalone /
- cadmium /
- heavy metal accumulation /
- health risk assessment
-
水体pH是水生动物生长存活的重要环境因子[1],其波动可以对水生动物的组织形态、代谢及基因表达产生直接影响[2]。相关研究指出鱼类长时间暴露于低pH水体,会造成糖原分解变慢、糖异生途径降低及肝糖原得不到及时补充[3]。
多环芳烃化合物 (Polycyclic aromatic hydrocarbons, PAHs) 是水环境中广泛存在的持久性污染物[4]。其在水体环境、河口沉积物中,甚至水生生物中已被大量检出[5],如太湖 (877~5 730 ng·g−1) 和鸭绿江沉积物 (68~1 500 ng·g−1)。高度城市化和工业化地区的PAHs污染水平较高,例如珠江 (1 434~10 811 ng·g−1) 和澳门内港 (294~12 714 ng·g−1)[6-8]。已有研究证实PAHs对多种水生动物具有明确的毒性作用[9-10]。菲 (Phenanthrene, PHE) 等PAHs污染物进入机体后,可直接作用于多环芳烃受体 (AHR),进而转移至细胞核,与芳香烃受体核转位因子 (ARNT) 结合,AhR/ARNT的复合物进而促进细胞色素p450 1A1 (cyp1a1) 基因的表达[11],产生一些高度致癌性中间产物,最终导致细胞凋亡等[12-13]。
对于甲壳动物而言,其脂肪常常存储在肝胰腺的R细胞中[14]。中华绒螯蟹 (Eriocheir sinensis) 是一种主要在长江流域养殖的重要经济品种,“蟹黄”的质量是消费者重点关注的食用品质,其中含有大量的脂肪和胆固醇[15-16],而脂肪是重要的能量物质,因此能量代谢对于中华绒螯蟹而言十分重要。在现代养殖条件下,水生动物由于环境因素的变化更容易发生脂质代谢的变化[17]。随着天气和养殖密度等因素的变化,水体pH也会随时发生改变,且中华绒螯蟹作为典型的底栖生物,其生活在水体地表沉积物表面,非常容易接触到PHE和低pH环境,在生产中若发生两者联合作用,会对养殖造成损失。为探究pH和PHE复合胁迫的毒性作用机制,本实验测定了不同pH下PHE进入中华绒螯蟹机体后,对其重要的呼吸器官鳃和代谢器官肝胰腺的损伤情况,以及对能量代谢主要场所肝胰腺中相关生化指标及基因表达的影响。
1. 材料与方法
1.1 材料
中华绒螯蟹 [(15.0 ± 2.3) g] 采集自上海崇明,运送到上海海洋大学实验基地进行相关实验。实验开始前,所有的蟹均在含有碳过滤自来水 [溶解氧质量浓度8.0~8.5 mg·L−1、pH 7.8、温度 (20±2) ℃] 的脱氯水族箱 (100 cm×60 cm×50 cm) 中进行为期1周的驯化适应,水箱中间均放置几个长形拱状瓦片作为隐蔽物。期间每2 d投喂1次商业饲料 (浙江澳华公司),每天用虹吸法吸取多余饵料,每2 d进行1次水体更新。
1.2 pH和PHE暴露实验建立
为研究低pH和PHE的联合效应,建立了阶乘设计:3个pH分别为5.5、6.5和7.8 (5.5为重度酸化,6.5为中度酸化,7.8为对照),2个PHE质量浓度 (0和50 µg·L−1),分别为对照组pH 7.8×PHE 0,处理组pH 7.8×PHE 50、pH 6.5×PHE 0、pH 6.5×PHE 50、pH 5.5×PHE 0、pH 5.5×PHE 50。酸化条件根据有关的研究和整个酸化环境的预测[15,18]设定。将PHE按照0.02% (质量分数) 溶解在二甲亚砜 (DMSO) 中,配制成1 mg·L−1的母液,在DMSO体积分数为 0.01%的情况下,向PHE处理组中加入适量PHE母液以达到目标PHE质量浓度 (50 μg·L−1) 。实验中PHE质量浓度 (50 µg·L−1) 的设置是参考虾蟹相关实验[18]和中国湖泊环境中的实际浓度[19],pH的设定是基于本实验室的研究基础以及深度酸化的探讨[17]。健康蟹随机分组 (每组3个重复,每个重复10只蟹)。实验期间,使用便携式pH计 (HQ40D,美国Hach) 每4 h检测1次水体pH,用1 mol·L−1 NaOH和1 mol·L−1 HCl调节pH。每2 d更换1次胁迫水体,以保持实验性PHE浓度。实验持续14 d,期间持续充氧,每周饲喂2次商业饲料。
1.3 样品采集
实验14 d后,对中华绒螯蟹进行4 ℃低温麻醉,而后每池取3只蟹解剖采集鳃和肝胰腺,分别置于固定液中保存用于显微结构的观察,另外再采集3只中华绒螯蟹肝胰腺置液氮速冻,−80 ℃保存待测。
1.4 实验方法
1.4.1 组织染色与观察
从不同的实验组中各采集3只中华绒螯蟹,迅速取出肝胰腺和鳃组织,样品置于Bouin氏液里固定24 h,经体积分数为70%、80%、95%、100% 梯度乙醇脱水,然后用二甲苯透明,石蜡包埋,使用手摇式切片机切片,厚度约为5 μm,最后用苏木精和伊红进行常规HE染色,显微镜观察并拍照 (Leica TCS SP8,德国) 。
1.4.2 能量代谢指标的测定
肝胰腺样品以无水乙醇作为匀浆介质,经冰浴匀浆,离心提取上清后按试剂盒 (南京建成) 说明书测定甘油三酯 (TG)、糖原 (Gly)、高密度脂蛋白胆固醇 (HDL-C) 和低密度脂蛋白胆固醇 (LDL-C)。
1.4.3 基因表达的测定
使用TRIozl法对肝胰腺样本进行RNA的提取,使用HiScript®II 1st Strand cDNA Synthesis Kit (+gDNA wiper) (南京诺唯赞) 对RNA进行反转录生成cDNA,根据已报道的相关基因序列设计引物 (表1) 用于荧光定量PCR检测。SYBR® PCR Kit (南京诺维赞) 用于荧光定量PCR反应,反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。基于2−∆∆Ct方法,分析基因的相对表达水平[20]。
表 1 引物名称及序列Table 1 Primer names and sequnences基因
Gene对应蛋白
Corresponding protein引物序列 (5'—3')
Primer sequence (5'−3')ahr 多环芳烃受体
Polycyclic aromatic hydrocarbon receptorF: GGCGGTAACACCAGTGAAGAGTC
R: TGGAGATTGTAGGAGGCGAGAAGTarnt 芳香烃受体核转位因子 (ARNT) 重组蛋白
Aryl hydrocarbon receptor nuclear translocation factor (ARNT) recombinant proteinF: CCAACCTTCATGCGGCAGATGAAC
R: ACACAGGAGCCAGCCAACCAAGcyp1a1 细胞色素
Cytochrome P1A1F: ATTTCGTGCTGGTTTGGC
R: GGAGTTGCTGCGTATTGGT1.5 数据处理
数据采用Levene检验法检测方差齐次性,pH和PHE 2个因素共同胁迫采用SPSS 22.0软件进行双因素方差分析 (Two-way ANOVA),同一因素胁迫采用SPSS 22.0软件进行单因素方差分析 (One-way ANOVA),最后对实验结果采用Duncan's法进行多重比较,采用t检验法检测同一pH下PHE的毒性。实验结果以“平均值±标准差 (
$\overline { x} \pm s $ )”表示,P<0.05为统计学差异显著。2. 结果
2.1 中华绒螯蟹肝胰腺和鳃组织结构
中华绒螯蟹肝胰腺由柱状上皮 (即肝小管) 构成,管腔 (Lumen, Lu) 结构呈星型。PHE胁迫下,pH 7.8时肝胰腺星型结构稍有改变,且基膜脱落,细胞顶端微绒毛 (Microvilli, MV) 部分脱落、微绒毛黏膜 (Enteric coat, EC) 完整但R细胞处出现空泡 (图1-a)。在pH 6.5条件下,肝胰腺管腔扩张,但基膜没有明显脱落,微绒毛黏膜部分破损、B细胞部分破损 (图1-b)。在pH 5.5下,管腔结构明显扩张,部分柱状上皮细胞解体,细胞核固缩破碎,R细胞出现萎缩、胞质空泡化,微绒毛黏膜破损 (图1-c)。
![]() 图 1 中华绒螯蟹肝胰腺和鳃组织暴露在 PHE (50 µg·L−1) 和 pH (7.8、6.5 和 5.5) 中14 d 后的病理变化注:a. pH 7.8×PHE 50组肝胰腺;b. pH 6.5×PHE 50组肝胰腺;c. pH 5.5×PHE 50组肝胰腺;d. pH 7.8×PHE 50组鳃;e. pH 6.5×PHE 50组鳃;f. pH 5.5×PHE 50组鳃。Fig. 1 Pathological changes of hepatopancreas and gill tissues of E. sinensis after exposure to PHE (50 µg·L−1) and pH (7.8, 6.5 and 5.5) for 14 dNote: a. Hepatopancreas in pH 7.8×PHE 50 group; b. Hepatopancreas in pH 6.5×PHE 50 group; c. Hepatopancreas in pH 5.4×PHE 50 group; d. Gill in pH 7.8×PHE 50 group; e. Gill in pH 6.5×PHE 50 group; f. Gill in pH 5.5×PHE 50 group.
图 1 中华绒螯蟹肝胰腺和鳃组织暴露在 PHE (50 µg·L−1) 和 pH (7.8、6.5 和 5.5) 中14 d 后的病理变化注:a. pH 7.8×PHE 50组肝胰腺;b. pH 6.5×PHE 50组肝胰腺;c. pH 5.5×PHE 50组肝胰腺;d. pH 7.8×PHE 50组鳃;e. pH 6.5×PHE 50组鳃;f. pH 5.5×PHE 50组鳃。Fig. 1 Pathological changes of hepatopancreas and gill tissues of E. sinensis after exposure to PHE (50 µg·L−1) and pH (7.8, 6.5 and 5.5) for 14 dNote: a. Hepatopancreas in pH 7.8×PHE 50 group; b. Hepatopancreas in pH 6.5×PHE 50 group; c. Hepatopancreas in pH 5.4×PHE 50 group; d. Gill in pH 7.8×PHE 50 group; e. Gill in pH 6.5×PHE 50 group; f. Gill in pH 5.5×PHE 50 group.中华绒螯蟹幼蟹的鳃由数条形状规整的鳃丝以及一条鳃轴组成。鳃叶分为上皮层和血腔,而上皮层主要由角质层、上皮细胞层以及基膜组成。通过HE染色法对中华绒螯蟹鳃组织的形态结构变化进行观察,所有处理组肝胰腺结构均有不同程度的改变 (图1)。PHE胁迫下,pH 7.8时鳃丝厚度变薄,局部基膜出现脱落,部分角质层表皮分离,近鳃腔部分有血细胞存在 (图1-d)。而在pH 6.5条件下,鳃轴厚度变厚,但鳃丝的基膜完整,角质层表皮平整 (图1-e) 。在pH 5.5下,鳃丝形状扭曲,部分角质层表皮破损,基膜脱落,鳃轴出现空泡化 (图1-f)。
2.2 中华绒螯蟹肝胰腺能量代谢指标
如图2-a所示,在PHE 0 µg·L−1组中,中华绒螯蟹TG浓度随着pH降低而显著降低 (P<0.05)。而在PHE 50 µg·L−1组中,pH 6.5处理时,TG浓度最高,且显著高于单独pH 6.5处理 (P<0.05);pH 5.5时,TG浓度最低,且低于pH 7.8条件下的TG浓度。pH和PHE的交互作用对中华绒螯蟹TG浓度有显著影响 (P<0.05,表2)。
![]() 图 2 不同 pH 条件下 PHE 浓度对中华绒螯蟹能量代谢指标的影响注:数值表示为“平均值±标准误”(n=3);方柱上方不同大写字母表示在PHE 0 µg·L−1下差异显著 (P<0.05);不同小写字母表示在PHE 50 µg·L−1下差异显著 (P<0.05);*表示相同pH下组间差异显著 (P<0.05)。图3同此。Fig. 2 Effect of PHE concentration on energy metabolism indexes of E. sinensis under different acidification conditionsNote: Values are represented as Mean±SE (n=3); different uppercase letters above the columns represent significant differences at PHE 0 µg·L−1 (P<0.05); different lowercase letters represent significant differences at PHE 50 µg·L−1 (P<0.05); * represents significant differences between the two groups at the same pH values (P<0.05). The same case in Fig. 3.表 2 pH 和 PHE 对中华绒螯蟹肝胰腺甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和糖原含量影响的双因素方差分析Table 2 Two-way analysis of variance for influence of pH and PHE on contents of TG, HDL
图 2 不同 pH 条件下 PHE 浓度对中华绒螯蟹能量代谢指标的影响注:数值表示为“平均值±标准误”(n=3);方柱上方不同大写字母表示在PHE 0 µg·L−1下差异显著 (P<0.05);不同小写字母表示在PHE 50 µg·L−1下差异显著 (P<0.05);*表示相同pH下组间差异显著 (P<0.05)。图3同此。Fig. 2 Effect of PHE concentration on energy metabolism indexes of E. sinensis under different acidification conditionsNote: Values are represented as Mean±SE (n=3); different uppercase letters above the columns represent significant differences at PHE 0 µg·L−1 (P<0.05); different lowercase letters represent significant differences at PHE 50 µg·L−1 (P<0.05); * represents significant differences between the two groups at the same pH values (P<0.05). The same case in Fig. 3.表 2 pH 和 PHE 对中华绒螯蟹肝胰腺甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和糖原含量影响的双因素方差分析Table 2 Two-way analysis of variance for influence of pH and PHE on contents of TG, HDL${\text{-}} $ C, LDL${\text{-}} $ C and Gly in E. sinensis hepatopancreas能量代谢指标
Energy metabolism index处理组别
Group自由度
DF均方差
MSF P 甘油三酯 TG PHE 1 0.009 6.591 <0.001 pH 2 0.025 17.585 <0.001 PHE×pH 2 0.018 12.798 <0.001 高密度脂蛋白胆固醇 HDL-C PHE 1 0.000 2 0.301 0.593 pH 2 0.002 201.824 <0.001 PHE×pH 2 0.000 1 18.863 <0.001 低密度脂蛋白胆固醇 LDL-C PHE 1 0.000 1 9.378 0.010 pH 2 0.008 145.710 <0.001 PHE×pH 2 0.001 10.200 0.003 糖原 Gly PHE 1 0.240 39.171 0.020 pH 2 0.677 110.327 <0.001 PHE×pH 2 0.043 6.952 0.010 与对照组 (pH 7.8×PHE 0) 相比,PHE使得Gly浓度显著降低 (P<0.05),在PHE 0 µg·L−1组中,Gly浓度也随着pH的降低而显著下降 (P<0.05,图2-b)。pH和PHE的交互作用对中华绒螯蟹Gly浓度变化有显著影响 (P<0.05,表2)。在PHE 50 µg·L−1组中,Gly浓度随着pH降低而显著下降 (P<0.05),在pH 5.5时达到最低,为所有实验组中的最低值 (P<0.05,图2-b)。
HDL-C也有相似的结果,无论是否存在PHE,pH的降低均可导致中华绒螯蟹HDL-C浓度显著降低 (P<0.05,图2-c),且pH和PHE的交互作用也对中华绒螯蟹HDL-C浓度有显著影响 (P<0.05,表2) 。
pH和PHE的交互作用对中华绒螯蟹的LDL-C浓度也有显著影响 (P<0.05,表2)。在PHE 0 µg·L−1组中,与pH 7.8相比,pH 6.5及pH 5.5条件下LDL-C浓度均出现了显著降低 (P<0.05),且pH 5.5组显著低于pH 6.5组 (P<0.05)。在PHE 50 µg·L−1组中,pH 6.5及pH 5.5条件下LDL-C浓度也出现显著下降 (P<0.05),但两组间无显著性差异 (P>0.05,图2-d)。
2.3 中华绒螯蟹肝胰腺中ahr、arnt、cyp1a1基因表达水平
实时荧光定量PCR检测了pH和PHE对中华绒螯蟹肝胰腺中的ahr、arnt、cyp1a1基因相对表达量的影响 (图3)。在PHE 0 µg·L−1组中,与pH 7.8组相比,pH 6.5组ahr基因表达量显著降低 (P<0.05),而pH 5.5组的ahr基因表达量则显著升高 (P<0.05)。在PHE 50 µg·L−1组中,随着pH的降低,ahr基因表达量显著升高 (P<0.05),且在pH 6.5及pH 5.5条件下,均显著高于PHE 0 µg·L−1组 (P<0.05,图3-a)。pH 5.5×PHE 50组的ahr基因表达量为所有组中最高。pH与PHE的交互作用对ahr基因的表达量具有显著影响 (P<0.05,表3)。
表 3 pH 和 PHE 对中华绒螯蟹 ahr、 arnt、 cyp1a1 基因表达量影响的双因素方差分析Table 3 Two-way analysis of variance for effects of pH and PHE on ahr, arnt and cyp1a1 gene expression of E. sinensis基因
Gene处理组别
Group自由度
DF均方差
MSF P ahr PHE 1 7.889 204.860 <0.001 pH 2 7.760 208.258 <0.001 PHE×pH 2 5.111 134.930 <0.001 arnt PHE 1 8.133 314.861 <0.001 pH 2 8.276 320.375 <0.001 PHE×pH 2 5.697 220.565 <0.001 cyp1a1 PHE 1 51.122 1 643.494 <0.001 pH 2 28.965 931.189 <0.001 PHE×pH 2 4.721 151.787 <0.001 PHE 0 µg·L−1组中,与对照组相比,pH 5.5和pH 6.5处理均未使arnt基因表达量出现显著性变化 (P>0.05,图3-b) 。而在PHE 50 µg·L−1组中,随着pH的降低,arnt基因的表达量随之显著升高 (P<0.05),且在pH 5.5和pH 6.5下,均显著高于PHE 0 µg·L−1组 (P<0.05,图3-b)。同样,pH与PHE的交互作用对arnt基因的表达量也有显著性影响 (P<0.05,表3)。pH 5.5×PHE 50组的arnt基因表达量也为所有组中的最大值。
对于cyp1a1基因而言,在PHE 0 µg·L−1组中,与pH 7.8组相比,pH 6.5使cyp1a1基因的表达量显著降低 (P<0.05) ,而pH 5.5处理使cyp1a1基因的表达量显著升高 (P<0.05,图3-c)。在PHE 50 µg·L−1组中,pH的降低使得cyp1a1基因的表达量显著升高 (P<0.05,图3-c),在pH 5.5条件下,cyp1a1的基因表达量最高。pH和PHE对cyp1a1基因的表达量有显著的交互作用 (P<0.05,表3)。
3. 讨论
鳃是甲壳动物重要的呼吸器官,也是重要的渗透压和离子调节器官[21],肝胰腺是中华绒螯蟹的主要消化腺,因而环境污染物很可能对中华绒螯蟹的鳃和肝胰腺造成组织损伤。本研究中,PHE对中华绒螯蟹的鳃和肝胰腺均造成了一定程度的损伤,这与一些污染物造成中华绒螯蟹组织损伤的研究相一致[15]。肝胰腺作为甲壳类动物的重要多功能器官,不仅参与食物消化吸收相关的消化酶的合成和分泌,且在能量代谢中具有重要作用[22]。中华绒螯蟹肝胰腺小管的R细胞以及B细胞顶端的微绒毛和微绒毛表面的黏膜对物质转运具有重要作用[14]。本研究中,不同pH与PHE联合作用均对其造成不同程度的损伤,说明PHE对中华绒螯蟹呼吸和消化系统产生了影响,从而影响其能量代谢。同时R细胞是重要的脂肪和糖原贮藏场所,且能量的消耗往往会导致细胞收缩和萎缩[23]。本研究中,在pH 7.8及5.5下,PHE不仅使得肝小管细胞顶端的微绒毛和微绒毛表面的黏膜脱落破损,而且使得肝小管R细胞萎缩、空泡化,说明在pH 7.8及5.5下,PHE对中华绒螯蟹的糖代谢和脂代谢均产生了一定影响。因而相较于正常的pH,pH 6.5在一定程度上缓解了PHE对中华绒螯蟹的组织损伤,而pH 5.5则加剧了PHE对中华绒螯蟹肝胰腺的组织损伤,这也表明在极端环境下,生物体可能通过大量的能量消耗以抵御外界压力[24]。
此外,肝胰腺还被认为是多种环境应激的关键靶器官[17]。研究表明,当受到环境压力时,甲壳类动物需要额外的能量来维持体内平衡[25]。pH作为水生动物生长发育重要的环境因子[26],其异常变化往往导致动物机体代谢失调,能量消耗增加[27]。TG、Gly、HDL-C、LDL-C等物质的动态平衡对机体健康至关重要,它们在机体的免疫反应和抗氧化能力中发挥着重要作用[28-29]。本研究中,在pH 7.8条件下,PHE导致Gly浓度显著降低,说明糖类是中华绒螯蟹遭受环境压力时优先利用的物质之一,这与对一些鱼类的研究相一致[30]。与中华绒螯蟹暴露于苯并芘 (Bap) 中的研究结果也类似[31],说明PAHs会引起中华绒螯蟹的能量消耗。而不同的pH与PHE的联合作用均使中华绒螯蟹肝胰腺Gly显著降低,尤其在pH 5.5条件下,PHE对Gly的影响最为显著,说明机体抵御环境压力时会产生能量损耗[24]。
对于TG而言,单独的PHE处理并未使中华绒螯蟹肝胰腺TG发生显著改变,甚至在pH 6.5下,PHE诱导TG浓度较单独PHE处理组显著升高,这可能是中度的酸化诱导了中华绒螯蟹对外界环境的积极响应,某种程度上减轻了PHE的毒性,降低了脂质的消耗[32]。但pH 5.5与PHE联合胁迫时,TG浓度为所有组中最低,表明重度酸化加剧了PHE对中华绒螯蟹糖代谢和脂代谢的影响。而HDL-C和LDL-C在胆固醇向组织运输的过程中起着重要作用[33-34],其在其他动物上的研究往往与“疾病”因素呈现负向关系[35]。本研究中,单独PHE处理使得中华绒螯蟹肝胰腺HDL-C浓度较对照组显著降低,表明低浓度的PHE对中华绒螯蟹存在潜在风险。而不同程度pH与PHE的联合作用均对中华绒螯蟹HDL-C产生了显著影响,尤其是pH 5.5×PHE 50组,肝胰腺HDL-C浓度为所有组中最低,表明酸化和PHE协同处理对中华绒螯蟹能量代谢具有显著影响。与之相似,酸化和PHE的联合作用也会使得LDL-C浓度显著降低。
pH和PHE的联合作用导致TG、Gly、HDL-C、LDL-C浓度的显著变化,尤其在pH 5.5的重度酸化条件下,PHE显著影响了中华绒螯蟹的能量代谢平衡。由此可见,不同环境应激源可能会产生协同效应,从而影响甲壳动物的能量代谢过程,这与铜 (Cu) 和土霉素 (Oxytetracycline) 协同效应诱导了草鱼 (Ctenopharyngodon idella) 的脂质代谢的研究结果相一致[36]。
本研究中,PHE显著促进了arnt和cyp1a1基因的表达,且酸化条件显著提高了ahr和arnt基因的表达,并最终导致cyp1a1基因表达量的显著升高。Holen和Olsvik[37]同样发现PHE对大西洋鳕 (Gadus morhua) cyp1a1基因表达的诱导,同时还发现脂多糖 (Lipopolysaccharide) 和PHE的交互作用对cyp1a1基因的显著诱导。Guo等[38]报道了PAHs可以诱导菲律宾蛤仔 (Ruditapes philippinarum) 中ahr基因的表达;Liu等[39]发现苯并芘 (BaP) 可显著诱导栉孔扇贝 (Chlamys farreri) 中ahr基因的表达;低浓度BaP可诱导栉孔扇贝中ahr和arnt基因的表达[40];Lima等[41]在牡蛎 (Crassostrea gasar) 中也发现pH和PHE协同效应对cyp家族基因的诱导。这与本研究结果一致,本实验也发现pH与PHE协同作用可诱导中华绒螯蟹cyp1a1基因的表达。
ahr基因与脂类代谢以及能量代谢有重要关联,有研究指出ahr对哺乳动物脂质代谢具有调控作用[42],多氯联苯或ahr配体暴露导致鱼类肝糖原浓度降低的研究也有相关报道[43]。本研究也阐明了PHE对中华绒螯蟹脂质代谢产生影响的重要原因,而过度的酸化与PHE产生交互效应,显著影响了中华绒螯蟹的能量代谢。相关研究指出,在无脊椎动物中,PAHs的解毒代谢经由I相的AHR-ARNT信号通路以及II相的谷胱甘肽-S-转移酶 (GST) 代谢进行,期间产生大量的活性中间体和活性氧 (Reactive oxygen species, ROS),干扰水生生物的正常生理功能[44]。因此,pH和PHE协同作用可能对中华绒螯蟹能量代谢及抗氧化系统产生影响。
本研究结果表明,从组织结构方面,pH 6.5可以缓解PHE的毒性作用;从能量代谢、基因表达方面,随着pH的降低,PHE毒性的影响也随之增强。
-
表 1 鲍w(Cd)的统计结果
Table 1 Statistics of Cd content in abalone
平均值/mg·kg-1
average中值/mg·kg-1
median偏度系数
skewness标准偏差
standard deviation辽宁 Liaoning 1.52a 1.59 -0.31 0.20 山东 Shandong 1.21b 1.13 0.86 0.35 福建 Fujian 0.61c 0.53 0.75 0.27 广东 Guangdong 0.42c 0.39 1.11 0.21 注:同一列中,不同上标字母表示存在显著性差异(P < 0.05)
Note: Different superscripts within the same column indicate significant difference(P < 0.05).表 2 不同海产品w(Cd)的比较
Table 2 Comparison of Cd content among various aquatic products
样品名称
sample namew(Cd)/mg·kg-1
content数据来源
reference鱼 Perciformes 0.04,0.10 [11, 14] 虾 Penaeus joyneri 0.17,0.29 [11, 14] 莱氏拟乌贼 Sepioteuthis lessoniana 0.17,0.07 [11, 14] 近江牡蛎 Crassostrea rivularis 1.86,1.46,4.84 [8, 12, 14] 长牡蛎 C.gigas 0.47,0.28 [8, 12] 翡翠贻贝 Perna viridis 0.22,0.528,4.62 [13-14, 18] 菲律宾蛤仔 Ruditapes philippinarum 0.32,5.12,1.01 [12-13, 18] 扇贝 scallop 2.71,0.92,4.03 [18-20] 鲍 abalone 0.88 此次调查 表 3 鲍体Cd通过膳食途径的健康年风险指数和人体每周暴露量计算结果
Table 3 Health risk caused by Cd in abalone through diets and weekly exposure of Cd
地区
area风险指数/年-1
risk index每周暴露量/mg·kg-1
weekly exposure广东 Guangdong 1.21×10-5 ±1.13×10-5 1.0±0.9 辽宁 Liaoning 4.40×10-5±5.81×10-6 3.5±0.5 山东 Shandong 3.50×10-5±1.02×10-5 2.8±0.8 福建 Fujian 1.76×10-5±7.84×10-6 1.4±0.6 -
[1] MARÍA-CERVANTES A, JIMÉNEZ-CÁRCELES F J, ÁLVAREZ-ROGEL J. As, Cd, Cu, Mn, Pb and Zn contents in sediments and mollusks (Hexaplex trunculus and Tapes decussatus) from coastal zones of a Mediterranean lagoon (Mar Menor, SE Spain) affected by mining wastes[J]. Water, Air & Soil Poll, 2009, 200(1): 289-304. doi: 10.1007/s11270-008-9913-7
[2] BELLAS J, FERNáNDEZ N, LORENZO I, et al. Integrative assessment of coastal pollution in a Ria coastal system (Galicia, NW Spain): correspondence between sediment chemistry and toxicity[J]. Chemosphere, 2008, 72(5): 826-835. doi: 10.1016/j.chemosphere.2008.02.039
[3] 冯志权, 冯金祥, 马明辉. 北方海洋生态站几种经济动物体内5种重金属残留量[J]. 海洋环境科学, 2004, 23(3): 49-50. https://lib.cqvip.com/Qikan/Article/Detail?id=10419753&from=Qikan_Article_Detail [4] 杨美兰, 林钦, 王增焕, 等. 大亚湾海洋生物体重金属含量与变化趋势分析[J]. 海洋环境科学, 2004, 23(1): 41-44. [5] BEIRASA R, BELLASA J, FERNA N, et al. Assessment of coastal marine pollution in Galicia (NW Iberian Peninsula); metal concentrations in seawater, sediments and mussels (Mytilus galloprovincialis) versus embryo-larval bioassays using Paracentrotus lividus and Ciona intestinalis[J]. Mar Environ Res, 2003, 56(4): 531-553. doi: 10.1016/S0141-1136(03)00042-4
[6] 贺广凯. 黄渤海沿岸经济贝类体中重金属残留水平[J]. 中国环境科学, 1996, 16(2): 96-100. https://qikan.cqvip.com/Qikan/Article/Detail?id=2315345 [7] 严卫星, 丁晓雯. 食品毒理学[M]. 北京: 中国农业大学出版社, 2009: 298-299. https://xueshu.baidu.com/usercenter/paper/show?paperid=5ee0875e9690e5dd270537a4913336b6&site=xueshu_se [8] 王增焕, 王许诺, 林钦. 贝类产品镉铜铅锌的含量特征与风险分析[J]. 农业环境科学学报, 2011, 30(6): 1208-1213. https://www.doc88.com/p-6042955508251.html [9] 王增焕, 林钦, 王许诺, 等. 华南沿海牡蛎重金属含量特征及其风险评估[J]. 水产学报, 2011, 35(2): 291-297. https://lib.cqvip.com/Qikan/Article/Detail?id=37030217&from=Qikan_Search_Index [10] 王增焕, 林钦, 王许诺. 大亚湾海洋生物体内铅的含量与风险评估[J]. 南方水产, 2010, 6(1): 54-58. [11] 王增焕, 林钦, 王许诺, 等. 大亚湾经济类海洋生物体的重金属含量分析[J]. 南方水产, 2009, 5(1): 23-28. doi: 10.3969/j.issn.1673-2227.2009.01.004 [12] 王许诺, 王增焕, 林钦, 等. 广东沿海贝类4种重金属含量分析和评价[J]. 南方水产, 2008, 4(6): 83-87. https://www.schinafish.cn/article/id/b3f84b05-1feb-4c86-ad2c-6fce8854d649 [13] 李玉环. 贝类体内重金属镉的富集和消除规律及食用安全性的研究[D]. 青岛: 中国海洋大学, 2005: 35-44. 10.7666/d.y829183 [14] 秦春艳. 广东沿海海洋生物体内有毒物质的生物积累与污染评价[D]. 广州: 华南师范大学, 2007: 28-33. https://www.doc88.com/p-8136039426092.html [15] 王增焕, 林钦, 王许诺. 南海北部沿岸贝类体内镉含量及健康风险评价[J]. 中国水产科学, 2011, 18(6): 1406-1412. doi: 10.3724/SP.J.1118.2011.01406 [16] 王增焕, 林钦, 王许诺, 等. 华南沿海贝类产品重金属元素含量特征及其安全性评价[J]. 上海海洋大学学报, 2011, 20(6): 923-929. http://qikan.cqvip.com/Qikan/Article/Detail?id=40032224 [17] 孙超, 陈振楼, 张翠, 等. 上海市主要饮用水源地重金属健康风险初步评价[J]. 环境科学研究, 2009, 22(1): 60-65. http://www.hjkxyj.org.cn/article/id/20090110 [18] 纪焕红, 徐韧, 程祥圣, 等. 上海市售海产贝类食用安全质量评价及分级[J]. 海洋环境科学, 2009, 28(2): 193-197. https://www.doc88.com/p-7764207980885.html [19] 马元庆, 唐学玺, 刘义豪, 等. 山东半岛近海贝类污染状况调查与评价[J]. 海洋环境科学, 2009, 28(5): 562-565. https://lib.cqvip.com/Qikan/Article/Detail?id=31791393&from=Qikan_Article_Detail [20] 刘桂荣. 扇贝中重金属残留及食用风险分析[D]. 青岛: 中国海洋大学, 2005: 10-15. https://www.xueweilunwen.com/doc/922175 [21] 李学鹏, 段青源, 励建荣. 我国贝类产品中重金属镉的危害及污染分析[J]. 食品科学, 2010, 31(17): 457-461 https://lib.cqvip.com/Qikan/Article/Detail?id=35344790&from=Qikan_Search_Index [22] 孟祥周, 余莉萍, 郭英, 等. 滴滴涕类农药在广东省鱼类中的残留及人体暴露水平初步评价[J]. 生态毒理学报, 2006, 1(2): 116-122. https://lib.cqvip.com/Qikan/Article/Detail?id=22296186&from=Qikan_Search_Index [23] 唐洪磊, 郭英, 孟祥周, 等. 广东省沿海城市居民膳食结构及食物污染状况的调研——对持久性卤代烃和重金属的人体暴露水平评价[J]. 农业环境科学学报, 2009, 28(2): 329-336. https://lib.cqvip.com/Qikan/Article/Detail?id=29519677&from=Qikan_Search_Index [24] 郭卫东, 杨逸萍, 石谦, 等. 我国典型海域主要生物体微量元素含量的统计研究[J]. 海洋环境科学, 2003, 22(5): 1-5. https://lib.cqvip.com/Qikan/Article/Detail?id=7882249&from=Qikan_Search_Index [25] LOBEL P B, BEL KHODE S P, BAJDIK C, et al. General characteristics of the frequency distributions of element concentrations and of interelemental correlations in aquatic organisms[J]. Mar Environ Res, 1992, 33(2): 111-126. https://www.sciencedirect.com/science/article/abs/pii/014111369290136A
[26] LIU H, YANG J, GAN J. Trace element accumulation in bivalve mussels Anodonta woodiana from Taihu Lake, China [J]. Arch Environ Contamination & Toxicol, 2010, 59(4): 593-601. doi: 10.1007/s00244-010-9521-6
[27] RAINBOW P S. Trace metal bioaccumulation: Models, metabolic availability and toxicity[J]. Environ Int, 2007, 33(4): 576-582. https://www.sciencedirect.com/science/article/abs/pii/S0160412006000729
[28] AMIARD J C, AMIARD-TRIQUET C, BARKA S, et al. Metallothioneins in aquatic invertebrates: their role in metal detoxification and their use as biomarkers[J]. Aquat Toxicol, 2006, 76(2): 160-202. https://www.sciencedirect.com/science/article/abs/pii/S0166445X05003279
[29] RAINBOW P S. Trace metal concentrations in aquatic invertebrates: why and so what?[J]. Environ Poll, 2002, 120(3): 497-507. https://www.sciencedirect.com/science/article/abs/pii/S0269749102002385
[30] 徐韧, 杨颖, 李志恩. 海洋环境中重金属在贝类体内的蓄积分析[J]. 海洋通报, 2007, 26(5): 117-120. https://lib.cqvip.com/Qikan/Article/Detail?id=25531854&from=Qikan_Search_Index [31] 王晓丽, 孙耀, 张少娜, 等. 牡蛎对重金属生物富集动力学特性研究[J]. 生态学报, 2004, 24(5): 1086-1090. https://lib.cqvip.com/Qikan/Article/Detail?id=9853969&from=Qikan_Search_Index [32] 李学鹏, 励建荣, 段青源, 等. 泥蚶对重金属铜、铅、镉的生物富集动力学[J]. 水产学报, 2008, 32(4): 592-600. https://lib.cqvip.com/Qikan/Article/Detail?id=27894258&from=Qikan_Search_Index [33] FATTORINI D, NOTTI A, DI MENTO R, et al. Seasonal, spatial and inter-annual variations of trace metals in mussels from the Adriatic sea: a regional gradient for arsenic and implications for monitoring the impact of off-shore activities[J]. Chemosphere, 2008, 72(10): 1524-1533. https://www.sciencedirect.com/science/article/abs/pii/S004565350800578X
[34] 甘居利, 贾晓平, 林钦, 等. 应用重金属和有机污染物对人体健康的风险评价理论反推牡蛎安全消费量[J]. 南方水产, 2008, 4(6): 17-25. https://lib.cqvip.com/Qikan/Article/Detail?id=28855279&from=Qikan_Search_Index [35] FERNANDEZ-GARCIA E, CARVAJAL-LERIDA I, PEREZ-GALVEZ A. In vitro bioaccessibility assessment as a prediction tool of nutritional efficiency[J]. Nutr Res, 2009, 29(11): 751-760. https://www.sciencedirect.com/science/article/abs/pii/S0271531709001730
[36] AMIARD J C, AMIARD-TRIQUET C, CHARBONNIER L, et al. Bioaccessibility of essential and non-essential metals in commercial shellfish from Western Europe and Asia[J]. Food Chem Toxicol, 2008, 46(6): 2010-2022. https://www.sciencedirect.com/science/article/abs/pii/S0278691508000641
[37] BRAGIGAND V, BERTHET B, AMIARD J C, et al. Estimates of trace metal bioavailability to humans ingesting contaminated oysters[J]. Food & Chem Toxicol, 2004, 42(11): 1893-1902.
-
期刊类型引用(1)
1. 王婷,贾磊,谷德贤,马超,于燕光,陈春秀. 早期发育阶段日本蟳表型性状对体质量的影响分析. 天津农业科学. 2024(12): 66-74 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
