Effects of different temperature and salinity on growth and biochemical constituents of Gracilaria chouae
-
摘要:
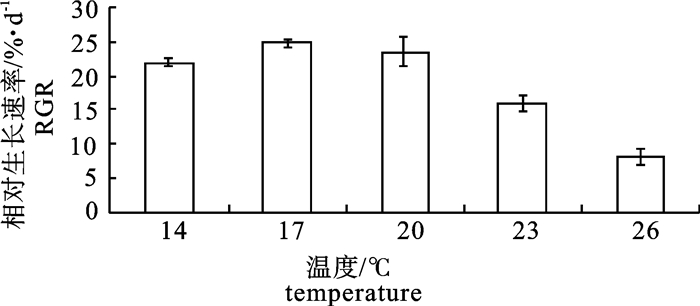
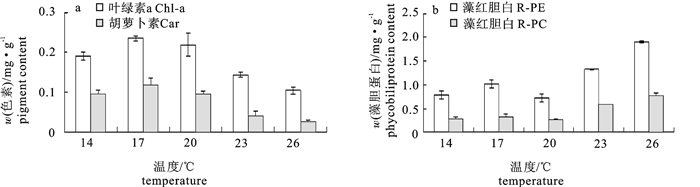
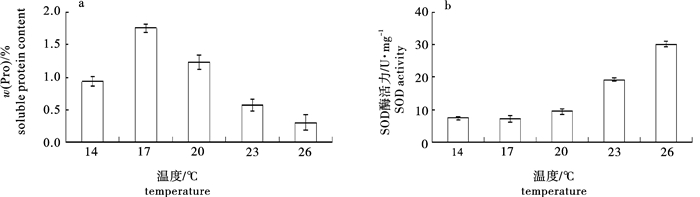
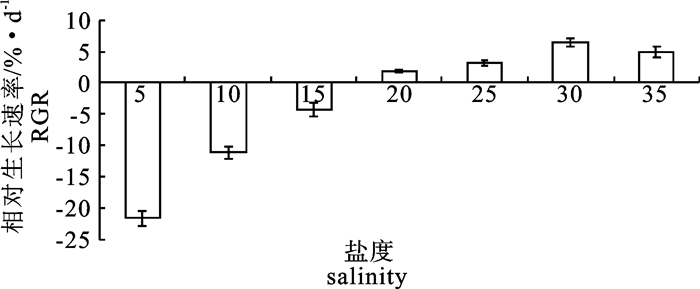
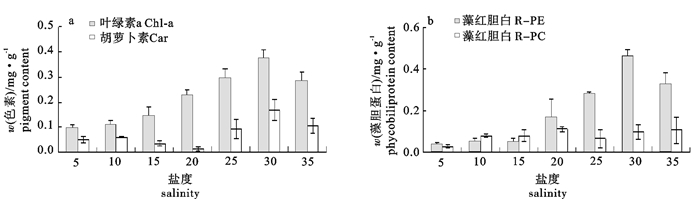
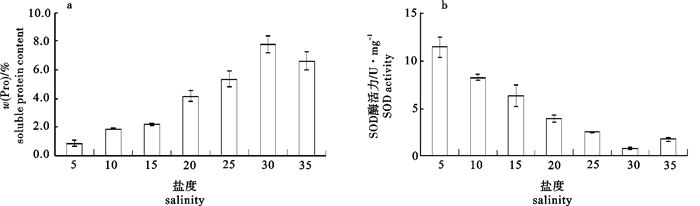
在不同温度(14 ℃、17 ℃、20 ℃、23 ℃和26 ℃)和不同盐度(5、10、15、20、25、30和35)条件下培养脆江蓠(Gracilaria chouae),观察测定其生长及藻体生化组分的变化。试验结果显示,脆江蓠生长的适宜温度为14~26 ℃,最适温度为17~20 ℃,在此温度条件下藻体可以保持最快相对生长速率(relative growth rate,RGR);温度高于20 ℃时脆江蓠的生长受到抑制。在生长状态、光合色素和抗氧化等方面,脆江蓠对低温的耐受能力要比高温强。脆江蓠生长的适宜盐度为20~35,最适盐度为30,在此盐度条件下藻体可以保持最快RGR,盐度低于20时脆江蓠的生长受到抑制。高盐度培养条件下脆江蓠在生长状态、光合色素和抗氧化等方面强于低盐度培养条件。
Abstract:We study the effects of different temperature (14 ℃, 17 ℃, 20 ℃, 23 ℃, 26 ℃) and salinity (5, 10, 15, 20, 25, 30, 35) on the growth and biochemical constituents of Gracilaria chouae. Results indicate that the appropriate temperature for its growth is 14~26 ℃ and optimum is 17~20 ℃. Under 17~20 ℃, G.chouae obtains maximal relative growth rate. But when the temperature is higher than 20 ℃, the growth of G.chouae is inhibited. In addition, its tolerance to low temperature is better than that of high temperature in terms of growth performance, photosynthetic pigments and antioxidant enzymes. The appropriate salinity for its growth is 20~35 and optimum is 30. Under the salinity of 30, G.chouae obtains maximal relative growth rate. Its growth is inhibited when salinity is below 20. G.chouae treated with high salinity has better growth performance, photosynthetic pigment and antioxidant enzymes than that with low salinity.
-
Keywords:
- Gracilaria chouae /
- temperature /
- salinity /
- growth /
- biochemical constituents
-
潮间带作为海陆交汇的关键区域,是最敏感的生态系统之一,其生物多样性和生态环境复杂多变,受自然与人为因素共同影响[1-2]。大型底栖动物是潮间带重要生物类群之一,其分布与变化直接反映潮间带的生态状况[3-5]。大型底栖动物种类丰富,活动范围有限且对环境变化敏感,作为生态系统中的关键消费者,它们在物质循环、能量流动和环境污染监测方面发挥着重要作用,是评估生态系统健康和底栖环境质量的理想指示生物[6-7]。研究潮间带大型底栖动物的种类组成及其生物多样性,对评估潮间带环境变化态势,解析潮间带生态系统的内在规律具有重要意义。
防城港市坐落于广西壮族自治区南部,地处中国大陆海岸线最西南端,南濒北部湾。江山半岛作为广西最大的半岛,位于防城港市西湾与珍珠湾之间,具有独特的沿海沿边优势。随着江山半岛区域经济发展一体化,人口迅速增加,人类活动明显增大,亟需评估其对潮间带生物多样性和生态系统的影响。李永强[8]报道了北部湾 (广西段) 潮间带大型底栖动物现状;许铭本等[9]指出邻近江山半岛的北仑河口北岸潮间带2/3的断面环境质量为中度污染,其大型底栖动物群落受到中等程度扰动;赖廷和等[10]通过评估大型底栖动物的多样性水平,指出防城港河口湾潮间带生态系统整体处于中度扰动状态;汪玮[11]研究了广西北部湾潮间带大型底栖动物与环境因子的关系。然而,对于江山半岛的大型底栖动物的研究却鲜有报道。因此,本研究聚焦于北部湾防城港江山半岛潮间带,旨在通过对不同季节不同潮间带断面大型底栖动物的研究,查明江山半岛潮间带大型底栖动物的多样性现状,揭示其受扰动水平,并评估其生态质量状态,以期为江山半岛潮间带生态保护提供科学依据。
1. 材料与方法
1.1 研究区域
本研究区域位于广西壮族自治区防城港市江山半岛 (图1),其中,白龙尾潮间带断面 (108°12'57.67''E、21°29'52.89''N) 位于江山半岛最南部,底质类型为多砾石的沙滩,周围分布有养殖池塘和厂棚,附近为著名的怪石滩,每年吸引众多游客前来露营和摄影等,人类活动相对较为频繁;白浪滩潮间带断面 (108°17'52.45''E、21°32'19.96''N) 位于江山半岛潮间带中部,底质类型为砂质沙滩,是滨海旅游休闲景区之一,游客活动相对较为频繁。
1.2 取样方法
本研究分别于2023年11月 (秋季) 和2024年4月 (春季) 在北部湾防城港江山半岛潮间带设置了2个断面,即白龙尾潮间带断面 (T1) 和白浪滩潮间带断面 (T2);各断面依据潮汐区带分布,于高潮区设2个站位 (H1—H2),中潮区设4个站位 (M1—M4),低潮区设2个站位 (L1—L2),并于退大潮时段,开展大型底栖动物样品采集。采用25 cm×25 cm×30 cm规格的定量样方框,每站位随机采集4个样方。采样时,首先收集样框内地表底栖动物,随后挖掘至30 cm,通过0.5 mm孔径筛网筛选大型底栖动物。所得样品即时以5%中性甲醛溶液固定,带回实验室,使用体视显微镜 (尼康SMZ25) 进行种类鉴定,使用电子天平称质量 (0.001 g)。每个站位4个样方数据汇总后进行计算分析。样品采样与处理参照GB 12763.6—2007《海洋调查规范》第六部分——海洋生物调查执行。
1.3 生物多样性指数
生物多样性指数采用Shannon-Wiener多样性指数 (H')、Margalef种类丰富度指数 (D) 以及Pielou种类均匀度指数 (J') 进行计算,公式分别为:
$$ {H}{\text{'}}{\mathrm{=}}{\text{−}}{\sum} _{i=1}^{S}{P}_{i}{\mathrm{l}\mathrm{o}\mathrm{g}}_{2}{P}_{i} $$ (1) $$ D\mathrm{=}(S-1)/\mathrm{l}\mathrm{o}\mathrm{g}_2N $$ (2) $$ {J}{\text{'}}{\mathrm{=}}{H}{\text{'}}/{\mathrm{l}\mathrm{o}\mathrm{g}}_{2}S $$ (3) 式中:Pi为第$i$个物种的个体数占所有物种个体总数比例;N为所有物种总个体数;S为样本中物种数目。
1.4 相对重要性指数 (Index of Relative Importance, IRI)
采用IRI计算大型底栖动物相对重要性,当某一物种的IRI>1 000时,则判定该物种为优势种,IRI的计算公式为:
$$ {\mathrm{IRI}}{\mathrm{=}}(N{\mathrm{+}}W)\times F $$ (4) 式中:N为该物种个体数占所有物种个体总数的百分比;W为该物种的质量占所有物种个体总质量的百分比;F为该物种出现的站位数量占所有调查站位数百分比。
1.5 海洋生物指数 (AZTI Marine Biotic Index, AMBI) 和多变量海洋生物指数 (M-AMBI)
AMBI是基于群落中对环境压力耐受性不同的大型底栖动物物种及其相对比例计算得到[12]。参照AMBI软件2024年10月更新的物种名录,根据大型底栖动物对污染的耐受性可以将其划分为5个生态组,即敏感种 (EGI)、不敏感种 (EGII)、耐受种 (EGIII)、二阶机会种 (EGIV) 和一阶机会种 (EGV)。其中,EGI组对污染高度敏感,EGV组对污染高度耐受。AMBI值的范围为0~7,数值越高,表明群落受到的扰动越严重,生态质量健康状况越差。根据AMBI阈值可以将其分为5个等级 (表1)。AMBI的计算公式为:
表 1 不同生态质量等级的海洋生物指数和多变量海洋生物指数阈值Table 1 AMBI and M-AMBI thresholds for different ecological quality levels海洋生物指数阈值
AMBI threshold扰动等级
Disturbance level多变量海洋生物指数阈值
M-AMBI threshold生态质量状况
Ecological quality status0.0<AMBI≤1.2 未扰动Undisturbed 0.77<M-AMBI≤1.00 优 Excellent 1.2<AMBI≤3.3 轻度扰动Slightly disturbed 0.53<M-AMBI≤0.77 良 Good 3.0<AMBI≤5.0 中度扰动Moderately disturbed 0.38<M-AMBI≤0.53 一般 Fair 5.0<AMBI≤6.0 重度扰动Heavily disturbed 0.20<M-AMBI≤0.38 差 Poor 6.0<AMBI≤7.0 极度扰动Extremely disturbed 0<M-AMBI≤0.20 劣 Bad $$ \mathrm{A}\mathrm{M}\mathrm{B}\mathrm{I}{\mathrm{=}}0\times \mathrm{E}\mathrm{G}\mathrm{I}{\mathrm{+}}1.5\times \mathrm{E}\mathrm{G}\mathrm{I}\mathrm{I}{\mathrm{+}}3\times \mathrm{E}\mathrm{G}\mathrm{I}\mathrm{I}\mathrm{I}{\mathrm{+}}4.5\times \mathrm{E}\mathrm{G}\mathrm{I}\mathrm{V}{\mathrm{+}}6\times \mathrm{E}\mathrm{G}\mathrm{V} $$ (5) 式中:EGI—EGV分别为敏感种、不敏感种、耐受种、二阶机会种和一阶机会种在群落中的百分比。
M-AMBI是在AMBI的基础上融合了生物多样性指数和丰富度指数得到,其值范围为0~1,数值越高,表明生态质量越好[13]。根据M-AMBI可以将底栖生境质量分为5个不同的等级 (表1)。
1.6 统计分析
大型底栖动物多样性指数使用R v4.3.2中的“vegan”包中的diversity() 函数进行计算;IRI使用Excel 2021软件通过公式进行计算;AMBI和M-AMBI使用AMBI v6.0软件进行计算;单因素方差分析 (One-way ANOVA) 使用R v4.3.2中anova() 函数进行分析;采样地图采用ArcMap 10.8软件进行绘制。使用Origin 2022软件绘图。
2. 结果
2.1 大型底栖动物群落组成
春、秋季江山半岛潮间带共鉴定大型底栖动物87种。其中软体动物最多 (41种,47.13%),其次为环节动物 (21种,24.14%) 和节肢动物 (19种,21.84%),其他类群动物较少 (6种,6.90%)。春季共鉴定大型底栖动物39种,以软体动物最多 (20种),其次为环节动物 (11种) 和节肢动物 (7种),其他类群动物较少 (1种);秋季共鉴定大型底栖动物66种,同样以软体动物最多 (28种),其次为节肢动物 (17种) 和环节动物 (15种),其他类群动物较少 (6种)。T1断面春、秋季调查共鉴定出大型底栖动物54种,其中软体动物21种,环节动物11种,节肢动物16种,其他类群动物6种。T2断面共鉴定出大型底栖动物51种,其中软体动物24种,环节动物17种,节肢动物9种,其他类群动物1种。各季节和各断面大型底栖动物种类组成及其占比如图2所示。
2.2 栖息密度与生物量
T1断面春季大型底栖动物的栖息密度介于0~84 个·m−2,生物量介于0~417.10 g·m−2;秋季的栖息密度介于80~320 个·m−2,生物量介于9.90~519.71 g·m−2。其中,春、秋季大型底栖动物的平均栖息密度均以低潮区为最高,生物量均以中潮区为最高,且春季各潮带的平均栖息密度和平均生物量均低于秋季。T2断面春季大型底栖动物的栖息密度介于36~336 个·m−2,生物量介于36.95~318.19 g·m−2;秋季的栖息密度介于48~368个·m−2,生物量介于13.10~113.81 g·m−2。其中,春、秋季大型底栖动物的平均栖息密度均以低潮区为最高,春季生物量以低潮区为最高,秋季生物量则以中潮区为最高,高潮区平均生物量在春、秋季均低于其他潮区。春、秋季2个潮间带各站位的大型底栖动物栖息密度和生物量如表2所示。ANOVA显示春、秋季2个潮间带断面大型底栖动物栖息密度和生物量均无显著性差异 (p>0.05)。
表 2 春、秋季江山半岛潮间带大型底栖动物栖息密度与生物量Table 2 Abundance and biomass of macrobenthos at each station in intertidal zone of Jiangshan Peninsula in spring and autumn站位
Station春季 Spring 秋季 Autumn T1断面
Transect T1T2断面
Transect T2T1断面
Transect T1T2断面
Transect T2密度
Abundance/
(个·m−2)生物量
Biomass/
(g·m−2)密度
Abundance/
(个·m−2)生物量
Biomass/
(g·m−2)密度
Abundance/
(个·m−2)生物量
Biomass/
(g·m−2)密度
Abundance/
(个·m−2)生物量
Biomass/
(g·m−2)L1 40 24.35 96 40.44 80 33.04 96 13.10 L2 52 3.31 48 40.53 136 18.10 112 23.25 M1 28 417.10 36 36.95 220 246.01 104 113.81 M2 16 3.86 84 90.88 176 519.71 200 53.00 M3 12 6.27 72 95.17 116 9.90 48 112.05 M4 0 0 76 39.06 320 481.70 72 59.97 H1 84 26.87 36 53.20 264 66.95 368 87.57 H2 40 12.24 336 318.19 240 65.06 80 49.89 均值±标准差
Mean±SD34±25 61.75±134.63 98±92 89.3±89.28 194±76 180.06±197.96 135±98 64.08±35.24 2.3 大型底栖动物多样性
春季江山半岛潮间带大型底栖动物的H'介于0.46~2.92,均值为1.82±0.74;D介于0.46~2.11,均值为1.20±0.49;J'介于0.23~1.00,均值为0.78±0.23。秋季江山半岛潮间带大型底栖动物的H'、D和J'分别介于1.51~3.63、0.73~2.73和0.51~0.95,均值分别为2.76±0.59、1.95±0.65和0.79±0.11。各站位大型底栖动物多样性如表3所示。ANOVA结果显示,T1断面春、秋季大型底栖动物的H'、D和J' 均无显著性差异 (p>0.05);T2断面春季大型底栖动物的H' 和D均显著低于秋季 (p<0.05),而J' 在2个季节则无显著性差异 (p>0.05)。
表 3 春、秋季江山半岛潮间带各站位大型底栖动物多样性指数Table 3 Diversity indexes of macrobenthos at each station in intertidal zone of Jiangshan Peninsula in spring and autumn断面
Transect站位
Station春季 Spring 秋季 Autumn H' D J' H' D J' T1 L1 2.92 2.11 0.97 2.55 1.65 0.81 L2 2.65 1.89 0.88 2.95 2.06 0.77 M1 2.24 1.42 0.96 2.95 2.65 0.72 M2 1.50 1.00 0.95 3.06 2.54 0.77 M3 1.58 1.26 1.00 1.87 2.08 0.51 M4 — — — 2.13 0.73 0.92 H1 1.41 0.91 0.61 2.14 1.16 0.83 H2 0.92 0.60 0.58 1.51 0.79 0.65 均值±标准差
Mean±SD1.89±0.67 1.31±0.50 0.85±0.16 2.40±0.53 1.71±0.70 0.75±0.12 T2 L1 1.89 1.09 0.73 3.10 2.18 0.81 L2 1.55 0.84 0.78 3.37 2.50 0.88 M1 2.42 1.58 0.94 3.63 2.55 0.93 M2 0.55 0.46 0.35 3.28 2.48 0.77 M3 2.33 1.20 0.9 2.61 1.12 0.87 M4 2.69 1.88 0.85 3.03 2.16 0.95 H1 2.20 1.26 0.95 2.55 1.84 0.65 H2 0.46 0.47 0.23 3.46 2.73 0.86 Mean±SD 1.76±0.79 1.10±0.47 0.72±0.26 3.13±0.36 2.20±0.48 0.84±0.09 注:—. 未采集到底栖动物。 Note: —. No macrobenthos was collected. 2.4 优势种
IRI结果表明春季江山半岛潮间带断面IRI>1 000的大型底栖动物优势种共有4种;其中T1断面的优势种为疣滩栖螺 (Batillaria sordida) 和粒花冠小月螺 (Lunella coronata);T2断面的优势种为韦氏毛带蟹 (Dotilla wichmanni) 和斧文蛤 (Meretrix lamarckii)。秋季大型底栖动物优势种共有3种,其中T1断面的优势种有2种,分别为日本和美虾 (Nihonotrypaea japonica) 和扁平蛛网海胆 (Arachnoides placenta);T2断面的优势种仅有1种即文蛤 (Meretrix meretrix)。
2.5 生态质量
春、秋季江山半岛潮间带各站位大型底栖动生物生态功能组的组成如图3所示。春季T1断面大型底栖动物总体以不敏感种为主,平均占比 (40.76±26.61)%,其次为敏感种,平均占比(38.16±25.98)%,耐受种占比较少,未发现二阶机会种和一阶机会种。T2断面各站位大型底栖动物以不敏感种占绝对优势,平均占比 (75.85±18.77)%,其次为敏感种,平均占比 (22.38±17.55)%,耐受种仅出现在1个站位,未发现二阶机会种和一阶机会种。
![]() 图 3 春、秋季江山半岛潮间带各站位大型底栖动物生态组占比注:a. 春季白龙尾潮间带物种生态组百分比;b. 春季白浪滩潮间带物种生态组百分比;c. 秋季白龙尾潮间带物种生态组百分比;d. 秋季白浪滩潮间带物种生态组百分比。Fig. 3 Proportion of ecological groups of macrobenthos at each station in intertidal zone of Jiangshan Peninsula in spring and autumnNote: a. Proportion of species groups in the intertidal zone of Bailongwei in spring; b. Proportion of species groups in the intertidal zone of Bailagntan in spring; c. Proportion of species groups in the intertidal zone of Bailongwei in autumn; d. Proportion of species groups in the intertidal zone of Bailagntan in autumn.
图 3 春、秋季江山半岛潮间带各站位大型底栖动物生态组占比注:a. 春季白龙尾潮间带物种生态组百分比;b. 春季白浪滩潮间带物种生态组百分比;c. 秋季白龙尾潮间带物种生态组百分比;d. 秋季白浪滩潮间带物种生态组百分比。Fig. 3 Proportion of ecological groups of macrobenthos at each station in intertidal zone of Jiangshan Peninsula in spring and autumnNote: a. Proportion of species groups in the intertidal zone of Bailongwei in spring; b. Proportion of species groups in the intertidal zone of Bailagntan in spring; c. Proportion of species groups in the intertidal zone of Bailongwei in autumn; d. Proportion of species groups in the intertidal zone of Bailagntan in autumn.秋季T1断面大型底栖动物生态功能组总体以不敏感种、敏感种和耐受种为主,平均占比分别为(34.05±31.12)%、(32.34±30.43)%和 (32.09±26.11)%;一阶机会种 [小头虫 (Capitella sp.)] 平均占比较小[(1.52±2.20)%],未发现二阶机会种;T2断面大型底栖动物主要以不敏感种和敏感种为主,平均占比分别为 (46.71±13.45)%和 (40.71±17.95)%,耐受种平均占比为 (12.56±10.71)%,未发现二阶机会种和一阶机会种。
基于AMBI的春、秋季江山半岛潮间带各站位受扰动状况评估结果如图4所示。春季T1断面各站位的AMBI介于0.5~2.25,均值为1.24±0.59。根据其评价阈值标准,L1、M1和M3等3个站位处于“未扰动”状态,L2、M2、H1和H2等4个站位均处于受到“轻度扰动”状态。T2断面各站位AMBI介于0.56~1.46,均值为1.19±0.26。其中M1与M3站位处于“未扰动”的理想状态,其他6个站位则处于“轻度扰动”状态。T1断面AMBI的均值略高于T2断面,表明其受到的扰动相对较高,但ANOVA结果显示二者无显著性差异 (p=0.84)。就不同潮区而言,春季江山半岛AMBI均值:高潮区 (1.37±0.11) >低潮区 (1.22±0.41) >中潮区 (1.12±0.55)。
![]() 图 4 春、秋季江山半岛潮间带各站位AMBI指数注:a. 春季白龙尾潮间带AMBI;b. 春季白浪滩潮间带AMBI;c. 秋季白龙尾潮间带AMBI;d. 秋季白浪滩潮间带AMBI。Fig. 4 AMBI index of each station in intertidal zone of Jiangshan Peninsula in spring and autumnNote: a. AMBI in the intertidal zone of Bailongwei in spring; b. AMBI in the intertidal zone of Bailagntan in spring; c. AMBI in the intertidal zone of Bailongwei in autumn; d. AMBI in the intertidal zone of Bailagntan in autumn.
图 4 春、秋季江山半岛潮间带各站位AMBI指数注:a. 春季白龙尾潮间带AMBI;b. 春季白浪滩潮间带AMBI;c. 秋季白龙尾潮间带AMBI;d. 秋季白浪滩潮间带AMBI。Fig. 4 AMBI index of each station in intertidal zone of Jiangshan Peninsula in spring and autumnNote: a. AMBI in the intertidal zone of Bailongwei in spring; b. AMBI in the intertidal zone of Bailagntan in spring; c. AMBI in the intertidal zone of Bailongwei in autumn; d. AMBI in the intertidal zone of Bailagntan in autumn.秋季T1断面各站位的AMBI介于0.34~2.55,均值为1.57±0.77。根据其评价阈值标准,L2和M3站位(25%) 处于“未扰动”状态,其他6个站位 (75%) 均处于“轻度扰动”状态。T2断面的AMBI介于0.54~1.76,均值为1.08±0.39,表明整体生态系统处于较为稳定的状态,其中L1和H2站位被判定为“轻度扰动”状态,其他6个站位则处于“未扰动”的理想状态。与春季类似,秋季T1断面AMBI均值高于T2断面,表明其受到的扰动相对较高,但ANOVA结果显示二者无显著性差异 (p=0.16)。就不同潮区而言,秋季江山半岛AMBI均值:高潮区 (1.41±0.38) >中潮区 (1.35±0.79) >低潮区 (1.18±0.55)。
春、秋季江山半岛潮间带各站位M-AMBI评估结果如图5所示。T1断面各站位的M-AMBI介于0.46~0.91,均值为0.65±0.15。其中M2与H2站位的底栖生态质量处于“一般”的状态,L2和L1站位处于“优”的状态,其他3个站位的底栖生态质量均处于“良”的状态。T2断面的M-AMBI介于0.46~0.87,均值为0.68±0.14。其中,M1、M3和M4站位的底栖生态质量处于“优”的状态,L1、L2和G1站位处于“良”的状态,其他2个站位的生态质量处于“一般”的状态。T2断面M-AMBI均值略高于T1断面,表明前者生态质量相对较高,但ANOVA结果显示二者无显著性差异 (p=0.71)。就不同潮区而言,春季江山半岛M-AMBI均值:高潮区 (0.57±0.10) <中潮区 (0.67±0.15) <低潮区 (0.76±0.11)。
![]() 图 5 春、秋季江山半岛潮间带各站位M-AMBI指数注:a. 春季白龙尾潮间带M-AMBI;b. 春季白浪滩潮间带M-AMBI;c. 秋季白龙尾潮间带M-AMBI;d. 秋季白浪滩潮间带M-AMBI。Fig. 5 M-AMBI indices of each station in the intertidal zone of Jiangshan Peninsula in spring and autumn.Note: a. M-AMBI in the intertidal zone of Bailongwei in spring; b. M-AMBI in the intertidal zone of Bailagntan in spring; c. M-AMBI in the intertidal zone of Bailongwei in autumn; d. M-AMBI in the intertidal zone of Bailagntan in autumn.
图 5 春、秋季江山半岛潮间带各站位M-AMBI指数注:a. 春季白龙尾潮间带M-AMBI;b. 春季白浪滩潮间带M-AMBI;c. 秋季白龙尾潮间带M-AMBI;d. 秋季白浪滩潮间带M-AMBI。Fig. 5 M-AMBI indices of each station in the intertidal zone of Jiangshan Peninsula in spring and autumn.Note: a. M-AMBI in the intertidal zone of Bailongwei in spring; b. M-AMBI in the intertidal zone of Bailagntan in spring; c. M-AMBI in the intertidal zone of Bailongwei in autumn; d. M-AMBI in the intertidal zone of Bailagntan in autumn.秋季T1断面各站位的M-AMBI介于0.51~0.88,均值为0.68±0.12。根据评价结果,H2站位处于“一般”的状态,L2和M2站位处于“优”的状态,其他5个站位均处于“良”的状态。T2断面各站位的M-AMBI介于0.54~0.84,均值为0.75±0.09。根据评价结果,L2、M1、M2和H2站位处于“优”的状态,而其他4个站位则处于“良”的状态。与春季类似,秋季T2断面M-AMBI均值高于T1断面,表明前者生态质量相对较高,但ANOVA结果显示二者无显著性差异 (p=0.23)。就不同潮区而言,秋季江山半岛M-AMBI均值:高潮区(0.67±0.13) <中潮区 (0.72±0.10) <低潮区 (0.75±0.09)。
3. 讨论
3.1 大型底栖动物种类组成及多样性
本研究共鉴定出大型底栖动物87种,其中春季39种,秋季66种;软体动物占比最多,其次为环节动物和节肢动物。这与环北部湾其他邻近潮间带的调查结果一致,如北仑河口北岸的竹山半岛,在秋季3个潮间带断面共记录大型底栖动物63种,其中以软体动物最多[9];防城河河口的老鼠墩和白浪滩潮间带断面4个季度分别共鉴定出大型底栖动物48和108种,其中也均以软体动物种类占比最高[10];北海冯家江入海口夏季5个潮间带断面共鉴定出大型底栖动物31种,亦以软体动物居多[14]。这可能与研究区域、断面数量和采样频次以及底质类型等有关[15-16],软体动物尤其是双壳类多偏好栖息于含沙量相对较高的区域,这与上述潮间带多为沙质底质的结果一致。
北部湾江山半岛潮间带大型底栖动物春、秋季平均栖息密度 (119 个·m−2) 和平均生物量 (101.98 g·m−2)略低于环北部湾其他区域,如北仑河口[9]、防城港河口[10]以及冯家江河口[14]潮间带,这主要与该区域春季调查的潮间带大型底栖动物栖息密度和生物量相对较低有关。若仅就秋季而言,江山半岛潮间带大型底栖动物平均栖息密度和平均生物量则处于环北部湾潮间带中等水平。在生物多样性方面,江山半岛潮间带大型底栖动物春季明显低于秋季,这主要与春季采集到的大型底栖动物物种数量较少和丰度较低有关。与环北部湾周边区域相比,秋季江山半岛潮间带大型底栖动物生物多样性指数 (2.76±0.59) 则明显高于其他潮间带,如北仑河口北岸潮间带 (2.27±0.67) 和北海市冯家江入海口潮间带 (2.52±0.42),同时也高于钦州湾 (1.80) 和北部湾北部海域等潮下带区域[17-18]。
3.2 底栖生态质量状况评价
群落中大型底栖动物敏感物种比例常被用作环境质量的评估指标,较高的敏感物种比例通常表明环境条件良好[19-20];而随着环境质量的恶化,如有机质富集或富营养化加剧,群落中的耐受种则会慢慢增多,逐渐取代原本占据主导地位的敏感种,成为群落中新的优势种[21-23]。在本研究中,春、秋季T1和T2断面大型底栖动物均以敏感种和不敏感种为主,耐受种和机会种占比较小,并且其优势种 (如斧文蛤、文蛤和扁平蛛网海胆等) 也多属于敏感种或不敏感种,反映出江山半岛潮间带受到的扰动较轻,底栖生态质量整体处于较好水平。
为了更准确和直观评估江山半岛潮间带大型底栖动物群落受到的扰动水平及其底栖生态质量,本研究应用AMBI和M-AMBI对其进行评估。AMBI的评估结果显示,春、秋季江山半岛潮间带未受到扰动和受到轻微扰动的站位占比分别为41.94%和58.06%;未发现受到中等及以上扰动的站位,表明研究区域整体受到的外界扰动或压力较小,生态质量处于良好水平。而就不同区域而言,白浪滩潮间带的生态质量优于白龙尾潮间带,这可能与白龙尾潮间带受到的外源扰动压力较大有关,外源压力越高 (如人类活动或环境污染),生境受到的扰动就越严重,生态质量就越差[24-26]。M-AMBI的评估结果显示,江山半岛春、秋季潮间带生态质量处于“优”、“良”和“一般”的站位占比分别为35.48%、48.39%和16.13%,表明江山半岛潮间带生态质量出现了一定程度的退化,但整体仍处于相对较好的水平。对于部分站位而言,M-AMBI的评估结果与AMBI呈现一定差异,评估的生态等级略低,这主要是因为M-AMBI是在AMBI的基础上,进一步整合了生物多样性指数和丰富度指数所得,其对生态质量的评价更严格,且相对于AMBI更不易受群落单一物种丰度偏高的影响[27-29]。
与AMBI的评估结果类似,M-AMBI同样也显示T2断面的生态质量优于T1,暗示白龙尾整体受到的外部扰动或环境压力要大于白浪滩。笔者认为,这主要与白龙尾潮间带的生境特征、周边环境以及人为干扰有关。白龙尾潮间带沙滩多有砾石分布,砾石的存在挤占了一些营埋栖生活的大型底栖动物的生存空间,可能会导致部分物种减少。本研究中在该区域的1个站位未采集到大型底栖动物也反映了这一情况。白龙尾周边还存在一些养殖池塘和厂棚,养殖尾水的排放也可能会对白龙尾潮间带大型底栖动物产生一定的影响[30-31]。此外,白龙尾潮间带采样区域附近是著名景点怪石滩及摄影基地,每年吸引大量游客,特别是自驾游客,区域内的人为扰动程度较高;较高的人类活动如高强度踩踏和对底栖生物的挖掘等会造成大量底栖生物死亡,生物多样性降低,进而导致生态质量健康下降[32-33]。这可能也是导致白龙尾潮间带生态质量退化的原因之一。相对而言,白浪滩是砂质沙滩,沙滩较为平坦,周边几乎没有养殖池塘及工厂等,但是随着江山半岛旅游度假区的开发建设,游客数量也呈逐年增加趋势。尽管其生态质量稍优于白龙尾潮间带,但是AMBI和M-AMBI评估结果也表明,其大型底栖动物群落已经受到了一定的扰动,部分站位的生态质量有所退化,尤其是春季。因此,有必要强化对人类活动干扰的管控,增加对海滩的保护力度,从而提升海滩整体的生态质量与健康水平。
4. 结论
北部湾防城港江山半岛潮间带大型底栖动物种类丰富,生物多样性较高,并且存在空间和季节上的差异,总体表现出白浪滩断面高于白龙尾断面,秋季资源量高于春季。AMBI和M-AMBI显示江山半岛潮间带大型底栖动物群落处于“轻度扰动”或“未扰动”的状态,个别站位扰动程度相对较高,但底栖生态质量总体处于良好水平。白龙尾潮间带的整体生态质量略低于白浪滩潮间带,可能与其环境条件以及受到的人为干扰相对较高有关。本研究为江山半岛潮间带生态系统保护和管理提供了科学依据,并且强调了可以针对不同断面特性实施差异化保护策略。
-
-
[1] 夏邦美. 中国海藻志, 红藻门, 伊谷藻目, 杉藻目, 红皮藻目[M]. 北京: 科学出版社, 1999: 41-42. https://www.las.ac.cn/front/book/detail?id=858e92c72c7924a092fccd1059a0632e XIA Bangmei. Flora Algarum Marinarum Sinicarum, Rhodophyta, Ahnfeltiales Gigartinales Rhodymeniales[M]. Beijing: Science Press, 1999: 41-42. (in Chinese) https://www.las.ac.cn/front/book/detail?id=858e92c72c7924a092fccd1059a0632e
[2] 阎希柱, 王桂忠, 李少菁, 等. 九孔鲍摄食江蓠与人工配合饵料的能量收支比较[J]. 应用与环境生物学报, 2004, 10(6): 757-761. doi: 10.3321/j.issn:1006-687X.2004.06.017 YAN Xizhu, WANG Guizhong, LI Shaojing, et al. Energy budgets of Haliotis diverscicoloraquatilis fed by Gracilariaceae licheniodes and formula feed[J]. Chin J Appl Environ Biol, 2004, 10(6): 757-761. (in Chinese) doi: 10.3321/j.issn:1006-687X.2004.06.017
[3] 潘江球, 李思东. 江蓠的资源开发利用新进展[J]. 热带农业科学, 2010, 30(10): 47-50. doi: 10.3969/j.issn.1009-2196.2010.10.013 PAN Jiangqiu, LI Sidong. Development and utilization of Gracilaria resources[J]. Chin J Trop Agric, 2010, 30(10): 47-50. (in Chinese) doi: 10.3969/j.issn.1009-2196.2010.10.013
[4] 郑怡, 余萍, 刘艳如. 脆江蓠凝集素的部分性质及细胞凝集作用[J]. 应用与环境生物学报, 2002, 8 (1) : 60-70. doi: 10.3321/j.issn:1006-687X.2002.01.013 ZHENG Yi, YU Ping, LIU Yanru. Partial properties and cell agglutination of Gracilaria bursapastoris lectin[J]. Chin J Appl Environ Biol, 2002, 8(1) : 60-70. (in Chinese) doi: 10.3321/j.issn:1006-687X.2002.01.013
[5] WELLBURN A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Plant Physiol, 1994, 144(3): 307-313. doi: 10.1016/S0176-1617(11)81192-2
[6] BEER S, ESHEL A. Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae[J]. Aust J Mar Freshwater Res, 1985, 36(6): 785-792. doi: 10.1071/MF9850785
[7] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2002: 158-160. https://xueshu.baidu.com/usercenter/paper/show?paperid=92ec178b12926c288ea041739ab329dc ZHANG Zhiliang, JU Weijing. Experimental instruction of plant physiology[M]. Beijing: Higher Education Press, 2002: 158-160. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=92ec178b12926c288ea041739ab329dc
[8] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 184-185. https://xueshu.baidu.com/usercenter/paper/show?paperid=9451ba3beb65814b9b02a7667177c1b5 LI Hesheng. Principles and techniques of plant physiology biochemical experiment[M]. Beijing: Higher Education Press, 2000: 184-185. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=9451ba3beb65814b9b02a7667177c1b5
[9] 波钦诺克. 植物生物化学分析方法[M]. 北京: 科学出版社, 1981: 23-27. https://www.shukui.net/book/2160935.html ПОЧИНОК Ф Н. Plant biochemistry analysis method[M]. Beijing: Science Press, 1981: 23-27. (in Chinese) https://www.shukui.net/book/2160935.html
[10] 刘树霞, 徐军田, 蒋栋成. 温度对经济红藻龙须菜生长及光合作用的影响[J]. 安徽农业科学, 2009, 37 (33): 16322-16324. doi: 10.13989/j.cnki.0517-6611.2009.33.154 LIU Shuxia, XU Juntian, JIANG Dongcheng. The effects of temperature on the growth and photosynthesis of economic red macroalga Gracilaria lemaneiformis[J]. J Anhui Agric Sci, 2009, 37(33): 16322-16324. (in Chinese) doi: 10.13989/j.cnki.0517-6611.2009.33.154
[11] 刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响[J]. 中国海洋大学学报: 自然科学版, 2001, 31 (3): 332-338. doi: 10.3969/j.issn.1672-5174.2001.03.022 LIU Jingwen, DONG Shuanglin. Interactions between light and temperature on the growth and levels of chemical constituents of Gracilaria tenuistipitata var liui Zhang et Xia[J]. Periodic Ocean Univ China: Natural Science, 2001, 31 (3): 332-338. (in Chinese) doi: 10.3969/j.issn.1672-5174.2001.03.022
[12] HANISAK M D. Growth patterns of Codium fragile spp. Tomentosoides in response to temperature, irradiance, salinity and nitrogen source[J]. Mar Biol, 1979, 50(4): 319-332. doi: 10.1007/BF00387009
[13] 李伟新, 朱仲嘉, 刘凤贤. 海藻学概论[M]. 上海: 上海科学技术出版社, 1982: 224-225. https://xueshu.baidu.com/usercenter/paper/show?paperid=3c0ab084aada15a0212db544dd9ead88&site=xueshu_se LI Weixin, ZHU Zhongjia, LIU Fengxian. Introduction to seaweed[M]. Shanghai: Shanghai Science and Technology Press, 1982: 224-225. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=3c0ab084aada15a0212db544dd9ead88&site=xueshu_se
[14] 潘瑞炽. 植物生理学[M]. 4版. 北京: 高等教育出版社, 2001: 57-66. https://book.douban.com/subject/10787150/ PAN Ruichi. Plant physiology[M]. 4th edition. Beijing: Higher Education Press, 2001: 57-66. (in Chinese) https://book.douban.com/subject/10787150/
[15] NIYOGI K K. Photo protection revised: genetic and molecular approaches[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50(4): 333-359. doi: 10.1146/annurev.arplant.50.1.333
[16] DUKE C S, LITAKER W, RAMUS J. Effect of temperature, N supply, and tissue N on ammonium up take rates of the Ulva curuata and Codium decorticatum[J]. J Phycol, 1989, 25(1): 113-120. doi: 10.1111/j.0022-3646.1989.00113.x
[17] 韩博平, 韩志国, 付翔. 藻类光合作用机理与模型[M]. 北京: 科学出版社, 2003: 12. https://xueshu.baidu.com/usercenter/paper/show?paperid=581717703cc4de8cdde7ed66d7e89388&site=xueshu_se&hitarticle=1 HAN Boping, HAN Zhiguo, FU Xiang. Algal photosynthesis: mechanisms and models[M]. Beijing: Science Press, 2003: 12. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=581717703cc4de8cdde7ed66d7e89388&site=xueshu_se&hitarticle=1
[18] 温洋, 孙吉雄, 王代军. 干旱胁迫对冷地型草坪草生理特性影响的研究[J]. 草原与草坪, 2005, 10 (1): 43-45. doi: 10.3969/j.issn.1009-5500.2005.01.010 WEN Yang, SUN Jixiong, WANG Daijun. Effects of drought stress on physiological characteristics in cool season turfgrasses[J]. Grassland Turf, 2005, 10(1): 43-45. (in Chinese) doi: 10.3969/j.issn.1009-5500.2005.01.010
[19] FONG P, BOYER K E, DESMOND J S. Salinity stress, nitrogen competition, and facilitation: what controls seasonal succession of two opportunistic green macroalgae[J]. J Exp Mar Biol, 1996, 206(1/2): 203-211. doi: 10.1016/S0022-0981(96)02630-5
[20] DAVISON I R, PEARSON G A. Stress tolerance in intertidal seaweed[J]. J Phycol, 1996, 32(2): 197-211. doi: 10.1111/j.0022-3646.1996.00197.x
[21] 钱鲁闽, 徐永健, 焦念志. 环境因子对龙须菜和菊花心江蓠N、P吸收速率的影响[J]. 中国水产科学, 2006, 13(2): 251-262. doi: 10.3321/j.issn:1005-8737.2006.02.015 QIAN Lumin, XU Yongjian, JIAO Nianzhi. Effects of environmental factors on uptake of nitrogen and phosphorus by Gracilaria lemaneiformis and G. lichevoides[J]. J Fish Sci China, 2006, 13(2): 251-262. (in Chinese) doi: 10.3321/j.issn:1005-8737.2006.02.015
[22] 郑兰红. 冈村枝管藻培养及实验生态学基础研究[D]. 青岛: 中国海洋大学, 2004. https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq5097xk0aZfRGGpTn0qdO8hxlVVurclLalXLST-ke3asA78JeYdus8vUjXbNs_0EnlXyp8jzb7ckvZFXNf6TM28RUM60UjmZ-thyM2ZtRo-iNfpjHsoWjXhi421YwJg0G9TUxPV8aJ3lJM31QC0118Z5sr7tuV3yuc71xX_1zQJUf2kevgyaNLc&uniplatform=NZKPT&language=CHS ZHENG Lanhong. Primary study of culture and environmental factors on the growth of Cladosiphon akamuranus[D]. Qingdao: Ocean University of China, 2004. (in Chinese) https://kns.cnki.net/kcms2/article/abstract?v=MdENDFpkZq5097xk0aZfRGGpTn0qdO8hxlVVurclLalXLST-ke3asA78JeYdus8vUjXbNs_0EnlXyp8jzb7ckvZFXNf6TM28RUM60UjmZ-thyM2ZtRo-iNfpjHsoWjXhi421YwJg0G9TUxPV8aJ3lJM31QC0118Z5sr7tuV3yuc71xX_1zQJUf2kevgyaNLc&uniplatform=NZKPT&language=CHS
[23] 吴超元, 李纫芷, 林光恒, 等. 细基江蓠繁枝变型生长适宜环境条件的研究[J]. 海洋与湖沼, 1994, 25(1): 60-66. doi: 10.3321/j.issn:0029-814X.1994.01.009 WU Chaoyuan, LI Renzhi, LIN Guangheng, et al. Effect of environmental factors on growth of Gracilaria tenuistipitata var liui Zhang et Xia[J]. Oceanologia et Limnologia Sinica, 1994, 25(1): 60-66. (in Chinese) doi: 10.3321/j.issn:0029-814X.1994.01.009
[24] BIRD K T, HABIG C, DEBUSK T. Nitrogen allocation and storage patterns in Gracilaria tikvahiae (RhodoPhyta)[J]. J Phycol, 1982, 18(3): 344-348. doi: 10.1111/j.1529-8817.1982.tb03194.x
[25] 刘长发, 张泽宇, 雷衍之. 盐度、光照和营养盐对孔石莼光合作用的影响[J]. 生态学报, 2001, 21 (5) : 795-798. doi: 10.3321/j.issn:1000-0933.2001.05.016 LIU Changfa, ZHANG Zeyu, LEI Yanzhi. Effects of salinity, light and nutrients on photosynthesis of sterile Ulva pertusa[J]. Acta Ecologica Sinica, 2001, 21 (5): 795-798. (in Chinese) doi: 10.3321/j.issn:1000-0933.2001.05.016
[26] 赵素达, 董树刚, 吴以平, 等. 盐胁迫对孔石莼的生理生化影响[J]. 海洋科学, 2000, 24(7): 52-55. doi: 10.3969/j.issn.1000-3096.2000.07.017 ZHAO Suda, DONG Shugang, WU Yiping, et al. Biochemical and physiological effects of salinity stress on Ulva purtusa[J]. Mar Sci, 2000, 24 (7): 52-55. (in Chinese) doi: 10.3969/j.issn.1000-3096.2000.07.017
-
期刊类型引用(2)
1. 卜弘毅,朱正杰,崔素珍,张明,李成之,许志敏,李典鹏,曹学城,孙天一,雷礼纲. 洪泽湖不同湿地类型表层土壤与沉积物碳氮含量特征分析. 湿地科学与管理. 2025(01): 45-51 .  百度学术
百度学术
2. 贺铮,朱长波,苏家齐. 低盐水体SO_4~(2-)/Cl~-胁迫下凡纳滨对虾生长、肝胰腺与鳃组织结构及酶活力比较. 南方水产科学. 2025(02): 118-126 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
