RAPD analysis of genetic diversity of Scylla paramamosain population in Guangxi and neighboring sea areas
-
摘要:
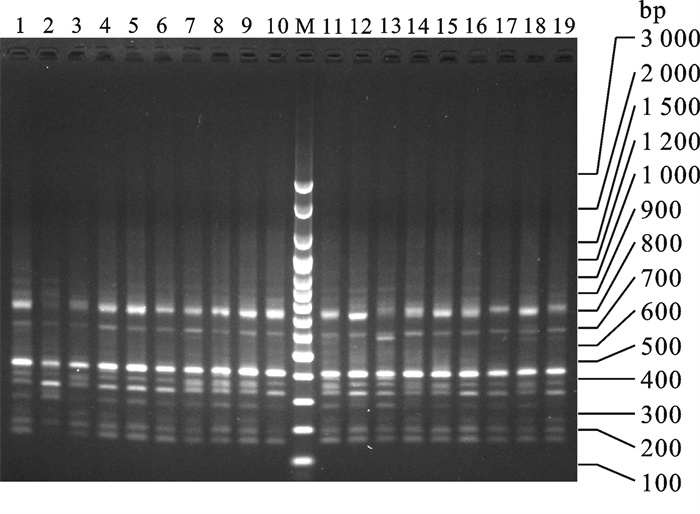
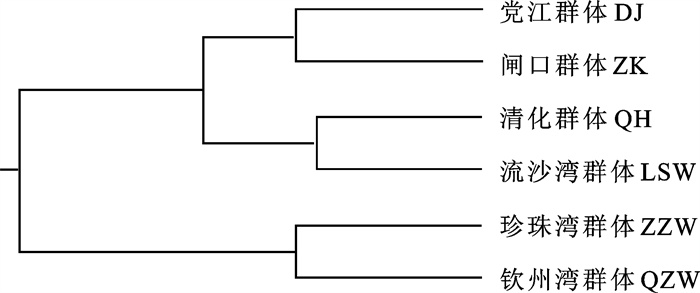
采用随机扩增多态DNA(random amplified polymorphic DNA,RAPD)技术检测广西沿海及其邻近海区拟穴青蟹(Scylla paramamosain)6个地理群体的遗传变异和遗传结构,8条10 bp寡核苷酸随机引物扩增99个个体,分析其中的44个位点,31个位点表现出多态性,在种水平的多态位点百分率为70.45%。POPGENE分析结果显示,6个群体的多态位点百分率为29.55%~54.55%,平均为36.97%;群体的遗传多样性自高至低排列为钦州湾群体>党江群体>珍珠湾群体>闸口群体>清化群体>流沙湾群体;群体内的遗传变异大于群体间的遗传变异,群体间的遗传分化程度较大。AMOVA分析显示,群体内遗传变异占87.03%,群体间遗传变异占12.97%,群体间发生中等程度遗传分化。Mantel检测结果表明,拟穴青蟹6个群体间的遗传距离与地理距离之间的相关性不显著。聚类分析表明,群体间聚类无明显的地域性分布格局。
Abstract:Random amplified polymorphic DNA (RAPD) technology was employed to investigate the genetic diversity and structure of 6 Scylla paramamosain populations in Guangxi and its neighboring sea areas. We amplified a total of 99 individuals by using 8 random primers with 10 bp in length, and analyzed 44 valid loci, among which 31 loci are disclosed as polymorphism. The percentage of polymorphic locus (PPL) at species level is 70.45%. According to POPGENE analysis, the PPL in the 6 populations ranges from 29.55% to 54.55% with an average of 36.97%. The abundance of genetic diversity is QZW>DJ>ZZW>ZK>QH>LSW. Variance within populations is higher than that among populations, and genetic differentiation among populations reaches higher level. An analysis of molecular variance (AMOVA) shows that variance within populations accounts for 87.03%, and that among populations accounts for 12.97%. However, genetic differentiation among populations only reaches medium level. Mantel test shows that no significant correlation between genetic and geographic distance is detected in the 6 S.paramamosain populations. Cluster analysis indicates that the distribution of these populations displays no apparent geographic pattern.
-
Keywords:
- Scylla paramamosain /
- RAPD /
- genetic diversity /
- genetic differentiation
-
梭子蟹Portunus pelagicus肉肥细嫩,味道鲜美,营养丰富,不仅为中国人民所喜爱,还是中国出口创汇的主要水产品之一,因此,梭子蟹一向被中国视为重要的水产资源。它不但蛋白质含量高,8种必需氨基酸齐全,而且必需脂肪酸和维生素A、D含量也极为丰富。梭子蟹在冷冻贮藏中其肌原纤维蛋白质变性而不易溶于盐类,其脂质由于富含EPA和DHA等高度不饱和脂肪酸而易于酸败,双键被氧化生成的过氧化物及其分解产物加快了蛋白质变性和氨基酸劣化,从而使蟹肉发生褐变,口感有涩味和哈味。近年来养殖梭子蟹产量逐年递增,而目前的销售和加工方式难于满足其产量快速增长的要求,因此,梭子蟹的保鲜和加工是水产加工业面临的一个重要问题。
相关研究表明,蛋白质在冻藏过程中的变性与新鲜度、速冻速度、冻藏温度、pH值、脂肪氧化、氧化三甲胺还原产生的二甲胺和甲醛等因素密切相关[1-3]。其中速冻速度是最重要的影响因素,速冻越快和冻藏温度越低,在一定程度上降低了蛋白质变性的速度,鱼肉的肉质、口感和风味明显提高[4-5]。因此,研究蟹类在冻藏过程中生化特性的变化, 寻找合理的冻结方式对生产高质量冻品具有重要意义。
此项研究采用液体浸渍等方法速冻梭子蟹,以肌动球蛋白盐溶性含量、巯基含量和ATPase活性为指标,并结合感观评定和失水率,考察其肌肉蛋白质生化特性的变化规律,以期找到更好的冻结方法,为梭子蟹的速冻加工提供理论与实践依据。
1. 材料与方法
1.1材料及处理
供试材料为鲜活梭子蟹(150±20 g),购自舟山沈家门东河菜场,分4组进行冻结。第1组用-50±2℃液氮喷洒方式速冻;第2组用-50±2℃液体(自制)浸渍方式速冻;第3组用-35±2℃空气隧道方式冻结;第4组用-20±2℃冰柜直接冻结。冻结过程用温度记录仪(浙江大学)记录材料中心的温度变化,比较各冻结方式的冻结速度。冻结之后,用塑料袋包扎,贮藏于-20±2℃冰柜。
1.2 测定项目及方法
盐溶性蛋白的提取参考OKADA等[6]方法,含量的测定采用双缩脲法。ATPase活性的测定参考HATANO方法[7]。巯基含量的测定参考SUVANICH等[1]方法。分别测定冻藏样品(贮藏90 d)取出时和28℃恒温箱中解冻并保持2 h后的固形物重量,以其失水量与试样原重之比作为失水率。感观评定方法为冰冻的以色泽、气味、组织形态和肌肉弹性为检验项目,沸水煮5 min后以色泽、气味和汤汁混浊度为检验项目,各项根据描述分为好(50~40分)、较好(40~30分)、一般(30~20分)、较差(20~10分)和差(10~0分)5个级别,评定人员由10人组成,结果采用模糊数学法统计。
2. 结果与分析
2.1 不同速冻方式的冻结速度比较
冻结速度快慢以梭子蟹在过冷点之后温度下降斜率来衡量。从图 1可看出,-20℃冰柜直接冻结方式,梭子蟹在-2.9℃就保留了4 200 s;-50℃液体浸渍下梭子蟹温度下降斜率最大,冻结到-18℃只需1 750 s;-50℃液氮喷洒则需2 050 s,-35℃空气隧道式需4 900 s,这表明液体浸渍速冻最快,其次为液氮喷洒,再次为空气隧道式,最慢为冰柜直接冻结。
2.2 不同速冻处理过程中肌动球蛋白盐溶性变化
梭子蟹经过不同速冻处理后冻藏,其肌动球蛋白盐溶性的变化见图 2。在-20℃冰柜直接冻结梭子蟹在冻藏过程中肌动球蛋白的溶出量一直呈快速下降趋势,尤其是在前45 d的冻藏期内,其溶出量迅速从28.01 mg · g-1下降到5.66 mg · g-1。在-50℃液氮喷洒处理的梭子蟹肌动球蛋白溶出量在前30 d的冻藏期内变化不明显,其溶出量仅下降1.71 mg · g-1,在冻藏30 d后,尤其75 d后,下降速率加快,试验结束(第90天)时,肌动球蛋白的溶出量为8.76 mg · g-1,仍然远高于在-20℃冰柜直接冻结和-35℃空气隧道式处理的。-50℃液体浸渍处理的,前60 d内梭子蟹肌动球蛋白溶出量的变化相当缓慢,60 d后肌动球蛋白溶出量的下降速率开始加快。到第90天时,肌动球蛋白的溶出量仍高达21.4 mg · g-1,仅比鲜活梭子蟹肉的值低6.61 mg · g-1。
2.3 不同速冻处理过程中ATPase活性变化
不同速冻处理的梭子蟹在冻藏过程中ATPase活性的变化见图 3。在-20℃冰柜直接冻结下冻藏的梭子蟹肌动球蛋白的Ca2+-ATPase、Mg2+-ATPase、Ca2+-Mg2+-ATPase和Mg2+-EGTA-ATPase活性均随冻藏时间的延长而下降,且前三者的变化趋势基本相似,呈前期快后期慢的特点,第15天时,Mg2+-EGTA-ATPase活性已基本消失,第30天时,其它3种酶活性已基本丧失。-50℃液氮喷洒处理的Ca2+-ATPase、Mg2+-ATPase和Ca2+-Mg2+-ATPase活性呈一直下降的趋势,在冻藏70 d后,
![]() 图 3 不同速冻处理的梭子蟹在冻藏过程中ATPase活性的变化a.-20℃冰柜直接冻结;b.-50℃液氮喷洒;c.-50℃液体浸渍;d.-35℃空气隧道式Fig. 3 Changes of ATPase activities under different quick-freezing ways for P.pelagicus during storagea.froze under -20℃; b.spraying of liquid nitrogen at -50℃; c.soaking of liquid at -50℃; d.air tunnel way freezing at -35℃
图 3 不同速冻处理的梭子蟹在冻藏过程中ATPase活性的变化a.-20℃冰柜直接冻结;b.-50℃液氮喷洒;c.-50℃液体浸渍;d.-35℃空气隧道式Fig. 3 Changes of ATPase activities under different quick-freezing ways for P.pelagicus during storagea.froze under -20℃; b.spraying of liquid nitrogen at -50℃; c.soaking of liquid at -50℃; d.air tunnel way freezing at -35℃其活性均已降到接近0,Mg2+-EGTA-ATPase活性则呈缓慢下降趋势,第60天时,其活性已接近0。-50℃液体浸渍处理的Ca2+-ATPase、Mg2+-ATPase及Ca2+-Mg2+-ATPase活性大体呈匀速下降趋势,试验结束(90 d)时,其活性分别为0.041,0.086和0.093 μmol · (mg · min)-1,Mg2+-EGTA-ATPase活性在前15 d下降较快,随后一直缓慢下降,直至第75天降为0。-35℃空气隧道式处理的Ca2+-ATPase、Mg2+-ATPase及Ca2+-Mg2+-ATPase活性前30 d的下降速率较快,Ca2+-ATPase活性到第60天,Mg2+-ATPase及Ca2+-Mg2+-ATPase活性到第75天时降为0,Mg2+-EGTA-ATPase活性在前30 d冻藏期内下降速率较慢,随后迅速下降,到第45天时活性基本丧失。
2.4 不同速冻处理过程中巯基含量变化
不同速冻处理的梭子蟹在冻藏过程中巯基含量的变化见图 4。第15天开始,不速冻处理的梭子蟹巯基含量下降速度出现了显著差异。在-20℃冰柜直接冻结下冻藏时,梭子蟹巯基含量在15~30 d内急剧下降,由0.970 μmol · g-1下降到0.104μmol· g-1,到第45天时,巯基含量已接近0。-35℃空气隧道式处理的梭子蟹巯基含量在30~45 d期间快速下降,巯基含量由0.784 μmol · g-1下降到0.257 μmol · g-1,第70天,其含量已降为0。-50℃液氮喷洒处理的梭子蟹巯基含量下降速度明显放慢,尤其是在冻藏60 d以后,含量几乎不变,到第90天时,含量仍达0.764 μmol · g-1。-50℃液体浸渍处理的梭子蟹巯基含量下降极为缓慢,到90 d的冻藏期结束时,巯基含量依然高达1.030 μmol · g-1,仅比初始含量下降0.234 μmol · g-1。
2.5 不同速冻处理的感观评定和失水率
不同速冻处理的梭子蟹感观评定和失水率见表 1、表 2。从表中可以看到,冻藏2个月后,-50℃液氮喷洒和-50℃液体浸渍处理失水率低于-35℃空气隧道式和-20℃冰柜冻结,说明低温快速冻结梭子蟹肉持水量高于慢冻结。在感观评定方面,-50℃液氮喷洒和-50℃液体浸渍处理的梭子蟹肉在色泽和肌肉弹性上均优于-35℃空气隧道式和-20℃冰柜冻结的,水煮后香味较为浓郁清新且口感较好。
表 1 不同速冻处理的梭子蟹冰冻感观评定和失水率Table 1 Sensory evaluation and moisture-loss ratios in different quick-froze P.pelagicus色泽color 气味flavor 组织形态microstructure shape 肌肉弹性textures of muscle 失水率/% moisture-loss ratios -50℃液氮喷洒spraying of liquid nitrogen at -50℃ 45.5 46.7 46.1 46.2 10.42 -50℃液体浸渍soaking of liquid at -50℃ 45.4 46.2 46.9 46.1 11.53 -35℃空气隧道式air tunnel way at -35℃ 41.3 38.9 40.2 39.4 13.81 -20℃冰柜冻结frozen under -20℃ 32.3 30.6 16.8 28.8 14.52 表 2 水煮后的梭子蟹肉感官评定Table 2 Sensory evaluation of boiled P.pelagicus meat色泽color 气味flavor 汤汁混浊度turbid of soup juice -50℃液氮喷洒spraying of liquid nitrogen at -50℃ 46.3 46.2 46.9 -50℃液体浸渍soaking of liquid at -50℃ 46.5 45.9 46.7 -35℃空气隧道式air tunnel way at -35℃ 38.7 39.1 29.6 -20℃冰柜冻结frozen under -20℃ 26.8 16.5 20.1 3. 讨论
3.1 蟹肉的速冻与品质关系
冰晶体的大小与冷冻速率有关。在冷冻结冰缓慢进行的情况下,形成大型针状结构的晶体,缓慢冻结期间形成的少量晶核和大型冰晶,而快速冻结则大量形成晶核,分布广泛,冰晶体增长分配在多数晶核上进行,因而晶块小而分布广。-20℃冰柜冻结和-35℃空气隧道式缓慢冻结,解冻后的梭子蟹肉则变软流汁,风味减退,由于缓冻使冰晶体不断扩大,破坏细胞组织,使梭子蟹肉解冻后细胞失去恢复能力。而-50℃液氮喷洒和-50℃液体浸渍快速冻结则对梭子蟹肉破坏小,品质保持较好。
3.2 不同速冻方式对巯基含量变化的影响
梭子蟹在不同速冻方式下冻藏时,其巯基含量均表示出不同程度的下降趋势。巯基含量下降的原因可能是冰晶的形成使得肌原纤维蛋白空间结构发生改变,使埋藏在分子内部的巯基暴露出来,进而被氧化成二硫键,导致巯基含量的减少[8]。速冻方式对梭子蟹巯基含量的变化影响极其显著(P < 0.01)。冻藏至第30天时,-20℃冰柜直接冻结下冻藏的梭子蟹巯基含量已降为0.104 μmol · g-1,仅为初始含量的8.2%,而-50℃液体浸渍下冻藏的梭子蟹巯基含量仍高达1.048 μmol · g-1,为初始含量的82.9%。冻藏至第60天时,-35℃空气隧道式下冻藏的梭子蟹巯基含量降至0.111 μmol · g-1,仅为初始含量的8.8%,而-50℃液体浸渍下冻藏的梭子蟹巯基含量为1.039 μmol · g-1,相当于初始含量的82.2%。到第90天试验结束时,-50℃液氮喷洒冻藏下的梭子蟹巯基含量也降至0.764 μmol · g-1,为初始含量的60.4%,而-50℃液体浸渍下冻藏的梭子蟹巯基含量还保持在1.030 μmol · g-1的较高水平。
3.3 不同速冻方式对肌动球蛋白溶出量的影响
SOMPONGSE等[8]认为巯基氧化形成的二硫键会导致肌球蛋白重链聚合,从而降低其盐溶性。比较图 2和图 4可以看出,梭子蟹肌动球蛋白的溶出量在不同速冻方式下冻藏时的下降趋势与其巯基含量的变化存在相关性。因此,可以认为梭子蟹在冻藏过程中肌动球蛋白溶出量的下降是由于巯基氧化形成二硫键所致。
从图 2中可以看到,在-50℃液氮喷洒下冻藏的梭子蟹肌动球蛋白溶出量从第15天到第30天,在-50℃液体浸渍下冻藏的梭子蟹肌动球蛋白溶出量从第15天到第45天之间出现了上升趋势。实际上FUKUDA等[9]在研究其它蟹肉在冻藏过程中的变性情况时,也发现了盐溶性在一段时间内上升的现象。JIANG等[10]也发现类似情况,此现象可能是提取方法不完善导致的,由于在较低的温度下冻藏时,冻藏前期肌动球蛋白变性较轻微,因而提取方法对试验值的影响较大,导致-50℃液氮喷洒和-50℃液体浸渍下冻藏过程中的肌动球蛋白溶出量出现了上升趋势。基于此,不宜单独将肌动球蛋白的盐溶性作为评价其变性的指标。
3.4 不同速冻方式对肌原纤维蛋白质ATPase活性的影响
经不同速冻处理的梭子蟹肌原纤维蛋白质Ca2+-ATPase、Mg2+-ATPase、Ca2+-Mg2+-ATPase和Mg2+-EGTA-ATPase活性,均随冻藏时间延长而下降。引起冻藏过程中蟹肉肌原纤维蛋白质ATPase活性下降的原因众说纷纭。LIAN等[11]认为是由于冰晶的机械作用引起的;许多学者[12-13]也认为,由于巯基氧化形成二硫键导致分子聚合是ATPase活性下降的主要原因。根据冻藏梭子蟹巯基含量变化,笔者认为,肌原纤维蛋白质ATPase活性下降是由巯基氧化引起。但速冻速度对梭子蟹肌原纤维蛋白质ATPase活性下降速率具有显著的影响(P < 0.01)。速冻速度越快,梭子蟹肌原纤维蛋白质ATPase活性下降速率越慢。另外,即使是-50℃液体浸渍速冻,Mg2+-EGTA-ATPase活性也在70 d内消失,表明梭子蟹肌原球蛋白-肌钙蛋白复合体非常容易变性。
4. 小结
速冻保藏是国际公认的食品最佳保藏方法之一。通常认为,冻结速度越快,食品的质量越好,这是因为冻结速度快,食品材料内部形成的冰晶小而均匀,食品的组织结构被破坏的程度低,汁液流失少。从4种不同速冻方式中可以看出,-50℃液体浸渍处理梭子蟹,保藏期长,蛋白质等流失量少,水煮后香味较为浓郁清新,在色泽和肌肉弹性上均优于其它3种速冻方式;-50℃液氮喷洒对蟹肉的品质保存相对完好;-20℃冰柜直接冻结到第30天时,蟹肉已经基本变质;4种速冻方式中以-50℃液体浸渍为最佳的保鲜方式。
从此试验结果可以看出,虽然低温速冻处理没能阻止梭子蟹肉冻藏期间盐溶性蛋白含量、巯基含量、ATPase活性等指标的下降趋势,但相比于直接冻结,低温快速冻结处理在一定程度上降低了蛋白质变性的速度,蟹肉的肉质、口感和风味明显提高。
-
表 1 RAPD引物序列及退火温度
Table 1 Primer sequences for RAPD and annealing temperature
引物编号
primer No.引物序列(5→3′)
primer sequence退火温度/℃
annealing temperatureS15 GGAGGGTGTT 36.0 S24 AATCGGGCTG 36.0 S31 CAATCGCCGT 36.0 S58 GAGAGCCAAC 36.0 S68 TGGACCGGTG 36.0 S83 GAGCCCTCCA 36.0 S103 AGACGTCCAC 36.0 S398 ACCACCCACC 36.0 表 2 拟穴青蟹群体的遗传多样性
Table 2 Genetic diversity parameters of S.paramamosain populations
项目
item样本数/个
number of specimen(NS)多态位点数/个
number of polymorphic locus (NPL)多态位点百分率/%
percentage of polymorphic locus (PPL)观察等位基因数
observed number of alleles (Na)有效等位基因数
effective numeber of alleles (Ne)Nei′s基因多样性
gene diversity(h)Shannon′s信息指数
Shannon′s information index(I)党江DJ 19 17 38.64 1.386 4±0.492 5 1.276 1±0.382 7 0.155 8±0.208 1 0.227 1±0.298 6 闸口ZK 19 16 36.36 1.363 6±0.486 6 1.258 2±0.363 1 0.148 5±0.202 5 0.216 9±0.293 4 珍珠湾ZZW 14 17 38.64 1.386 4±0.492 5 1.274 1±0.387 5 0.154 0±0.207 6 0.224 8±0.297 0 钦州湾QZW 13 24 54.55 1.545 5±0.503 7 1.375 8±0.397 5 0.213 2±0.214 2 0.312 1±0.305 5 清化QH 19 15 34.09 1.340 9±0.479 5 1.251 3±0.391 6 0.138 1±0.206 6 0.200 1±0.293 5 流沙湾LSW 15 13 29.55 1.295 5±0.461 5 1.177 8±0.308 0 0.106 6±0.175 3 0.159 9±0.257 7 平均average 16.5 17 36.97 1.369 7 1.268 8 0.152 7 0.223 5 物种水平at species level 99 31 70.45 1.704 5±0.461 5 1.296 3±0.335 9 0.184 3±0.177 7 0.290 9±0.250 2 表 3 拟穴青蟹6个群体基因多样性的Nei′s分析
Table 3 Nei′s analysis of gene diversity in 6 S.paramamosain populations
项目
item总基因多样性
total gene diversity (Ht)群体内基因多样性
gene diversity within population (Hs)基因分化系数
coefficient of gene differentiation(Gst)基因流
gene flow(Nm)平均 average 0.187 2 0.152 7 0.184 3 2.212 9 标准差 standard deviation 0.031 6 0.023 9 — — 表 4 拟穴青蟹6个群体的AMOVA分析
Table 4 AMOVA analysis of 6 S.paramamosain populations
谱系结构
source of variation自由度
degree of freedom (df)方差总和
sum of squared deviation (SSD)平均方差
mean of squared deviation (MSD)变异组分
variance component变异百分率/%
percentage of total variance群体间 among populations 5 43.407 8.681 0.375 12.97 群体内 within populations 93 234.290 2.519 2.519 87.03 表 5 拟穴青蟹6个群体间的地理距离(对角线上方)和遗传距离(对角线下方)
Table 5 Geographic (above diagonal) and genetic distance (below diagonal) among 6 S.paramamosain populations km
项目 item 党江 DJ 闸口 ZK 珍珠湾 ZZW 钦州湾 QZW 清化 QH 流沙湾 LSW 党江 DJ — 53.53 88.63 53.28 383.77 165.20 闸口 ZK 0.023 4 — 140.79 101.60 434.87 156.80 珍珠湾 ZZW 0.037 3 0.065 1 — 38.83 306.54 220.77 钦州湾 QZW 0.060 2 0.093 8 0.023 6 — 344.13 204.32 清化 QH 0.038 3 0.042 1 0.040 0 0.062 1 — 422.49 流沙湾 LSW 0.023 7 0.033 1 0.030 7 0.068 8 0.021 2 — -
[1] 林琪, 李少菁, 黎中宝, 等. 中国东南沿海青蟹属(Scylla)的种类组成[J]. 水产学报, 2007, 31(2): 211-219. doi: 10.3321/j.issn:1000-0615.2007.02.013 LIN Qi, LI Shaojing, LI Zhongbao, et al. Species composition in genus Scylla from the coast of southeast China[J]. J Fish China, 2007, 31(2): 211-219. (in Chinese) doi: 10.3321/j.issn:1000-0615.2007.02.013
[2] KEENAN C P, DAVIES P J F, MANN D L. A revision of the genus Scylla de Hann, 1833 (Crustacea: Decapoda: Brachyura: Portunidae)[J]. Raffles Bull Zool, 1998, 46(1): 217 - 245. https://xueshu.baidu.com/usercenter/paper/show?paperid=9586dfe49a62a6bccee53bea98770a0e&site=xueshu_se&hitarticle=1
[3] 乔振国, 马凌波, 于忠利, 等. 我国海水蟹类养殖现状与发展目标[J]. 渔业现代化, 2009, 36(3): 45-48. doi: 10.3969/j.issn.1007-9580.2009.03.010 QIAO Zhenguo, MA Lingbo, YU Zhongli, et al. Status and development goal of sea crabs farming in China[J]. Fish Modern, 2009, 36 (3): 45-48. (in Chinese) doi: 10.3969/j.issn.1007-9580.2009.03.010
[4] 林琪. 中国青蟹属种类组成和拟穴青蟹群体遗传多样性的研究[D]. 厦门: 厦门大学, 2008. https://xueshu.baidu.com/usercenter/paper/show?paperid=4ae1fcc648781dcd0d98410f893fe510&site=xueshu_se&hitarticle=1 LIN Qi. Species composition of genus Scylla and genetic diversity of Scylla paramamosain (Estampador, 1949) populations in China[D]. Xiamen: Xiamen University, 2008. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=4ae1fcc648781dcd0d98410f893fe510&site=xueshu_se&hitarticle=1
[5] 路心平, 马凌波, 乔振国, 等. 利用线粒体DNA标记分析中国东南沿海拟穴青蟹种群遗传结构[J]. 水产学报, 2009, 33 (1): 15-23. doi: 10.3321/j.issn:1000-0615.2009.01.003 LU Xinping, MA Lingbo, QIAO Zhenguo, et al. Population genetic structure of Scylla paramamosain from the coast of the southeastern China based on mtDNA COI sequences[J]. J Fish China, 2009, 33(1): 15-23. (in Chinese) doi: 10.3321/j.issn:1000-0615.2009.01.003
[6] KINBUNGA S, BOONYAPAKDEE A, PRATOOMCHAT B. Genetic diversity and species-diagnostic markers of mud crabs (Genus Scylla) in eastern Thailand determined by RAPD analysis[J]. Mar Biotechnol, 2000, 2(2): 180-187. doi: 10.1007/s101269900023
[7] YEH F C, YANG R C, BOYLE T B J, et al. POPGENE: the user-friendly shareware for population genetic analysis[CP]. Edmonton: Molecular and Biotechnology Center, University of Alberta, 1997. https://xueshu.baidu.com/usercenter/paper/show?paperid=85a3192e104a0b0d49eb1d400642c937&site=xueshu_se
[8] MILLER M P. Tools for population genetic analysis (TFPGA): version 1.3[CP]. Flagstaff: Department of Biological Sciences, Northern Arizona University, 1997. https://www.scienceopen.com/document?vid=91146e4d-17b1-42e6-b5e0-7717b8d6600d
[9] EXCOFFIER L. Analysis of molecular variance (AMOVA): version 1.55[CP]. Switzerland: Genetics and Biometry Laboratory, University of Geneva, 1993.
[10] 李康, 杜晓东, 叶富良. 斑节对虾两个野生种群RAPD分析[J]. 湛江海洋大学学报, 2005, 25(3): 79-82. doi: 10.3969/j.issn.1673-9159.2005.03.019 LI Kang, DU Xiaodong, YE Fuliang. Genetic diversity of two wild populations of Penaeus monodon revealed by RAPD technique[J]. J Zhanjiang Ocean Univ, 2005, 25(3): 79-82. (in Chinese) doi: 10.3969/j.issn.1673-9159.2005.03.019
[11] 谭树华, 王桂忠, 林琼武, 等. 短沟对虾两个野生群体遗传多样性的RAPD分析[J]. 生态学报, 2006, 26(11): 3907-3911. doi: 10.3321/j.issn:1000-0933.2006.11.051 TAN Shuhua, WANG Guizhong, LIN Qiongwu, et al. Genetic diversity of two wild populations of Penaeus semisulcatus revealed by RAPD technique[J]. Acta Ecologica Sinica, 2006, 26(11): 3907-3911. (in Chinese) doi: 10.3321/j.issn:1000-0933.2006.11.051
[12] GARCIA D K, FAGGART M A, RHOADES L, et al. Genetic diversity of cultured Penaeus vannamei shrimp using three molecular genetic techniques[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 270-280. https://xueshu.baidu.com/usercenter/paper/show?paperid=54a34c7d28b92dd39bff5307943cc9e2&site=xueshu_se&hitarticle=1
[13] 孟宪红, 马春燕, 刘萍, 等. 黄渤海中国对虾6个地理群的遗传结构及其遗传分化[J]. 高技术通讯, 2004, 14(4): 97-102. https://xueshu.baidu.com/usercenter/paper/show?paperid=1s1p0ph0203j0ev0mj5p00k0e3778863&site=xueshu_se&hitarticle=1 MENG Xianhong, MA Chunyan, LIU Ping, et al. The genetic structure and differentiation of geographic stock of Fenneropenaeus chinensis along the Yellow Sea and the Bohai Sea[J]. Chin High Technol Lett, 2004, 14(4): 97-102. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=1s1p0ph0203j0ev0mj5p00k0e3778863&site=xueshu_se&hitarticle=1
[14] 刘海映, 王桂娥, 王秀利. 大连海域口虾蛄资源遗传多样性的分析[J]. 大连水产学院学报, 2009, 24(4): 350-353. doi: 10.3969/j.issn.1000-9957.2009.04.013 LIU Haiying, WANG Gui'e, WANG Xiuli. Genetic diversity analysis of mantis shrimp Oratosquilla oratoria from Dalian coast[J]. J Dalian Fish Univ, 2009, 24(4): 350-353. (in Chinese) doi: 10.3969/j.issn.1000-9957.2009.04.013
[15] CHI Dali, YAN Binlun, SHEN Songdong, et al. RAPD analysis between color-different crab individuals of Portunus trituberculatus[J]. Mar Sci Bull: English Edition, 2010, 12(2): 47-54. https://xueshu.baidu.com/usercenter/paper/show?paperid=3885c2b978c406ffeb515bcbe2073661&site=xueshu_se&hitarticle=1
[16] 刘萍, 孔杰, 石拓, 等. 中国对虾黄、渤海沿岸地理群的RAPD分析[J]. 海洋学报, 2000, 22(5): 89-93. doi: 10.3321/j.issn:0253-4193.2000.05.011 LIU Ping, KONG Jie, SHI Tuo, et al. RAPD analysis of wild stock of Penaeid shrimp (Penaeus chinensis) in the China's coastal waters of Huanghai and Bohai Seas[J]. Acta Oceanologica Sinica, 2000, 22(5): 89-93. (in Chinese) doi: 10.3321/j.issn:0253-4193.2000.05.011
[17] NELSON K, HEDGECOCK D. Enzyme polymorphism and adaptive strategy in the decapod crustacean[J]. Am Nat, 1980, 116(2): 238-279. doi: 10.1086/283625
[18] HAMRICK J L, LOVELESS M D. The genetic structure of tropical tree populations: associations with reproductive biology[G]//BOCK J H, LINHART Y B. Plant evolutionary ecology. Boulder: Westview Press, 1989: 131-146. doi: 10.1201/9780429310720-8/genetic-structure-tropical-tree-populations-associations-reproductive-biology-hamrick-loveless
[19] 李婧, 夏念和. 广东省五节芒遗传多样性的ISSR分析[J]. 热带亚热带植物学报, 2011, 19(6): 506-512. doi: 10.3969/j.issn.1005-3395.2011.06.003 LI Jing, XIA Nianhe. Genetic diversity of Miscanthus floridulus (Poaceae) from Guangdong by inter simple sequence repeat (ISSR)[J]. J Trop Subtrop Bot, 2011, 19(6): 506-512. (in Chinese) doi: 10.3969/j.issn.1005-3395.2011.06.003
[20] BUSO G S C, RANGEL P H, FERREIRA M E. Analysis of genetic variability in South American wild rice populations (Oryza glumaepatula) with isozymes and RAPD markers[J]. Mol Ecol, 2002, 7(1): 107-117. doi: 10.1046/j.1365-294x.1998.00321.x
[21] SITES J W, MARSHALL J C. Delimiting species: a renaissance issue in systematic biology[J]. Trends Ecol Evol, 2003, 18(9): 462-470. doi: 10.1016/S0169-5347(03)00184-8
[22] WALKER C W, VILA C, LANDA A, et al. Genetic variation and population structure in Scandinavian wolverine (Gulo gulo) populations[J]. Mol Ecol, 2001, 10(1): 53-63. https://xueshu.baidu.com/usercenter/paper/show?paperid=1s170re0fa390ta0jp560xs05k420524&site=xueshu_se




 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
