Quality assessment of oosperm of turbot (Scophthalmus maximus) based on energy metabolism-related relative enzyme activities
-
摘要:
采用卵径形态比较和能量代谢关键酶生理生化分析方法,对大菱鲆(Scophthalmus maximus)卵质进行了评价。结果显示,大菱鲆受精卵卵径平均值为(1.053±0.020)mm,不同批次的受精卵卵径间无显著差异。双变量相关统计分析结果显示,大菱鲆卵径与悬浮率、受精率和孵化率间相关性皆不显著。基于能量代谢关键酶统计结果显示,大菱鲆受精卵孵化率与参与蛋白代谢关键酶谷草转氨酶(AST)相对活力存在显著相关性[EAST≥(15.159±3.300)U · mg-1,HHatching rate>20%,Spearman相关系数为R=0.675,P=0.003],悬浮率和受精率与AST显著相关;大菱鲆受精卵悬浮率、受精率和孵化率与参与糖代谢关键酶丙酮酸激酶(PK)间相关性均不显著。该研究表明,AST相对活力可以作为用于评价大菱鲆卵质的生理生化参数,蛋白质在大菱鲆受精卵能量代谢过程中是一个重要的能量来源。
Abstract:We assessed the oosperm quality of turbot (Scophthalmus maximus) based on the morphological comparison of oosperm diameter and energy metabolism-related relative enzyme activities. The results show that the average oosperm diameter for turbot is (1.053±0.020) mm and no significant difference is found among different batches. Bivariate correlation statistics reveal that the correlation is insignificant among oosperm diameter and suspensibility as well as fertilization rate and hatching rate. The statistics of energy metabolism-related relative enzyme activities indicate that significant correlation is found between hatching rate and aspartate amino transferase (AST) [EAST≥(15.159±3.300) U · mg-1, HHatching rate > 20%, Spearman coefficient R=0.675, P=0.003]; the correlation among suspensibility, fertilization rate and AST is significant. No significant correlation is found among pyruvate kinase (PK), suspensibility, fertilization rate and hatching rate. Thus, the relative activity of AST can be used as a physiological and biochemical parameter to assess the oosperm quality of turbot, and protein is an important energetic source for the energy metabolism of turbot′s oosperm.
-
弧菌病是常见的水产养殖病害[1]。近年来随着水产养殖品种的增加和养殖规模的扩大,尤其是高密度养殖使水体自身调节能力降低,弧菌病害和氨氮 (NH4 +-N) 过量对水产养殖的负面影响越来越严重,有关水产养殖过程中弧菌病防治和水体污染治理的研究备受关注[2]。目前主要采用化学、物理手段进行弧菌病的防治,但物理手段会造成水体二次污染,化学手段会导致病原菌的抗药性,打破水域生态平衡,而生物手段则弥补了化学手段的不足,这类生态友好型的治理手段已成研发热点[3],生产上亟需更多的微生物制剂用于水产病害和水污染治理[4]。
光合细菌 (Photosynthetic bacteria, PSB) 是在厌氧条件下以光为能源,以二氧化碳 (CO2) 或有机物为碳源,进行不生氧光合作用的原核生物[5]。目前所知的光合细菌可分为着色杆菌科、外硫红螺菌科、紫色非硫细菌、绿色硫细菌、多细胞丝状绿细菌、螺旋杆菌科、含细菌叶绿素的专性好氧菌7大类群,其中在水产养殖方面应用最多的为紫色非硫细菌[6-8]。光合细菌将水体中的有机物转化为自身生长所需的能量,与病原微生物形成竞争关系,从而成为优势菌群,抑制病原菌的生长繁殖[9],降低水产养殖病害的发生率,而且光合细菌所含的营养物质能够提高养殖鱼虾的免疫力,大幅提升其产量[10]。光合细菌作为生防菌株,已有研究主要针对其能够高效降解水体中的三态氮、硫化氢等有害物质[11],而对同时具有弧菌拮抗作用和降解NH4 +-N、亚硝态氮 (NO2 −-N) 复合功能的光合细菌的研究较少。本研究通过分离筛选对弧菌具有抑制作用并能降解NH4 +-N和NO2 −-N的优良光合细菌,以期为水产养殖病害的生物防治和养殖水污染治理提供优良菌株。
1. 材料与方法
1.1 试验材料
1.1.1 供试培养基
光合细菌富集培养基为氯化钠 (NaCl) 2 g,七水硫酸镁 (MgSO4·7H2O) 0.2 g,氯化铵 (NH4Cl) 1 g,磷酸二氢钾 (KH2PO4) 1.75 g,乙酸钠 (CH3COONa) 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g 碳酸氢钠 (NaHCO3)。光合细菌分离培养基为光合细菌富集培养基添加1.7%琼脂。光合细菌发酵培养基为LB培养基。弧菌的培养及抑菌作用测定培养基为2216E培养基 (蛋白胨5 g、酵母膏1 g、磷酸高铁0.01 g,琼脂20 g,陈海水1 000 mL,pH 8.0)。NH4 +-N降解培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,硫酸铵[(NH4)2SO4] 0.2358 g,KH2PO4 1.75 g,CH3COONa 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3 (NH4 +-N质量浓度为50 mg·L−1)。NO2 −-N降解培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,NaNO2 0.246 4 g,KH2PO4 1.75 g,CH3COONa 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3 (NO2 −-N质量浓度为50 mg·L−1)。柠檬酸盐利用培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,NH4Cl 1 g,KH2PO4 1.75 g,柠檬酸钠3 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3。
1.1.2 病原菌
副溶血弧菌 (Vibrio parahemolyticus)、鳗弧菌 (V. anguillarum)、创伤弧菌 (V. vulnificus) 由本实验室保藏提供。
1.2 样品的采集与富集
从连云港海域海州湾、车牛山岛、灌河入海口等区域采集海水样品20个,海泥样品4个,从南通市如东、启东地区海域采集海水样品4个,海泥样品2个。
取5 mL样品于25 mL富集培养基中,置于50 mL螺口离心管中,再加5 mL无菌液状石蜡,30 ℃,2 000 lx光照条件下富集培养,至培养物出现不同颜色。取1 mL培养物接种于新的富集培养基中继续培养,重复3~4次,得到深色培养液。
1.3 海洋光合细菌的分离纯化
采用双层平板涂布法和双层平板划线法。取不同的样品富集液,进行梯度稀释,分别取不同样品10−4、10−5、10−6稀释浓度的稀释液0.2 mL涂布于光合细菌分离培养基平板上,用一层融化后冷却至约45 ℃的分离培养基覆盖,静置凝固后,30 ℃光照条件下培养4 d。挑取红色、紫色、棕色和绿色等不同颜色菌落至新的分离培养基的平板上进行三区划线,进一步纯化,至在显微镜下观察菌体形态一致。
1.4 海洋光合细菌对弧菌的抑制作用测定
1.4.1 光合细菌菌悬液的制备
将分离得到的光合细菌菌株接种于装有25 mL LB液体培养基的50 mL离心管内,加入5 mL灭菌石蜡,在30 ℃、光照强度2 000 lx下培养4 d,菌液用无菌液体培养基调整光密度 (OD660 nm) 相等且OD660 nm≥1.5。
1.4.2 对弧菌的抑菌作用测定
采用牛津杯法。将在2216E培养基斜面上培养24 h的供试3种弧菌用无菌生理盐水洗下,制备成浓度为107个·mL−1的菌悬液,取0.1 mL菌悬液涂布在2216E培养基平板上。在距离培养皿边缘1.5 cm处的含菌平板四周均匀放置牛津杯,每个牛津杯中注入200 μL光合细菌不同菌株浓度为107个·mL−1的菌悬液,以等量的无菌培养基为对照,28 ℃恒温培养48 h,观察测定抑菌圈直径。每个菌株3个重复。
1.5 不同光合细菌菌株降解NH4 +-N和NO2 −-N作用测定
1.5.1 标准工作曲线制作
分别采用靛酚蓝分光光度法和盐酸萘乙二胺分光光度法 (GB/T 11889—1989) 测定溶液中NH4 +-N和NO2 −-N质量浓度。分别以NH4 +-N质量浓度和NO2 −-N质量浓度为横坐标,OD637 nm和OD538 nm为纵坐标,制作标准曲线,建立回归方程。
1.5.2 降解率测定
将光合细菌菌悬液 (OD660 nm≥1.5) 按10%的接种量接入装有25 mL液体降解培养基的50 mL离心管中,加入5 mL灭菌石蜡,每个菌株3个平行,在30 ℃、光照强度2 000 lx下静置培养4 d。发酵液于4 ℃、5 000 r·min−1条件下离心20 min,取上清液,测定不同菌株上清液的吸光值,根据标准曲线计算不同菌株发酵液中的氮质量浓度,以未接种的培养基作为对照,计算不同菌株的降解率。
$$ R=({{C}_{t}}-{{C}_{0}})/{{C}_{0}}\times 100{\text{%}} $$ (1) 式中:R为降解率;Ct为对照浓度;C0为处理浓度。
1.6 抑菌并高效降解NH4 +-N和NO2 −-N光合细菌菌株的初步鉴定
1.6.1 形态学观察
将筛选出的抑菌并高效降解NH4 +-N和NO2 −-N的光合细菌菌株接种于光合细菌分离培养基上,在30 ℃、光照强度2 000 lx下静置培养4 d,通过解剖镜观察培养基上菌落形态及颜色,挑取单菌落,进行革兰氏染色和鞭毛染色,显微镜观察菌体大小、形态和染色结果。
1.6.2 生理生化试验
挑取菌株3个单菌落至含2 mL无菌水的离心管中,振荡均匀并制成0.5麦氏浊度的均一菌悬液,吸取50~100 µL菌悬液接种至不同的生化管中,按照说明书于不同条件下培养,观察反应管的显色结果,将显色结果与《结果诠释表》比对,确定反应结果,以大肠杆菌为对照菌。
柠檬酸盐利用试验:将光合细菌菌悬液 (OD660 nm≥1.5) 按10%的接种量接入装有25 mL柠檬酸盐利用培养基的50 mL离心管中,加入5 mL灭菌石蜡,在30 ℃、2 000 lx下静置培养4 d,观察培养基颜色变化,确认菌株是否生长。
根据形态观察和生理生化反应结果,对照《伯杰细菌鉴定手册》 《常见细菌系统鉴定手册》对菌株进行初步鉴定。
1.6.3 16S rDNA序列分析
将P-3菌株样品送至上海生工生物工程有限公司,测定菌株的16S rDNA序列。所得的基因序列拼接完整后与NCBI数据库中的已知序列进行BLAST比对,选取近源序列,采用MEGA 7.0软件构建16S rDNA基因序列系统发育树。
2. 结果
2.1 海洋光合细菌的富集
在光照厌氧条件下30个不同样品多次富集培养,有6个样品出现了颜色变化,分离自灌河入海口海泥 (A) 为棕色,车牛山岛海水 (B) 和南通如东海泥 (C) 均为深红色,南通启东海水 (D) 和连云港高公岛表层海水 (E) 为红色,海州湾海水 (F) 为绿色 (图1),其他样品浑浊,未变色。
![]() 图 1 富集筛选培养后的培养液A. 灌河入海口海泥;B. 车牛山岛海水;C. 南通如东海泥;D. 南通启东海水;E. 连云港高公岛表层海水;F. 海州湾海水。Fig. 1 Culture medium after enrichment and screeningA. Sea mud of the river empties into the sea; B. Cheniushan Island sea water; C. Sea mud of Rudong, Nantong; D. Sea water of Qidong, Nantong; E. Surface water of Gaogong Island, Lianyungang; F. Sea water of Haizhou Bay.
图 1 富集筛选培养后的培养液A. 灌河入海口海泥;B. 车牛山岛海水;C. 南通如东海泥;D. 南通启东海水;E. 连云港高公岛表层海水;F. 海州湾海水。Fig. 1 Culture medium after enrichment and screeningA. Sea mud of the river empties into the sea; B. Cheniushan Island sea water; C. Sea mud of Rudong, Nantong; D. Sea water of Qidong, Nantong; E. Surface water of Gaogong Island, Lianyungang; F. Sea water of Haizhou Bay.2.2 海洋光合细菌的分离纯化
将富集的30个样品涂布于光合细菌平板上,从连云港高公岛海域海水分离纯化得到了橙红色的P-1菌株,从南通如东海泥中分离得到红色的P-2菌株,从连云港车牛山岛海域海水分离得到深红色P-3菌株。3个菌株的形态特征见表1、图2和图3,符合光合细菌的特征。
表 1 分离得到的3个光合细菌菌株的形态特征Table 1 Morphological characteristics of three isolates of photosynthetic bacteria菌株编号
Strain No.菌体形态
Mycelial morphology细胞大小
Cell size/μm革兰氏染色
Gram stain液体培养
Liquid culture菌落形态
Colony morphologyP-1 短杆状 1.47×0.83 G– 橙红色 橙色,边缘整齐,圆形,高突起 P-2 卵球状 1.02×0.23 G– 红色 深红色,边缘整齐,圆形,低突起,表面有光泽 P-3 细杆状 1.49×0.15 G– 深红色 红色,边缘整齐,圆形,表面低突 2.3 光合细菌菌株对3种弧菌的抑制作用
菌株P-3对3种弧菌均有抑制作用,对鳗弧菌的抑菌圈较明显,抑菌圈平均直径为 (5.26±0.03) mm。菌株P-1、P-2在平板对峙试验中,牛津杯周围基本上未现抑菌圈,说明这2株菌对副溶血弧菌、鳗弧菌和创伤弧菌没有拮抗作用 (表2、图4)。
表 2 不同光合细菌菌株对弧菌的抗菌效果Table 2 Antibacterial effect of strains against Vibrios指示菌
Indicator bacteria抑菌圈平均直径
Average diameter of inhibition zone/mmP-1 P-2 P-3 副溶血弧菌
V. Parahemolyticus— — 2.27±0.04 鳗弧菌 V. anguillarum — — 5.26±0.03 创伤弧菌 V. vulnificus 2.40±0.01 — 2.10±0.08 注:—. 无明显抑菌圈。 Note: —. No obvious bacteriostatic zone. 2.4 具有抑菌作用的光合细菌菌株降解NH4 +-N和NO2 −-N作用的测定
将光合细菌菌液加入含50 mg·L−1 NH4 +-N、NO2 −-N降解培养基中,光照厌氧条件30 ℃培养4 d,测定发酵液的吸光值,并通过回归方程计算氮浓度,结果见表3。3株菌株降解氮的能力较强,其中菌株P-2的NH4 +-N降解率最高 (93.39%),菌株P-3的NO2 −-N降解率最高 (94.98%)。
表 3 3株海洋光合细菌对氨氮和亚硝态氮的降解率Table 3 Ammonia nitrogen and nitrite nitrogen degradation rate of three marine photosynthetic bacteria菌株
编号
Strain No.氨氮 NH4 +-N 亚硝态氮 NO2 −-N 质量浓度
Concentration/
(mg·L−1)降解率
Degradation
rate/%质量浓度
Concentration/
(mg·L−1)降解率
Degradation
rate/%CK 48.78±0.00 — 48.91±0.35 — P-1 6.02±0.21 87.66±0.42 7.12±1.39 85.44±1.27 P-2 3.22±0.08 93.39±0.16 15.24±0.42 68.83±0.85 P-3 5.03±0.36 89.68±0.73 0.98±0.29 94.98±0.60 2.5 抑菌并高效降解NH4 +-N和NO2 −-N光合细菌菌株的鉴定
根据不同菌株抑菌作用、NH4 +-N和NO2 −-N降解作用结果,菌株P-3对3种弧菌的抑制作用以及对NO2 −-N的降解作用最强,同时对NH4 +-N的降解率较高,作为高效抑菌降解NH4 +-N和NO2 −-N的优良菌株进行初步鉴定。
2.5.1 形态学观察
菌落形态为红色圆球状,边缘整齐,表面低突 (图5);该菌为革兰氏阴性菌,细胞短杆状,大小为 (1.34~1.62) × (0.33~0.59) μm,单根极生鞭毛 (图6-a);菌株P-3在光照厌氧条件下,培养液呈深红色 (图6-b)。
2.5.2 生理生化特性
菌株P-3在麦芽糖、阿拉伯糖生化鉴定管颜色变为黄色、阳性,葡萄糖管颜色无变化,说明该菌具有分解阿拉伯糖和麦芽糖的能力,不能利用葡萄糖作为碳源;尿素酶、赖氨酸脱羧酶、精氨酸双水解酶实验呈阳性,表明菌株P-3能分解氨基酸使其脱羧生成胺;苯丙氨酸、肌醇试验为阴性;柠檬酸钠作为唯一碳源培养4 d,培养液颜色变为红色,为阳性,表明菌株P-3可以利用柠檬酸盐 (表4)。
表 4 菌株P-3生理生化试验结果Table 4 Physiological and biochemical characteristics of P-3 strain测定项目
Parameter反应结果 Reaction 菌株P-3
P-3 strain大肠杆菌 (对照)
Escherichia coli
(Control)肌醇 Inositol − − 明胶 Gelatin + − 尿素酶 Urease + − 赖氨酸脱羧酶 Lysine decarboxylase + − 精氨酸双水解酶 Arginine dihydrolase + + 苯丙氨酸 Phenylalanine − − 葡萄糖 Glucose − − 阿拉伯糖 Arabinose + + 麦芽糖 Malt dust + + 柠檬酸盐 Citrate + − 注:+. 阳性;−. 阴性;下同。 Note: +. Positive; −. Negative; the same below. 根据形态观察结果和生理生化试验,参照《伯杰细菌系统鉴定手册》和《常见细菌系统鉴定手册》对菌株P-3进行初步鉴定。
在厌氧光照条件下培养物为深红色的光合细菌有红假单胞菌属、红螺菌属和红微菌属,红螺菌属菌体为螺旋状,不具有脱氮能力,生境为淡水环境;红微菌属菌体为卵圆形至柠檬状,依靠周生鞭毛运动,且不能利用柠檬酸盐为碳源;红假单胞菌属的菌体为球形或杆状,单根极生鞭毛运动,不能利用葡萄糖,可以利用柠檬酸盐且具有脱氮作用,生境为海水环境,菌株P-3细胞形态、生理生化特性等与红螺菌属和红微菌属不同,而与红假单胞菌属的形态和生理生化特性一致,初步认为菌株P-3为红假单胞菌 (Rhodopseudomonas sp.,表5)。
表 5 红假单胞菌属菌株P-3鉴别特征Table 5 Identification characteristics of Rhodopseudomonas P-3性状
Characteristics菌株P-3
P-3 strain红假单胞菌属
Rhodopseudomonas sp.红螺菌属
Rhodospirillum sp.红微菌属
Rhodomicrobium sp.细胞大小 Cell size/μm (1.34~1.62) × (0.33~0.59) (0.6~5.0) × (0.4~0.5) 0.8~1.5 (2~2.8) × (1~1.2) 革兰氏染色 Gram stain G− G− G− G− 菌体形态 Strain morphology 杆状 球形或杆状 螺旋状 卵圆形至柠檬状 厌氧光照培养物颜色 Anaerobic lighting culture colour 深红色 深红色 红色至棕色 深红至红褐色 光照厌氧生长 Anaerobic growth under light + + + + 利用葡萄糖 Utilization of glucose − − − − 肌醇 Inositol − − 生境 Habitat 海水 淡水、海水和泥土 淡水 淡水和海水 明胶 Gelatin + ± 柠檬酸钠 Sodium citrate + + ± − 脱氮 Denitrifcation + + − ± 鞭毛 Flagella 极生 极生 极生 周生 注:G−. 革兰氏阴性;±. 部分菌株阳性,部分菌株阴性。 Note: G−. Gram-negative; ±. Some were positive and some were negative. 2.5.3 菌株P-3 16S rDNA序列分析
将菌株P-3的16S rDNA基因序列与NCBI中的序列进行比对,选取同属内同源相似性较高的不同菌株的16S rDNA序列,采用MEGA 7.0软件构建系统发育树,菌株P-3的16S rDNA与多株沼泽红假单胞菌 (R. palustris) 的相似性为99.31%,结果见图7。
3. 讨论
有学者认为光合细菌具有类胡萝卜素[12-13]、细菌叶绿素[14]等光合色素,在光照培养条件下,其培养液大多呈红色、紫色或者绿色等[5],如张小倩等[15]从辽河入海口筛选出1株产红色色素能力较强的红假单胞菌属菌株,王蕊等[16]从凡纳滨对虾 (Litopenaeus vannamei) 池塘水样、底泥中分离到1株类胡萝卜素含量较高的粪红假单胞菌 (R. faecalis)。本研究分离到的3株光合细菌厌氧培养液颜色均为红色,与已有的研究中菌液颜色相符,利用这一特性初步筛选菌株,有助于寻找到更多的光合菌株资源。
弧菌属是水产养殖中一种常见的细菌性病原[17-18],目前用于弧菌病的拮抗菌主要有乳酸菌[19]、芽孢杆菌[20]、光合细菌[21]等。张信娣等[22]研究发现球形红假单胞菌X3在平板扩散法中对水产致病菌有微弱的抑制作用。本研究中的沼泽红假单胞菌对副溶血弧菌、鳗弧菌和创伤弧菌均具有拮抗作用,与张信娣等[22]的研究结果相似。
光合细菌可以吸收水体中的NH4 +-N、硝态氮 (NO3 −-N) 和NO2 −-N,起到改善水质、修复水环境的作用[23-25]。目前对改善养殖环境的光合细菌种类研究颇多,如海洋着色菌 (Marichromatium gracile) [26]、红假单胞菌[27]、类球红细菌 (Rhodobacter sphaeroides) [28]、沙氏外硫红螺菌 (Ectothiorhodospira shaposhnikovii) [29]等,这些光合菌降解效率各不相同。本试验分离筛选得到的菌株P-3与金春英等[30]和刘珍珠等[31]研究的沼泽红假单胞菌降解效果相近。金春英等[30]分离出1株沼泽红假单胞菌CQV97,其对不同质量浓度的NH4 +-N和NO2 −-N最大去除率分别为35%~96%和46.850%~99.998%;刘珍珠等[31]从冰川前缘原生裸地土壤中分离出1株为沼泽红假单胞菌LG,菌株对NH4 +-N的转化率最高为65.71%,对NO3 −-N的转化率为95.58%,已有的研究表明光合细菌在养殖水体的NH4 +-N和亚硝酸盐降解中发挥了重要作用。
本试验分离筛选得到的菌株P-3在NH4 +-N和NO2 −-N质量浓度为50 mg·L−1时,对NH4 +-N和NO2 −-N的降解率分别达89.68%和94.98%,同时对副溶血弧菌、鳗弧菌和创伤弧菌均具有抑制作用,具有复合功能,表现出潜在的开发应用前景。
-
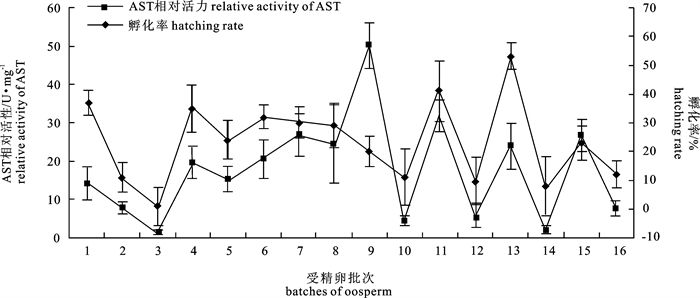
表 1 大菱鲆受精卵取样及亲鱼繁殖性状信息
Table 1 Sampling data and broodstock reproductive characteristics of S.maximus
样品(批次)
sampling batch采样地点
sampling location采样时间
sampling period发育时期
development stage保存状态
preservation state卵径规格/μm
oosperm diameter悬浮率/%
suspensibility受精率*/%
fertilization rate孵化率/%
hatching rateFEQ1 山东烟台 2011.06.01 原肠期 液氮 1 049.66±19.31 96.1±1.3 45.3±9.2 37.0±4.4 FEQ2 山东烟台 2011.06.01 原肠期 液氮 1 051.45±30.62 80.3±5.2 39.7±7.6 11.0±5.2 FEQ3 山东烟台 2011.06.02 原肠期 液氮-沉降卵 1 053.75±26.04 31.6±7.3 40.3±4.8 1.0±6.7 FEQ4 山东烟台 2011.06.02 原肠期 液氮 1 048.61±30.19 53.8±10.2 42.9±9.2 35.0±8.2 FEQ5 山东烟台 2011.06.03 原肠期 液氮 1 060.85±19.99 81.6±5.1 43.8±6.7 24.0±6.9 FEQ6 山东烟台 2011.06.03 原肠期 液氮 1 057.48±10.27 90.5±2.8 38.1±3.5 32.0±4.2 FEQ7 山东烟台 2011.06.04 原肠期 液氮 1 046.27±30.08 78.2±6.8 44.6±9.1 30.0±5.3 FEQ8 山东烟台 2011.06.04 原肠期 液氮 1 055.61±21.73 71.2±3.2 34.9±11.2 29.0±7.8 FEQ9 山东烟台 2011.06.05 原肠期 液氮 1 061.54±14.41 80.3±7.9 43.4±5.4 20.0±5.1 FEQ10 山东烟台 2011.06.05 原肠期 液氮-沉降卵 1 048.98±23.78 52.0±4.3 38.2±6.4 11.0±9.8 FEQ11 山东烟台 2011.06.06 原肠期 液氮 1 052.34±28.93 70.7±5.8 40.6±5.5 41.0±10.4 FEQ12 山东烟台 2011.06.06 原肠期 液氮-沉降卵 1 059.58±18.33 60.2±10.5 41.7±3.2 10.0±7.9 FEQ13 山东烟台 2011.06.07 原肠期 液氮 1 047.59±30.76 83.7±8.8 39.3±8.1 53.0±4.6 FEQ14 山东烟台 2011.06.08 原肠期 液氮-沉降卵 1 059.08±19.77 53.0±11.5 40.0±4.5 8.0±10.2 FEQ15 山东烟台 2011.06.09 原肠期 液氮 1 060.55±12.61 46.2±7.0 38.1±2.8 23.0±5.9 FEQ16 山东烟台 2011.06.10 原肠期 液氮 1 050.36±21.20 15.2±6.6 42.6±7.7 12.0±4.6 注:*. 发育到原肠期的受精卵数/受精卵总数×100%
Note:*. the number of oosperm in gastrulation/ total oosperm ×100%表 2 大菱鲆受精卵谷草转氨酶活力
Table 2 Relative activity of aspartate amino transferase (AST) for S.maximus
样品
sample保存状态
preservation state净质量/g
net weightAST含量/卡门氏
content of ASTρ(总蛋白)/mg·mL-1
content of proteinAST相对活性/U·mg-1
relative activity of ASTFEQ1 液氮 0.19 112.51±8.30 7.974±1.993 14.109±4.164 FEQ2 液氮 0.19 128.78±6.21 16.575±4.140 7.770±1.500 FEQ3 液氮-沉降卵 0.19 14.54±1.12 9.123±2.188 1.594±0.512 FEQ4 液氮 0.19 192.68±10.57 9.892±2.472 19.478±4.276 FEQ5 液氮 0.19 132.23±7.20 8.723±2.182 15.159±3.300 FEQ6 液氮 0.19 154.40±9.63 7.553±1.888 20.441±5.100 FEQ7 液氮 0.19 221.83±11.34 8.285±2.071 26.775±5.467 FEQ8 液氮 0.19 35.92±3.78 1.474±0.369 24.367±10.256 FEQ9 液氮 0.19 174.89±5.17 3.494±0.874 50.053±5.916 FEQ10 液氮-沉降卵 0.19 33.04±2.39 7.552±1.890 4.374±1.264 FEQ11 液氮 0.19 197.35±6.60 6.196±1.549 31.845±4.260 FEQ12 液氮-沉降卵 0.19 33.04±4.31 5.987±1.499 5.518±2.876 FEQ13 液氮 0.19 115.64±7.18 4.832±1.208 23.933±5.943 FEQ14 液氮-沉降卵 0.19 20.19±2.54 10.202±2.550 1.979±0.996 FEQ15 液氮 0.19 243.01±9.39 9.089±2.273 26.736±4.132 FEQ16 液氮 0.19 109.45±7.08 14.267±3.569 7.671±1.983 -
[1] FRIEDRICH C. Physiology and genetics of sulfur-oxidizing bacteria[J]. Adv Microb Physiol, 1998, 39: 235-289. doi: 10.1016/S0065-2911(08)60018-1
[2] SMITH E, MOROWITZ H. Universality in intermediary metabolism[J]. Proc Nat Acad Sci USA, 2004, 101(36): 13168-13173. doi: 10.1073/pnas.0404922101
[3] RØNNESTAD I, FYHN R N, GRAVNINGEN K. The importance of free amino acids to the energy metabolism of eggs and larvae of turbot (Scophthalmus maximus)[J]. Mar Biol, 1992, 114(4): 517-524. doi: 10.1007/BF00357249
[4] MOMMSEN T P, WALSH P J. Vitellogenesis and oocyte assembly[M]//HOAR W S, RANDALL D J. Fish physiology. The physiology of developing fish, eggs and larvae. London: Academic Press, 1988, 11A: 347-406. 10.1016/S1546-5098(08)60202-2
[5] SAKAMI W, HARRINGTON H. Amino acid metabolism[J]. Annu Rev Biochem, 1963, 32: 355-398. doi: 10.1146/annurev.bi.32.070163.002035
[6] BELL G, BURANT C, TAKEDA J, et al. Structure and function of mammalian facilitative sugar transporters[J]. J Biol Chem, 1993, 268(26): 19161-19164. doi: 10.1016/S0021-9258(19)36489-0
[7] SÁNCHEZ-MOLANO E, CERNA A, TORO M A, et al. Detection of growth-related QTL in turbot (Scophthalmus maximus)[J]. BMC Genomics, 2011, 12: 473. doi: 10.1186/1471-2164-12-473
[8] 雷霁霖. 大菱鲆养殖技术[M]. 上海: 上海科学技术出版社, 2003: 5-10. doi: 10.3969/j.issn.1007-9580.2003.01.006 LEI Jilin. The turbot (Scophthalmus maximus) culture technology[M]. Shanghai: Shanghai Science and Technology Press, 2003: 5-10. (in Chinese) doi: 10.3969/j.issn.1007-9580.2003.01.006
[9] JONES A. Sexual maturity, fecundity and growth of the turbot Scophthalmus maximus L[J]. J Mar Biol Assoc UK, 1974, 54(1): 109-125. doi: 10.1017/S0025315400022104
[10] SUQUET M, OMNES M H, NORMANT Y, et al. Assessment of sperm concentration and motility in turbot (Scophthalmus maximus)[J]. Aquaculture, 1992, 101(1/2): 177-185. doi: 10.1016/0044-8486(92)90241-C
[11] GEFFEN A J, FRAYER O. Retention of sperm motility in turbot, Scophthalmus maximus L.: the effects of time from activation, thermal shock and adenosine triphosphate levels[J]. Aquac Manag, 1993, 24(2): 203-209. doi: 10.1111/j.1365-2109.1993.tb00542.x
[12] KJØRSVIK E, HOEHNE-REITAN K, REITAN K I. Egg and larval quality criteria as predictive measures for juvenile production in turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2003, 227(1/2/3/4): 9-20. doi: 10.1016/S0044-8486(03)00492-7
[13] 马爱军, 雷霁霖, 王新安, 等. 大菱鲆亲鱼、配子和仔稚鱼的质量评价[J]. 海洋科学, 2011, 35(1): 98-104. MA Aijun, LEI Jilin, WANG Xinan, et al. Quality assessment of broodstock, sperm, egg, oosperm and larva of turbot (Scophthalmus maximus L.)[J]. Mar Sci, 2011, 35(1): 98-104. (in Chinese)
[14] FAUVEL C, OMNES M H, SQUET M, et al. Enhancement of the production of turbot, Scophthalmus maximus (L.), larvae by controlling overripening in mature females[J]. Aquac Fish Manag, 1992, 23(2): 209-216. doi: 10.1111/j.1365-2109.1992.tb00611.x
[15] OMNES M H, DORANGE G, SUQUET M, et al. Application of staining techniques to improve the viability assessment of turbot (Psetta maxima) ova[C]//NORBERG B. Proceedings of the 6th International Symposium on the Reproductive Physiology of Fish, Bergen, Norway, July 4-9, 1999. Norway: International Symposium on the Reproductive Physiology of Fish, 2000: 435. https://www.researchgate.net/publication/43106959_Application_of_staining_techniques_to_improve_the_viability_assessment_of_turbot_Psetta_maxima_ova
[16] DEVAUCHELLE N, ALEXANDRE J C, Le CORRE N, et al. Spawning of turbot Scophthalmus maximus in captivity[J]. Aquaculture, 1988, 69(1/2): 159-184. doi: 10.1016/0044-8486(88)90194-9
[17] KJØRSVIK E, MANGOR-JENSEN A, HOLMEFJORD I. Egg quality in fishes[J]. Adv Mar Biol, 1990, 26: 71-113. doi: 10.1016/S0065-2881(08)60199-6
[18] AEGERTER S, JALABER B, BOBE J. Large scale real-time PCR analysis of mRNA abundance in rainbow trout eggs in relationship with egg quality and post-ovulatory ageing[J]. Mol Reprod Dev, 2005, 72(3): 377-385. doi: 10.1002/mrd.20361
[19] AVERY T S, KILLEN S S, HOLLINGER T R. The relationship of embryonic development, mortality, hatching success, and larval quality to normal or abnormal early embryonic cleavage in Atlantic cod, Gadus morhua[J]. Aquaculture, 2009, 289(3/4): 265-273. doi: 10.1016/J.AQUACULTURE.2008.12.011
[20] TANDLER A, HAREL M, KOVEN W M, et al. Broodstock and larvae nutrition in gilthead seabream Sparus aurata: new findings on its mode involvement in improving growth, survival and swimbladder inflation[J]. Israel J Aquac, 1995, 47: 95-111. https://xueshu.baidu.com/usercenter/paper/show?paperid=8580c1a4ec41dcc52204093904d02329&site=xueshu_se
[21] PAVLOV D A, MOKSNESS E. Production and quality of eggs obtained from wolffish (Anarhichas lupus L.) reared in captivity[J]. Aquaculture, 1994, 122(4): 295-312. doi: 10.1016/0044-8486(94)90339-5
[22] DIETRICH G J, WOJTCZAK M, SKA M, et al. Broken eggs decrease pH of rainbow trout (Oncorhynchus mykiss) ovarian fluid[J]. Aquaculture, 2007, 273(4): 748-751. doi: 10.1016/j.aquaculture.2007.07.013
[23] BOBE J, LABBÉ C. Egg and sperm quality in fish[J]. Gen Comp Endocrinol, 2010, 165(3): 535-548. doi: 10.1016/j.ygcen.2009.02.011
[24] BROMAGE N, JONES J, RANDALL C, et al. Broodstock management, fecundity, egg quality and the timing of egg production in the rainbow trout (Oncoehynchus mykiss)[J]. Aquaculture, 1992, 100(1/2/3): 141-166. doi: 10.1016/0044-8486(92)90355-O
[25] BONNET E, FOSTIER A, BOBE J. Characterization of rainbow trout egg quality: a case study using four different breeding protocols, with emphasis on the incidence of embryonic malformations[J]. Theriogenology, 2007, 67(4): 786-794. doi: 10.1016/j.theriogenology.2006.10.008
[26] AEGERTER S, JALABERT B. Effects of post-ovulatory oocyte ageing and temperature on egg quality and on the occurrence of triploid fry in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 2004, 231(1/2/3/4): 59-71. doi: 10.1016/j.aquaculture.2003.08.019
[27] DENIEL C. Les poissons plats en baie de Douarnenez. Reproduction, croissance et migration des Bothidac, Scophthalmidae, Pleuronectidae et Soleidae[J]. Thèse dr, Univ Bretagne Occidentale, Brest, 1981, 22: 476. https://www.semanticscholar.org/paper/Les-Poissons-plats-(T%C3%A9l%C3%A9ost%C3%A9ens%2C-Pleuronectiformes)-D%C3%A9niel/4e2cf4289e700f52c92482f8f42f6f1b2d3d0d44
[28] 雷霁霖. 海水鱼类养殖理论与技术[M].北京: 中国农业出版社, 2005: 524-591. https://xueshu.baidu.com/usercenter/paper/show?paperid=2b3b35b9feeb760b39ab1753e08e1a1d&site=xueshu_se LEI Jilin. Marine fish culture theory and technology[M].Beijing: China Agriculture Press, 2005: 524-591. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=2b3b35b9feeb760b39ab1753e08e1a1d&site=xueshu_se
[29] HOWELL R, SCOTT A P. Ovulation cycles and post-ovulatory degradation of eggs of the turbot (Scophthalmus maximus (L.))[J]. Rapports et Procès-Verbaux des Réunions du Conseil International pour l'Exploration de la Mer, 1989, 191: 21-26. https://xueshu.baidu.com/usercenter/paper/show?paperid=f33a036109f1846899c81a056ba36a00&site=xueshu_se
[30] FORES R, IGLESIAS J, OLMEDO M, et al. Induction of spawning in turbot (Scophthalmus maximus L.) by a sudden change in the photoperiod[J]. Aquac Engin, 1990, 9(5): 357-366. doi: 10.1016/0144-8609(90)90026-V
[31] FAUVEL C, OMNÈS M H, SUQUET M, et al. Reliable assessment of overripening in turbot (Scophthalmus maximus) by a simple pH measurement[J]. Aquaculture, 1993, 117(1/2): 107-113. doi: 10.1016/0044-8486(93)90127-K
[32] LAHNSTEINER F, WEISMANN T, PATZNER R A. Physiological and biochemical parameters for egg quality determination in lake trout, Salmo trutta lacustris[J]. Fish Physiol Biochem, 1999, 20(4): 375-388. doi: 10.1023/A:1007715621550
-
期刊类型引用(3)
1. 王晗,卢圣鄂,卓维,亓俊朋,任风鸣. Illumina高通量测序辅助分离鉴定宽体金线蛭肠炎病病原菌. 中国药学杂志. 2025(07): 695-703 .  百度学术
百度学术
2. 田甜,张建明,朱欣,张德志,胡亚成. 50日龄中华鲟幼鱼肠道微生物群落结构特征及其影响因素. 南方水产科学. 2025(02): 102-109 .  本站查看
本站查看
3. 杨飞,汪斌,喻召雄,周治兵,兰松,张中良,周波. 长江鲟源致病性中间气单胞菌的分离鉴定及药敏试验. 西南农业学报. 2024(12): 2787-2792 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:








 粤公网安备 44010502001741号
粤公网安备 44010502001741号
