Study on fermentation conditions for oceanic red yeast strain RH1
-
摘要:
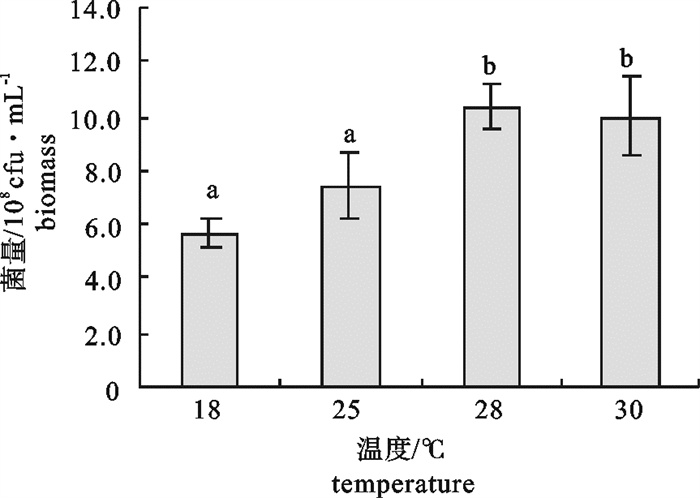
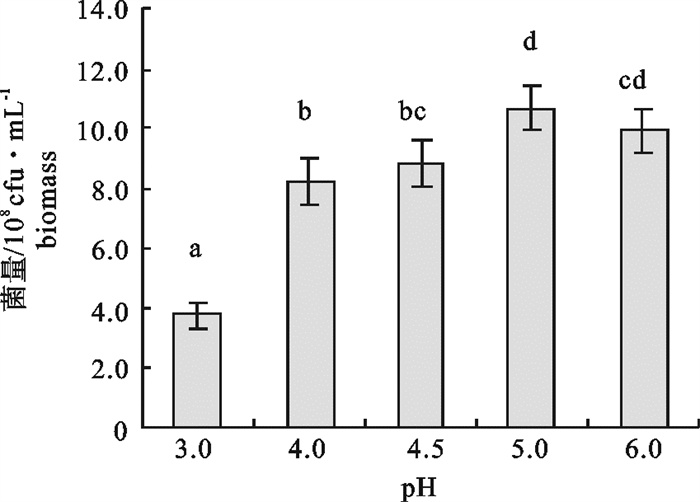
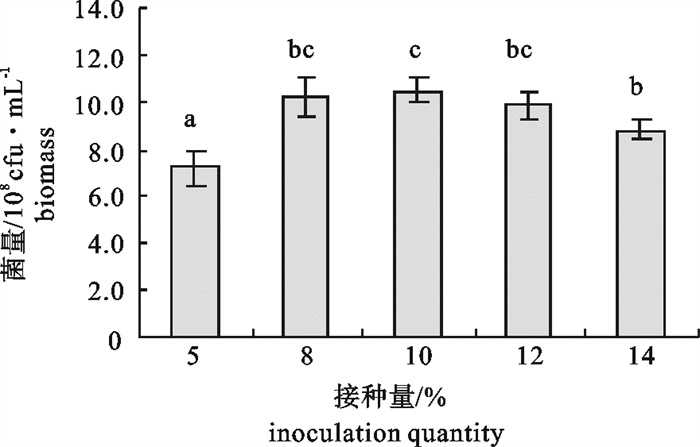
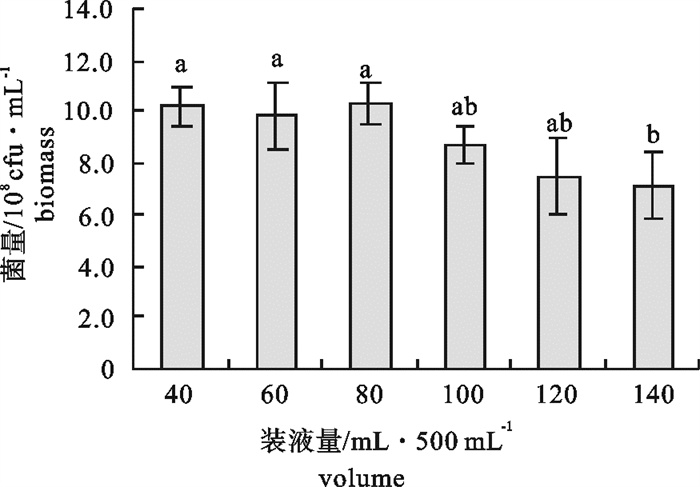
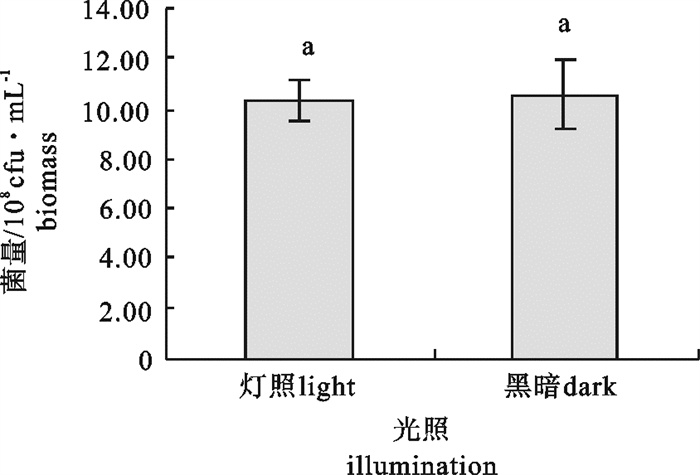
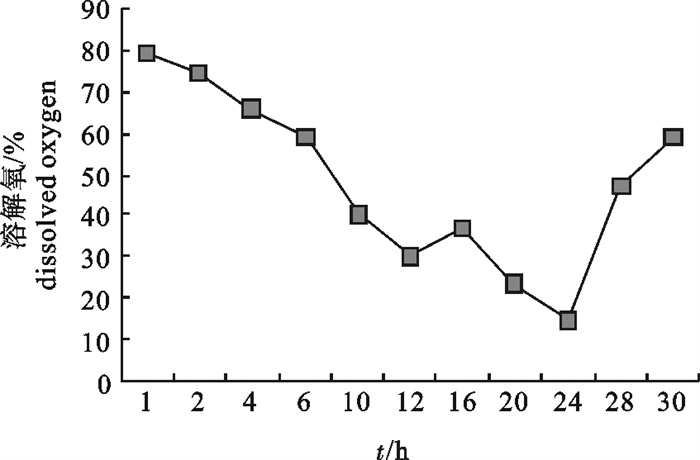
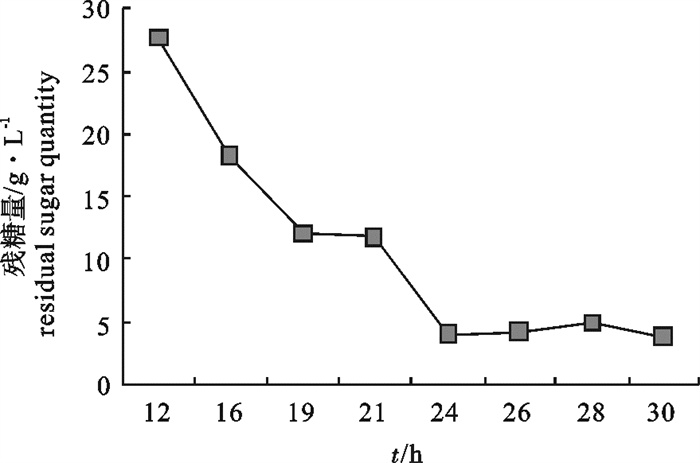
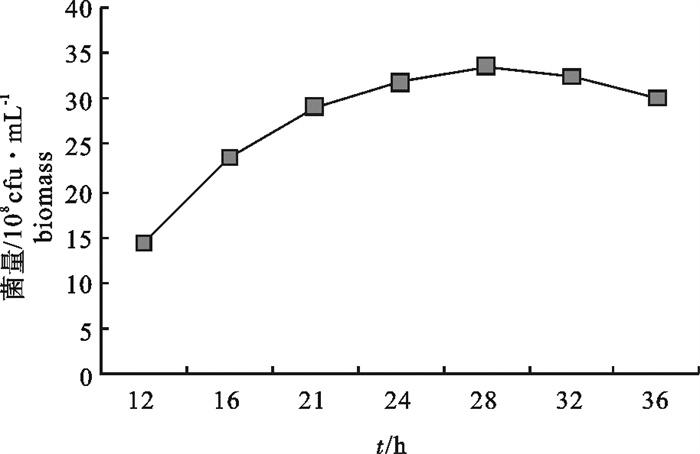
该研究比较了不同碳源、氮源、无机盐对海洋红酵母菌(Rhodotorula sp.)RH1菌株发酵产量的影响,通过葡萄糖、蛋白胨、酵母膏和硫酸镁(MgSO4)4因素3水平的正交试验,确定了RH1菌株的最优培养基为蛋白胨10 g · L-1,酵母膏15 g · L-1,葡萄糖20 g · L-1,MgSO4 0.25 g · L-1,磷酸二氢钾(KH2PO4)0.25 g · L-1,氯化钠(NaCl)10 g · L-1。结果显示,该菌株最佳摇瓶发酵条件为接种量10%,初始pH 5.0,摇瓶装液量80 mL/500 mL三角瓶,培养温度28 ℃,经48 h培养,菌量可达10.46×108 cfu · mL-1,比优化条件前提高23.9%。还进行了RH1菌株25 L发酵罐扩大培养试验,在接种量为8%、初始pH 5.0、搅拌速率350~400 r · min-1、通气量9 L ·min-1、温度28 ℃的条件下,经28 h的培养,菌量可达33.6×108 cfu · mL-1。预计通过连续补料的方式进行培养,有望进一步提高菌量。
Abstract:We compared the effects of different carbon sources, nitrogen sources and inorganic salts on fermentation yield of oceanic red yeast (Rhodotorula sp.)RH1. By 4 factors and 3 levels orthogonal test, the optimum fermentation conditions for RH1 were determined: peptone 10 g · L-1, yeast extract 15 g · L-1, glucose 20 g · L-1, MgSO4 0.25 g · L-1, KH2PO4 0.25 g · L-1, NaCl 10 g · L-1, inoculation amount 10%, initial pH 5.0, temperature 28 ℃, 80 mL medium in 500 mL triangle bottle, and fermentation time 48 h. Under above conditions, the cell biomass of RH1 can reach 10.46×108 cfu · mL-1, which increases by 23.9% as compared with the fermentation before optimization. An experiment of expanded culture is also conducted in a 25 L fermentation tank. The cell biomass of RH1 increased to 33.6×108 cfu · mL-1 in 28 h under the conditions of inoculation amount 8%, initial pH 5.0, revolution speed 350~400 r · min-1, air ventilation volume 9 L · min-1 and temperature 28 ℃. It is expected to further increase the biomass of strain RH1 by continuous filling of the materials.
-
Keywords:
- Rhodotorula sp. /
- culture conditions /
- optimization
-
凡纳滨对虾(Litopenaeus vannamei)是中国重要的经济养殖品种,2014年养殖产量达到157.69×104 t[1]。近年来对虾肝胰腺坏死综合征等病害持续发生,严重影响对虾养殖产业健康发展[2],有学者认为蓝藻等产毒藻类可能是引起对虾肝胰腺坏死的重要因子之一[3]。蓝藻是水体常见的有害藻类,在养殖过程中,大量的残饵和粪便造成养殖水体富营养化水平不断升高[4],蓝藻水华在养殖池塘水体中频频发生[5]。颤藻(Oscillatoria sp.)是蓝藻水华的主要微藻种类之一,已报道的颤藻种类有280多种[6],其中绿色颤藻(Oscillatoria chlorina)分布水域广泛,在淡水及海水养殖池塘均有发现,且常为池塘的优势藻种[7-8]。LEHMAN等[9]发现颤藻可伤害对虾的肝胰脏等,使对虾出现停食、空胃、肝胰脏糜烂等不良症状;曹平等[10]报道质量浓度高于22.5 mg · L-1的颤藻显著降低凡纳滨对虾成活率。目前对绿色颤藻的相关研究主要集中在颤藻治理及防控等方面[11-12],而关于绿色颤藻对凡纳滨对虾危害的机制尚不清楚,该文章研究了绿色颤藻细胞、颤藻粗提液以及颤藻细胞分泌物对凡纳滨对虾的毒性,探索了不同颤藻浓度和不同水温下对虾对颤藻毒素的响应,并对颤藻粗提液的毒性物质做了初步分析,明确了对对虾产生危害的颤藻细胞成分以及颤藻浓度与水温对颤藻毒性的影响,为对虾健康养殖和颤藻防控提供依据。
1. 材料与方法
1.1 养殖系统
养殖实验系统由18个直径为60 cm,高为120 cm的塑钢养殖桶组成。水体盐度36,pH 7.6~7.8。养殖用水经多级沙滤和含氯消毒剂进行处理,曝气24 h,显微镜检测确保水体中无微藻。实验对虾取自深圳市高位池养殖的健康凡纳滨对虾,实验前对虾暂养7 d,每天投喂3次全人工配合饲料,每天换30%水量,以充气方式将溶解氧控制在6.8~7.2 mg · L-1。实验对虾体长(7.1±1.0)cm,体质量(3.6±0.5)g。
1.2 微藻培养与粗提取液制备
绿色颤藻由中国水产科学研究院南海水产研究所提供,以BG11培养基在25 ℃和1 500 lx条件下进行扩大培养。
收集处于对数生长期的颤藻细胞,4 000 r ·min-1离心10 min,以无菌磷酸缓冲液(phosphate buffer saline,PBS)重复洗涤3次。以PBS作溶剂分别配制湿藻质量浓度为25.2 mg · mL-1(C1)、5.04 mg · mL-1(C2)、2.52 mg · mL-1(C3)、0.504 mg · mL-1(C4)、0.252 mg · mL-1(C5)的藻液。将不同浓度的藻液置于冰上,在功率100 W下超声破碎20 min(新芝JY92-ⅡDN),然后在4 ℃、6 000 r · min-1的条件下离心10 min,收集上清液获得不同浓度的颤藻粗提液(参照GB/T 57050.8—2006改进)。
1.3 实验设计
1.3.1 不同颤藻细胞组分对对虾的致死效应
对虾随机分为实验组与对照组,每组设3平行,每平行各30尾对虾。实验组分别注射湿藻质量浓度约为5.04 mg · mL-1的颤藻细胞、颤藻粗提液和藻细胞培养液,每尾注射50 μL,对照组注射等体积的无菌PBS。注射后,对虾放养在体积150 L、水温28 ℃水体中,每隔0.5 h观察对虾成活情况,并记录对虾死亡数量及死亡时间。
1.3.2 不同浓度颤藻粗提液对对虾的致死效应
对虾随机分为实验组与对照组,每组设3平行,每平行各30尾对虾。取浓度分别为C1、C2、C3、C4和C5的颤藻粗提液对实验组对虾进行攻毒,每尾注射50 μL,对照组注射等体积的无菌PBS。注射后,对虾放养在体积150 L、水温28 ℃水体中,每隔0.5 h观察对虾存活情况,并记录对虾死亡数量及死亡时间。
1.3.3 不同温度下对虾对颤藻毒素的响应
参考对虾养殖生产季节的水温变化范围[13],以恒定控温棒先将实验水体的水温稳定控制在22 ℃、28 ℃、34 ℃ 3个梯度。再根据1.3.2的结果,选取湿藻质量浓度为2.52 mg · mL-1的颤藻粗提液注射对虾,对照组注射等体积的无菌PBS。注射后,对虾放养在体积150 L水体中,每隔0.5 h观察对虾存活情况,并记录对虾死亡数量及死亡时间。
1.4 颤藻毒素的提取与检测
1.4.1 颤藻毒素提取
参照生活饮用水标准检验方法(GB/T 57050.8—2006),称取湿藻质量0.540 g颤藻细胞,加入10 mL 70%甲醇,超声破碎20 min(功率100 W),6 000 r · min-1离心10 min,收集上清液,沉淀再加入10 mL 70%甲醇超声提取1次,合并2次提取上清液,于50 ℃水浴中氮吹除去甲醇。管中剩余液体过C18小柱(预先用5 mL甲醇、5 mL水活化),用3 mL 20%甲醇润洗离心管,洗液一并过小柱,然后再加3 mL 20%甲醇淋洗小柱,用3 mL甲醇洗脱小柱,收集洗脱液,用去离子水定容至5 mL,-20 ℃保存待测。样品制备重复3次,每次均设3个平行。
1.4.2 颤藻毒素检测
参照GB/T 57050.8—2006微囊藻检测方法,选用高效液相色谱法(high performance liquid chromatography,HPLC)检测颤藻毒素。微囊藻毒素混合标准品(MC-RR/YR/LR)加入1 mL甲醇溶解,配制成250 μg · mL-1母液。取一定量母液用50%甲醇梯度稀释,分别配制质量浓度为5 μg · mL-1、2.5 μg · mL-1、0.5 μg · mL-1、0.25 μg · mL-1、0.1 μg · mL-1的标准液。使用液相色谱仪(岛津SHIMADZU LC-20A)对标准液和颤藻粗提液预处理样品进行检测。
1.5 数据分析
死亡率(%)=(死亡数量/实验初总数量)×100
死亡速率=死亡数量/时间
所得实验数据均以平均值±标准差(X±SD)表示,用SPSS 11.0进行方差分析(ANOVA)和Duncan多重比较,P < 0.05表示差异显著,以Pearson进行指标的相关性分析。
2. 结果与分析
2.1 颤藻细胞、颤藻粗提液及藻细胞培养液对对虾的毒性效应
注射PBS及藻细胞培养液组对虾未出现死亡,注射颤藻细胞后12 h内对虾受影响较小,死亡率仅为2.22%,12 h后对虾死亡率开始大幅度上升,72 h后对虾全部死亡(图 1)。对虾在注射颤藻粗提液后立即出现死亡,12 h后死亡率达到22.09%,72 h后死亡率为91.04%,实验结束时(第168小时),对虾死亡率为93.72%。可见藻细胞培养液对凡纳滨对虾的成活率没有影响,颤藻细胞及颤藻粗提液能够显著降低对虾的成活率(P < 0.05),且颤藻粗提液发挥毒性效应比颤藻细胞更迅速。实验结束时颤藻细胞注射组和颤藻粗提液注射组对虾累计死亡率之间没有明显差异(P>0.05),综上分析,颤藻对对虾的危害成分主要是颤藻粗提物所含的有毒物质。
2.2 颤藻粗提液对对虾的毒性效应
PBS注射组对虾未出现死亡,实验组对虾注射颤藻粗提液后,除C5组之外,其余各组对虾均出现不同程度的死亡(图 2)。C1和C2组对虾死亡率在第12小时高达100%和97.78%,第168小时C2组也达到100%;C3组的对虾死亡率略低于C1、C2组,第12小时为62.22%,第168小时达到86.67%;C4组对虾死亡率大幅降低,第12小时为1.11%,第168小时也仅为2.22%,与C1、C2和C3组对虾累计死亡率差异极其显著(P < 0.01)。由此可见,颤藻粗提液的毒性具有显著的浓度效应,随着颤藻粗提液浓度升高,对虾的死亡率和死亡速率都明显上升,且颤藻粗提液致对虾死亡必须高于一定范围的浓度,致死质量浓度应该在0.504~2.52 mg · mL-1范围内。
2.3 温度对对虾响应颤藻粗提液毒性的影响
22 ℃、28 ℃和34 ℃条件下对虾注射PBS后均未出现死亡,注射2.52 mg · mL-1的颤藻粗提液后对虾出现不同程度的死亡(图 3)。22 ℃组对虾在注射后0~6 h期间未出现死亡,24 h死亡率为10.0%,168 h达到20.0%;28 ℃组对虾在注射后0~6 h期间同样未出现死亡,24 h死亡率为60.0%,168 h达到82.2%;34 ℃组对虾在注射后立即死亡,6 h死亡率为43.47%,24 h死亡率为93.47.3%,168 h达到97.8%。可见,在温度较低时,粗提液对对虾致死效应相对微弱,随着水温上升,对虾注射粗提液后死亡率显著提高(P < 0.05)。所以水温的升高可以显著增强颤藻粗提液对凡纳滨对虾的毒性,表明当养殖对虾受到颤藻毒性胁迫时,温度越高,对虾的死亡率越高。所以在高温季节养殖对虾应该把蓝藻作为水体环境的重要监测指标加以严格控制。
2.4 颤藻粗提液有毒物质的检测
微囊藻毒素是蓝藻细胞产生的最常见的毒性物质之一,HPLC是检测微囊藻毒素最常用的方法,其最低检测质量浓度为0.06 μg · L-1。混合标准品MC-RR/YR/LR检测标准曲线如图 4所示,y=18 705x(MC-RR)-355.55,y=16 326x(MC-YR)-306.46,y=19 163x(MC-LR)+281.29,x为标准品的浓度,y为峰面积,曲线的拟合度系数(R2)分别为0.999 5、0.999 7、1.000 0,标准曲线线性关系良好。如图 5所示,MC-RR、MC-YR和MC-LR标准品的保留时间分别为8.5~9.2 min,9.2~9.8 min和10.6~11.6 min。而湿藻质量浓度为108.0 mg · mL-1颤藻粗提取液HPLC检测结果显示,样品在8.5~11.6 min内均没有出现特异的吸收峰,峰面积接近于零,说明样品中未检测到MC-RR/YR/LR(图 6)。所以颤藻粗提液致对虾死亡的毒性物质并非是MC-RR/YR/LR等常见的微囊藻毒素,其所含有的毒性物质具体为何种藻毒素有待进一步研究。
3. 讨论
颤藻隶属于蓝藻门,蓝藻纲,颤藻目,颤藻科,多生活在含氮量高、有机质丰富的高温水体中,是池塘常见的有害微藻之一[6, 14]。彭聪聪等[8]调查发现对虾养殖池塘后期颤藻密度能够达到108~109个· L-1,颤藻数量、生物量超过浮游微藻总量的50%以上,微藻多样性指数低的池塘对虾容易发病。颤藻水华极易引发“倒藻”,可导致大量羟胺、硫化物等有毒物质释放,会造成对虾因应激致病而死亡[15],曹平等[10]发现颤藻能够抑制对虾生长,降低对虾成活率。该研究同样发现颤藻细胞及其粗提液对凡纳滨对虾具有急性毒性,而颤藻细胞分泌物对对虾无致死效应,有学者曾报道颤藻粗提取物会导致小鼠生长缓慢,肝脏肿大[16]。颤藻等蓝藻细胞最大的危害是能够产生微囊藻毒素等蓝藻毒素,而蓝藻毒素主要是细胞内毒素,当细胞破裂或藻类腐烂分解后,毒素才会被释放到水体中[17]。该研究颤藻细胞注射组与粗提液注射组之间对虾死亡率无明显差异,推测致对虾死亡的毒性物质可能是微囊藻毒素。实验结果还显示粗提液致死效应随着颤藻细胞浓度增加而显著增强(P < 0.01),说明毒素浓度随着藻细胞浓度上升而升高,穆丽娜等[18]发现MC-LR浓度与蓝藻细胞数量密切相关。
水温是影响对虾对颤藻粗提液毒性的响应另一个重要因子,研究结果显示当水温从22 ℃上升至34 ℃,对虾注射颤藻粗提液后死亡率从20.00%急剧增加至97.78%,致死效应时间从6 h缩短至30 min,差异显著(P < 0.05),推测可能是水温影响了对虾对有毒物质的吸收和运输。蔡诤等[19]报道水温升高可以提升水产动物的吸收和代谢能力,从而增强和加速丁香酚对日本囊对虾(Marsupenaeus japonicus)的麻醉效果;梅景良等[20]也提出水温能够通过影响牛蛙(Rana catesbiana)心脏活动、血液循环而抑制或增强药物的效应。温度还可以直接影响藻类毒性,VANDER和ELOFF[21]研究发现,在一定温度范围内,温度升高显著增强铜绿微囊藻毒性,但有关温度与藻类产毒关系的报道并不统一。LEE等[22]发现温度和微囊藻毒素产量呈负相关;吴和岩等[23]报道铜绿微囊藻细胞内产毒量在20 ℃最高;而吴溶等[24]报道铜绿微囊藻的藻毒素最佳释放条件为28℃,推测这些差异可能由于藻种不是相同一株所导致。该研究使用的颤藻菌株产毒量与温度之间的关系尚待进一步的探究。
微囊藻毒素(Microcystin,MC)是最常见的蓝藻毒素之一,目前已报道的微囊藻毒素有70余种异构体,其中MC-RR、MC-YR和MC-LR最为常见,多由颤藻、微囊藻等蓝藻细胞产生[17, 25]。该研究检测结果表明,实验使用的颤藻粗提液未含有MC-RR/YR/LR,推测实验颤藻株产生的毒素可能是其他亚型微囊藻毒素,或是其他类型毒素。HITZFELD等[26]曾报道颤藻可以产生鱼腥藻毒素-a及其同系物等神经毒素。
近年来,对虾养殖发生了严重的病害,检测出多种病原[27-28],有学者提出这可能是由于养殖密度急剧增加,导致水体富营养化严重,蓝藻易形成优势种群,蓝藻水华暴发频繁,降低了对虾抗病能力,容易被病原侵染而发生病害[29-31]。该研究结果表明,高浓度的颤藻粗提液(≥2.52 mg · mL-1)可以造成对虾大量死亡,且随着藻细胞浓度和水温升高,致死效应显著增强。在养殖生产过程中,随着养殖持续,池塘水体积累大量的残饵、代谢产物等有机物,水温也逐渐上升,在养殖中后期颤藻细胞具有较高的生态竞争能力,大量繁殖形成水华[7-8, 13],危害对虾健康生长。因此,对虾养殖过程中必须防控颤藻等有害微藻的大量繁殖,尤其在高温季节需要采用正确有效的养殖管理措施。有研究报道,可以通过定向培养有益微藻种群或者添加芽孢杆菌(Bacillus licheniformis)[32],竞争营养物质,抑制颤藻等有害微藻的生长,或是添加蓝藻溶藻细菌,特异性杀灭有害蓝藻[33-34],这是对虾健康养殖的重要措施之一。
-
表 1 培养基的碳源及添加质量浓度
Table 1 Carbon source and its concentration in medium
g · L-1 碳源
carbon source葡萄糖
glucose蔗糖
sucrose糖蜜
molasses葡萄糖+蔗糖
glucose+ sucrose葡萄糖+糖蜜
glucose+ molasses蔗糖+糖蜜
sucrose+ molasses添加质量浓度
concentration20 20 20 10+10 10+10 10+10 表 2 培养基的氮源及添加质量浓度
Table 2 Nitrogen source and its concentration in medium
g · L-1 氮源
nitrogen source蛋白胨
peptone酵母膏
yeast extract硫酸铵
(NH4)2SO4氯化铵
NH4Cl豆粕
soybean meal蛋白胨+酵母膏
peptone+ yeast extract蛋白胨+硫酸铵
peptone+ (NH4)2SO4酵母膏+硫酸铵
yeast extract +(NH4)2SO4添加质量浓度
concentration10 10 10 10 10 5+5 5+5 5+5 表 3 培养基的无机盐及添加质量浓度
Table 3 Inorganic salt and its concentration in medium
g · L-1 无机盐
inorganic salt磷酸二氢钾
KH2PO4硫酸镁
MgSO4氯化钙
CaCl2磷酸二氢钾+硫酸镁
KH2PO4+ MgSO4磷酸二氢钾+硫酸镁+氯化钙
KH2PO4+ MgSO4+ CaCl2添加质量浓度
concentration0.5 0.5 0.5 0.25+0.25 0.5+0.25+0.1 表 4 正交试验因素水平
Table 4 Factors and levels of orthogonal test
水平
level因素factor (A)硫酸镁/g·L-1
MgSO4(B)葡萄糖/g·L-1
glucose(C)酵母膏/g·L-1
yeast extract(D)蛋白胨/g·L-1
peptone1 0.25 15 5 5 2 0.50 20 10 10 3 0.75 25 15 15 表 5 碳源对RH1菌量的影响
Table 5 Effect of carbon sources onbiomass of RH1
108 cfu · mL-1 碳源carbon source 菌量biomass 葡萄糖glucose 6.79±0.79a 蔗糖sucrose 4.78±0.48bc 糖蜜molasses 5.43±0.56abc 葡萄糖+蔗糖glucose+sucrose 4.99±0.67bc 葡萄糖+糖蜜glucose+molasses 5.73±0.90ab 蔗糖+糖蜜sucrose+molasses 3.64±0.94c 注:表格中的数值是3次平行试验的平均值,数据后不同上标字母表示5%显著水平。后表同此
Note:Values are expressed as average of 3 replicates; values with different superscript letters within the same column are significantly different(P<0.05). The same case in the following tables.表 6 氮源对RH1菌量的影响
Table 6 Effect of nitrogen sources on biomass of RH1
108 cfu · mL-1 氮源nitrogen source 菌量biomass 蛋白胨peptone 4.13±0.64a 酵母膏yeast extract 6.89±0.68b 硫酸铵(NH4)2SO4 1.34±0.63c 氯化铵NH4Cl 1.18±0.76c 豆粕soybean meal 1.35±0.49c. 蛋白胨+酵母膏peptone+yeast extract 7.13±1.18b 蛋白胨+硫酸铵peptone+(NH4)2SO4 3.87±0.78a 酵母膏+硫酸铵yeast extract+(NH4)2SO4 4.04±0.92a 表 7 无机盐对RH1菌量的影响
Table 7 Effect of inorganic salts on biomass of RH1
108 cfu · mL-1 无机盐inorganic salt 菌量biomass 磷酸二氢钾KH2PO4 4.43±0.33a 硫酸镁MgSO4 6.14±1.17ab 氯化钙CaCl2 4.22±0.76a 磷酸二氢钾+硫酸镁
KH2PO4+MgSO46.90±0.47b 磷酸二氢钾+硫酸镁+氯化钙
KH2PO4+MgSO4+CaCl25.27±1.27ab 表 8 正交试验结果分析
Table 8 Results of analysis of orthogonal test
108 cfu · mL-1 编号
No.A B C D 菌量
biomass1 1 1 1 1 6.04 2 1 2 2 2 8.44 3 1 3 3 3 4.60 4 2 1 2 3 4.08 5 2 2 3 1 6.76 6 2 3 1 2 5.92 7 3 1 3 2 7.32 8 3 2 1 3 3.64 9 3 3 2 1 5.56 k1 6.36 5.82 5.20 6.12 k2 5.58 6.28 6.02 7.22 k3 5.50 5.36 6.22 4.10 R 0.86 0.92 1.02 3.12 -
[1] BON J A, LEATHERS T D, JAYASWAL R K. Isolation of astaxanthin-overproducing mutants of Phaffia rhodozymal[J]. Biotechnol Lett, 1997, 19(2): 109-112. doi: 10.1023/A:1018391726206
[2] 刘秀莲, 王宇光. 海洋红酵母的研究进展[J]. 生物技术通讯, 2008, 19(2): 293-295. doi: 10.3969/j.issn.1009-0002.2008.02.039 LIU Xiulian, WANG Yuguang. Advance in the research of the Rhodotorula benthica[J]. Lett Biotechnol, 2008, 19(2): 293-295. (in Chinese) doi: 10.3969/j.issn.1009-0002.2008.02.039
[3] 李臣, 阮榕生, 林向阳, 等. 红酵母菌的性质及其应用研究[J]. 农产品加工学刊, 2006(5): 20-25. https://xueshu.baidu.com/usercenter/paper/show?paperid=fa4a63f19e6e7d35176171adfd4a8ee8&site=xueshu_se&hitarticle=1 LI CHEN, RUAN Rongsheng, LIN Xiangyang, et. al. Advances in research of properties and application of Rhodotorula[J]. Acad Periodic Farm Prod Process, 2006(5): 20-25. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=fa4a63f19e6e7d35176171adfd4a8ee8&site=xueshu_se&hitarticle=1
[4] 赵述淼, 韩继宏. 谈酵母在水产养殖上的应用[J]. 中国水产, 2003(7): 68-69. doi: 10.3969/j.issn.1002-6681.2003.07.052 ZHAO Shumiao, HAN Jihong. The application of marine red yeast in aquaculture[J]. China Fish, 2003(7): 68-69. (in Chinese) doi: 10.3969/j.issn.1002-6681.2003.07.052
[5] 王伟霞, 李福后, 浦寅芳. 海洋红酵母产类胡萝卜素的研究[J]. 食品研究与开发, 2007, 28(10): 55-58. doi: 10.3969/j.issn.1005-6521.2007.10.018 WANG Weixia, LI Fuhou, PU Yinfang. Investigation on Carotenoids from marine Rhodotorula sp. [J]. Food Res Dev, 2007, 28(10): 55-58. (in Chinese) doi: 10.3969/j.issn.1005-6521.2007.10.018
[6] 王宇光, 雷禄旺, 刘秀莲, 等. 海南海域海洋红酵母的分离鉴定和应用性能评价[J]. 中国农学通报, 2009, 25(22): 324-328. https://xueshu.baidu.com/usercenter/paper/show?paperid=c06033e9e502a2e636e932738625631e&site=xueshu_se&hitarticle=1 WANG Yuguang, LEI Luwang, LIU Xiulian, et. al. Isolation and identification of Rhodotorula in Hainan sea area and evaluation of its application performance[J]. Chin Agric Sci Bull, 2009, 25(22): 324-328. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=c06033e9e502a2e636e932738625631e&site=xueshu_se&hitarticle=1
[7] 童应凯, 韦东胜, 刘婷, 等. 海洋红酵母菌培养条件的研究[J]. 食品研究与开发, 2006, 27(8): 75-79. doi: 10.3969/j.issn.1005-6521.2006.08.023 TONG Yingkai, WEI Dongsheng, LIU Ting, et al. Study on fermentation conditions in Rhodotorual benthica[J]. Food Res Dev, 2006, 27(8): 75-79. (in Chinese) doi: 10.3969/j.issn.1005-6521.2006.08.023
[8] 王普, 裘娟萍, 郑裕国, 等. 高产虾青素的红发夫酵母菌种的选育[J]. 微生物学通报, 2002, 29(1): 15-19. doi: 10.3969/j.issn.0253-2654.2002.01.004 WANG Pu, QIU Juanping, ZHENG Yuguo, et al. Breeding of Phaffia rhodozyma for astaxanthin over-production[J]. Microbiology, 2002, 29(1): 15-19. (in Chinese) doi: 10.3969/j.issn.0253-2654.2002.01.004
[9] 吴江, 刘子贻. 法夫红酵母高产虾青素菌株的研究概况[J]. 生物技术通报, 1999(4): 23-25. doi: 10.3969/j.issn.1002-5464.1999.04.006 WU Jiang, LIU Ziyi. The survey of astaxanthin high-producing stains of Phattia rhodozyma[J]. Biotechnol Info, 1999(4): 23-25. (in Chinese) doi: 10.3969/j.issn.1002-5464.1999.04.006
[10] MISAWA N, SHIMADA H. Metabolic engineering for the production of carotenoids in non-carotenogenic bacteria and yeasts[J]. Biotechnology, 1998, 59(3): 169-181. https://xueshu.baidu.com/usercenter/paper/show?paperid=bba15988eb99de03bd640859916aee0b&site=xueshu_se
[11] NAGAHAMA T, HAMAMOTO M, NAKASE T, et al. Rhodotorula benthica sp. nov. and Rhodotorula calyptogenae sp. nov., novel yeast species from animals collected from the deep-sea floor, and Rhodotorula lysiniphia sp. nov., which is related phylogentically[J]. Int J Syst Evol Microbiol, 2003, 53(3): 897-903. doi: 10.1099/ijs.0.02395-0
[12] 陈昌福, 姚鹃, 肖雪生. 海洋1号红酵母饲养日本对虾幼虾的效果[J]. 淡水渔业, 2004, 34(6): 55-57. doi: 10.3969/j.issn.1000-6907.2004.06.020 CHEN Changfu, YAO Juan, XIAO Xuesheng. The effect of the No. 1 marine red yeast on feeding juvenile Japanese prawn[J]. Freshwater Fish, 2004, 34(6): 55-57. (in Chinese) doi: 10.3969/j.issn.1000-6907.2004.06.020
[13] 李爱娟, 何伯峰, 李光. 海洋红酵母在水产养殖中的应用[J]. 齐鲁渔业, 2007, 24(12): 62. https://xueshu.baidu.com/usercenter/paper/show?paperid=15bebaa662142a362b35988dfb78bbc7&site=xueshu_se LI Aijuan, HE Bofeng, LI Guang. The application of marine red yeast in aquaculture[J]. Shandong Fish, 2007, 24(12): 62. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=15bebaa662142a362b35988dfb78bbc7&site=xueshu_se
[14] 杨秋明, 蔡慧农, 宁思扬, 等. 海洋红酵母产虾青素培养基优化的初步研究[J]. 微生物学杂志, 2007, 27(1): 72-75. doi: 10.3969/j.issn.1005-7021.2007.01.017 YANG Qiuming, CAI Huinong, NING Siyang, et. al. Medium optimization of astaxanthin by oceanic red yeast[J]. J Microbiol, 2007, 27(1): 72-75. (in Chinese) doi: 10.3969/j.issn.1005-7021.2007.01.017
[15] 张超, 刘军. SCP生产菌海洋红酵母摇瓶培养研究[J]. 四川轻化工学院学报, 2000, 13(3): 71-74. https://xueshu.baidu.com/usercenter/paper/show?paperid=d8cd7a827caac2562c59b3748b06d684&site=xueshu_se ZHANG Chao, LIU Jun. Study on the culture in flask scale of SCP-producing stain oceanic red yeast[J]. J Sichuan Inst Light Ind Chem Technol, 2000, 13(3): 71-74. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=d8cd7a827caac2562c59b3748b06d684&site=xueshu_se
[16] 张志军, 江晓路, 张婷婷, 等. 海洋红酵母Rhodotorula sp. 06产胡萝卜素的研究[J]. 食品工业科技, 2007, 28(11): 123-125, 131. doi: 10.3969/j.issn.1002-0306.2007.11.037 ZHANG Zhijun, JIANG Xiaolu, ZHANG Tingting, et al. The study on carotenoids production by marine Rhodotorula sp. 06[J]. Sci Technol Food Ind, 2007, 28(11): 123-125, 131. (in Chinese) doi: 10.3969/j.issn.1002-0306.2007.11.037
[17] 钱铭镛. 发酵工程最优化控制[M]. 南京: 江苏科学出版社, 1998: 306-309. https://xueshu.baidu.com/usercenter/paper/show?paperid=9cf151481a62d6ee949df004d4628168&site=xueshu_se&hitarticle=1 QIAN Mingyong. The optimization of fermentation engineering[M]. Nanjing: Jiangsu Science Press, 1998: 306-309. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=9cf151481a62d6ee949df004d4628168&site=xueshu_se&hitarticle=1
[18] 李宁, 柯晓静, 林场, 等. 产β胡萝卜素红酵母的筛选及其发酵废糖蜜的研究[J]. 农产品加工学刊, 2009(6): 43-45, 48. https://xueshu.baidu.com/usercenter/paper/show?paperid=5775c8dd5da5d893a6226c6651816dd5&site=xueshu_se&hitarticle=1 LI Ning, KE Xiaojing, LIN Chang, et al. Screening of Rhodotorula producing β-carotene and fermentation with wasted molasses[J]. Acad Periodic Farm Prod Process, 2009(6): 43-45, 48. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=5775c8dd5da5d893a6226c6651816dd5&site=xueshu_se&hitarticle=1
[19] 张超. 补料分批培养海洋红酵母的研究[J]. 四川轻化工学院学报, 2000, 13(2): 26-30. https://xueshu.baidu.com/usercenter/paper/show?paperid=163x0gt0fj4d08t04c2v0ju0tk332020&site=xueshu_se&hitarticle=1 ZHANG Chao. Study on fed-batch culture of oceanic red yeast[J]. J Sichuan Inst Light Ind Chem Technol, 2000, 13(2): 26-30. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=163x0gt0fj4d08t04c2v0ju0tk332020&site=xueshu_se&hitarticle=1
[20] BHOSALE P, GADRE R V. Production of β-carotene by a Rhodotorula guutinis mutant in sea water medium[J]. Bioresour Technol, 2001, 76(1): 53-55. doi: 10.1016/S0960-8524(00)00075-4
-
期刊类型引用(15)
1. 张华锋,罗纲,张瑞芳,侯学龙,翟婷婷,琚鸿睿. 液质联用法同时测定猪肉中磺胺类和喹酮类药物残留. 食品安全导刊. 2024(17): 79-83 .  百度学术
百度学术
2. 张丹鹤,周莹莹,刘定舟,朱欣欣,崔倩倩,贾松涛,赵林萍. 鸡肉中三种喹诺酮药物残留检测的不确定度评定. 现代食品. 2022(14): 214-218 .  百度学术
百度学术
3. 梁大伟,王悦秋,谭琳. 恩诺沙星-d_5的合成. 化学试剂. 2019(02): 190-193 .  百度学术
百度学术
4. 李卿沛,王吉河,张妍,代春梅. 高效液相色谱串联质谱法测定猪肉中磺胺甲恶唑不确定度的评定. 农业科技与信息. 2019(11): 54-56+61 .  百度学术
百度学术
5. 张昊,冯家力,陈东洋,袁春晖,曾栋,刘先军,李帮锐. 凝胶渗透色谱-液相色谱法测定沉积物中多环芳烃的不确定度评定. 实用预防医学. 2019(10): 1201-1205 .  百度学术
百度学术
6. 蓝草,邹游,欧阳少伦,吴映璇,邵琳智. 液相色谱-串联质谱法测定动物源性食品中硝基咪唑类药物残留量的不确定度评估. 农产品加工. 2017(04): 35-40+44 .  百度学术
百度学术
7. 李华,杨娟,陈黎. 超高液相色谱-串联质谱法测定猪肉中8种喹诺酮类兽药残留的不确定度评定. 食品安全质量检测学报. 2017(08): 3237-3243 .  百度学术
百度学术
8. 蒋翠红. HPLC法和HPLC-MS/MS法检测水产品中喹诺酮类药物的方法比较. 农技服务. 2016(01): 102 .  百度学术
百度学术
9. 张燕,徐幸,郭启新,舒平,赵用,杨朝义,赵燕娜. 高效液相色谱-串联质谱法测定牛奶中3种磺胺类药物残留不确定度的评定. 食品安全质量检测学报. 2015(01): 303-309 .  百度学术
百度学术
10. 张信仁,唐庆强,张云. 液相色谱-串联质谱法测定鳗鱼中甲苯咪唑含量的不确定度评定. 食品安全质量检测学报. 2015(05): 1713-1718 .  百度学术
百度学术
11. 吴健,朱峰,吉文亮,李放,阮丽萍,刘华良. 高效液相色谱-质谱联用法同时检测水体中14种喹诺酮类药物残留. 食品安全质量检测学报. 2015(12): 4966-4974 .  百度学术
百度学术
12. 张惠峰,綦天华. 高效液相色谱法测定水产品中甲基睾酮残留量的不确定度评定. 食品科学. 2015(18): 199-203 .  百度学术
百度学术
13. 彭家杰,李绪鹏,莫炯怀,邹潍力,卢伟华. HPLC法水产品中诺氟沙星盐酸环丙沙星恩诺沙星残留量的不确定度评定. 农业与技术. 2014(06): 23-25 .  百度学术
百度学术
14. 杨金兰,李刘冬,陈培基,黎智广,黄珂,王强,杨宏亮. 高效液相色谱法测定罗非鱼中孔雀石绿残留量的不确定度. 广东海洋大学学报. 2013(06): 62-66 .  百度学术
百度学术
15. 曹爱英,张园,赵春晖,王秀林,潘勇,李英,宗超,曹洁. 液质联用法测定水产品中泰乐霉素含量不确定度评价. 中国渔业质量与标准. 2013(04): 21-24 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
