Determination of 7 macrolide antibiotic residues in aquatic products by HPLC-MS/MS
-
摘要:
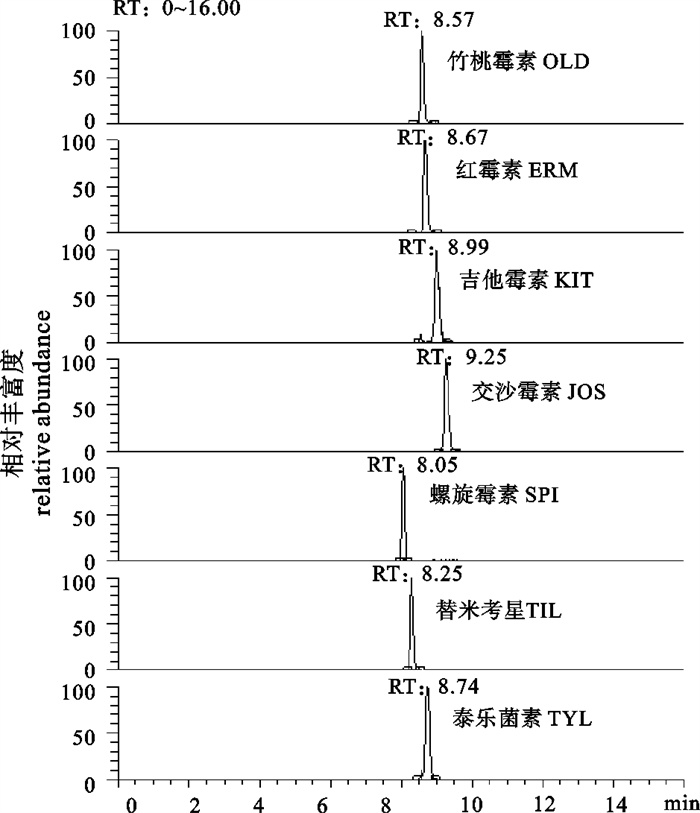
建立了水产品中7种大环内酯类抗生素[竹桃霉素(OLD)、红霉素(ERM)、吉他霉素(KIT)、交沙霉素(JOS)、螺旋霉素(SPI)、替米考星(TIL)和泰乐菌素(TYL)]残留检测的HPLC-MS/MS法。样品经乙腈提取,中性氧化铝和正己烷净化后,以选择反应检测模式检测,基质匹配标准工作曲线定量。在1~100 ng · mL-1范围内,7种药物的峰面积与质量浓度的线性关系良好(R2>0.995)。试验选择不同阴性样品为试样,在4 μg · kg-1、20 μg · kg-1和40 μg · kg-1添加水平下的回收率为75.4%~108%,相对标准偏差为0.665%~12.9%。方法的检出限为1 μg · kg-1,定量限为4 μg · kg-1。该方法简单,灵敏度高,重现性好,可为水产品中7种大环内酯类抗生素残留的检测提供技术支持。
-
关键词:
- 大环内酯类抗生素 /
- 水产品 /
- 高效液相色谱-串联质谱法
Abstract:We developed a high performance liquid chromatography tandem mass spectrometric (HPLC-MS/MS) method for determining 7 macrolide antibiotics [oleandomycin (OLD), erythromycin (ERM), kitasamycin (KIT), josamycin (JOS), spiramycin (SPI), tilmicosin (TIL) and tylosin (TYL)] in aquatic products. The samples were extracted with acetonitrile and cleaned up by neutral alumina and n-hexane; data acquisition was achieved by applying selected reaction monitoring (SRM), and quantification analysis was performed with matrix matched standard calibration curves. The standard curves show good linear between the peak areas and concentrations of 7 macrolides in the range of 1~100 ng · mL -1 (R2>0.995). The average recovery of the drugs fortified in different negative samples at 3 spiked levels of 4 μg · kg-1, 20 μg · kg-1 and 40 μg · kg-1 varies from 75.4% to 108%, and the relative standard deviations vary from 0.665% to 12.9%. The detection limit of the drugs in aquatic products is 1 μg · kg-1 and the quantification limit is 4 μg · kg-1. This simple, sensitive and reproducible method can provide technical support for the determination of 7 macrolide antibiotic residues in aquatic products.
-
Keywords:
- macrolide antibiotics /
- aquatic products /
- HPLC-MS/MS
-
合浦珠母贝(Pinctada fucata)是海产软体动物,隶属瓣鳃纲、珍珠贝目、珍珠贝科,广泛分布于热带、亚热带沿海。在中国主要分布于广东、广西、海南及福建沿海一带,是中国最主要的海水珍珠育珠贝,其所产海水珍珠质量蜚声中外[1-5]。而基质蛋白是一类存在于贝壳和珍珠矿化结构中的蛋白,在贝壳和珍珠形成过程中碳酸钙(CaCO3)在基质蛋白的作用下形成高度复杂有序的生物矿化结构,即贝壳和珍珠是在基质蛋白的指导下形成的[6-11]。研究发现,壳基质蛋白不仅在贝壳与珍珠形成的生物矿化过程中起着关键的调控作用,同时赋予珍珠质许多优异的生物学和力学性能,与珍珠贝的生长和珍珠的品质有着密切的关系[12-17]。
2000年,日本学者MIYASHITA等[18]用0.3 mol·L-1乙二胺四乙酸(EDTA)/8 mol·L-1尿素从珍珠粉中萃取出一种新的不溶于EDTA的蛋白Pearlin并克隆得到其cDNA序列,其由129个氨基酸构成,并含有高比例的甘氨酸(Gly,10.8%)、酪氨酸(Tyr,10.0%)、半胱氨酸(Cys,8.5%)、天冬酰胺(Asn,7.7%)、氨基丁二酸(Asp,7.7%)和精氨酸(Arg,7.7%)。Northern Blot分析表明其mRNA在外套膜上皮细胞特定表达,但关于其功能却并不清楚。直到2003年MATSUSHIRO等[19]从珍珠和贝壳珍珠层分离得到一种由Pearlin和角蛋白组成的复合蛋白,发现在含镁离子(Mg2+)的饱和碳酸溶液中加入少量的此蛋白复合体能够诱导文石晶体结晶化。在EDTA和尿素存在的情况下此复合体能够被分离,但被分离的组分混合物失去了诱导文石结晶化的功能。而通过钙离子(Ca2+)和尿素的诱导被分离的复合体组件又被重造成复合体并且重新获得了诱导文石结晶化的功能。这说明复合体是诱导文石结晶化不可或缺的重要功能元件,表明复合体的存在可能是壳基质蛋白执行矿化功能的前提。
由于受壳基质蛋白含量极少、分离难度大等条件限制,使壳基质蛋白的功能分析与开发利用比较困难。若能通过基因工程技术在体外大量获得壳基质蛋白,就能为壳基质蛋白的功能分析与研发利用提供材料。笔者通过基因重组技术构建了壳基质蛋白Pearlin基因的重组质粒,并成功表达出重组融合蛋白,以期对壳基质蛋白基因的进一步研究提供参考依据。
1. 材料与方法
1.1 实验材料
合浦珠母贝由中国水产科学研究院南海水产研究所热带水产研究开发中心陵水新村试验场提供。取合浦珠母贝外套膜组织样品快速保存于RNA样品保存液中,带回实验室-80 ℃冻存。质粒转化受体菌大肠杆菌(E.coli)DH5α、E.coli BL21(DE3)、原核表达载体pET32a均为笔者实验室保存,感受态细菌为笔者实验室自制。
1.2 重组原核表达载体pET32a-Pearlin的构建
根据GenBank上注册的合浦珠母贝壳基质蛋白基因Pearlin的基因序列(AB020779.1)设计引物。上游引物的5′端加保护性碱基CGC、酶切位点BamHⅠ:CGC GGATTC ATGACGTGCACACTTCGTTG;下游引物的5′端加保护性碱基CCC、酶切位点HindⅢ:CCC AAGCTT CTTGTCATACCGTTCATCGA。以合浦珠母贝外套膜cDNA为模板,在20 μL的反应体系中扩增目的基因。PCR反应体系为10×ExTaqBuffer 2 μL,2.5 mmol·L-1 dNTP Mixture 0.4 μL,正、反向引物各0.5 μL,ExTaqDNA polymerase 0.1 μL,cDNA 0.5 μL,无菌ddH2O 16 μL。反应条件为94 ℃预变性5 min,94 ℃变性30 s,59.9 ℃退火30 s,72 ℃延伸1 min,35个循环后,72 ℃延伸10 min。目的基因PCR产物和表达载体pET32a用TaKaRa公司的限制性内切酶BamHⅠ、HindⅢ进行双酶切反应,并以Magen公司的Hipure Gelpure DNA Micro Kit试剂盒从凝胶中回收,目的片段Pearlin与载体pET32a连接后转化感受态细胞DH5α。从阳性克隆中筛选正确插入外源基因的重组克隆,并送上海生工生物技术公司测序鉴定,将测序正确的阳性克隆命名为pET32a-Pearlin。
1.3 重组蛋白pET32a-Pearlin的诱导表达与条件优化
1.3.1 重组表达菌株的培养与诱导表达
将原核重组质粒pET32a-Pearlin与空载体pET32a分别转化到表达宿主菌E.coli BL21(DE3)感受态细胞中,分别挑取单菌落于3 mL LB/Amp液体培养基中,37 ℃摇床培养过夜。将过夜培养的菌液按体积比1 : 100转接至5 mL LB/Amp液体培养基中,37 ℃摇菌培养至光密度(OD600)=0.4~0.6,取2 mL菌液作为未诱导对照,再往剩下的菌液中加入IPTG至终浓度为l mmol·L-1,继续振荡培养4~6 h。分别取未诱导菌液1 mL、IPTG诱导后菌液l mL,进行SDS-PAGE电泳分析全菌蛋白。
1.3.2 IPTG诱导浓度的优化
取8管3 mL OD600=0.6的pET32a-Pearlin菌液分别加入100 mmol·L-1 IPTG至终浓度分别为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1,取1管3 mL OD600=0.6的空载体pET32a菌液加100 mmol·L-1 IPTG至终浓度为1.4 mmol·L-1。37 ℃诱导6 h,分别取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.3 诱导温度的优化
分别取3管3 mL OD600=0.6的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液为对照)。分别在37 ℃、28 ℃下诱导培养6 h,20 ℃下诱导过夜(16~18 h)。各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.4 培养基pH的优化
分别取3管3 mL OD600=0.6的pET32a-Pearlin菌液(培养基pH分别为6.0、7.0、8.0),均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下诱导培养6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.5 诱导时间的优化
分别取6管3 mL OD600=0.6的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下分别诱导培养1 h、2 h、3 h、4 h、5 h、6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.6 诱导时机的优化
分别取3 mL转接后培养了2 h、3 h、4 h的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下分别诱导培养6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.4 重组蛋白的可溶性检测
取10 mL重组蛋白表达菌pET32a-Pearlin,IPTG诱导培养6 h,4℃,12 000 g离心10 min,弃上清。用PBS洗涤一次后,加入10 mL PBS重悬菌体,进行超声波裂解。4 ℃,12 000 g离心10 min,分别收集上清和沉淀,进行SDS-PAGE电泳,比较确定表达产物是以可溶性形式存在(上清中),还是以包涵体形式存在(沉淀中)。
2. 结果
2.1 重组原核表达载体pET32a-Pearlin的构建
测序结果表明重组质粒pET32a-Pearlin中插入的基因片段与GenBank上注册的合浦珠母贝Pearlin基因ORF序列(ID: AB020779.1)一致性为93%。经BLAST分析,中国海南地区合浦珠母贝Pearlin ORF与日本等其他地区珍珠贝Pearlin ORF的核苷酸序列一致性为85%~99%(表 1),用邻位相连法(neighbor-joining,NJ)构建系统进化树见图 1,置信度检验1 000次。
表 1 Pearlin基因核苷酸序列间的一致性及变异性Table 1. Consistency and variability of Pearlin between nucleotide sequences登录号Genbank ID PearlinORF AB020779.1 JQ962975.1 DQ665305.3 Pearlin ORF 0.090 0.323 0.345 AB020779.1 93% 0.277 0.297 JQ962975.1 87% 87% 0.012 DQ665305.3 85% 85% 99% 注:Pearlin ORF. 合浦珠母贝(中国海南);AB020779.1. 合浦珠母贝(日本);JQ962975.1. Pteria sterna(墨西哥);DQ665305.3. 珠母贝(法国波利尼西亚)
Note:Pearlin ORF. P.fucata(Hainan, China);AB020779.1. P.fucata(Japan);JQ962975.1. Pteria sterna(Mexico);DQ665305.3. P.margaritifera(French Polynesia)2.2 重组蛋白pET32a-Pearlin原核表达的SDS-PAGE电泳检测
经IPTG诱导的重组质粒pET32a-Pearlin表达出相对分子质量约为34.19 kD的融合蛋白,而对照组的空载体pET32a则无此特异性条带(图 2)。由于合浦珠母贝Pearlin蛋白分子量约为14.19 kD,且pET32a自带的蛋白分子量约为20 kD,故其融合蛋白约为34.19 kD。表明增加的蛋白条带就是外源基因Pearlin被诱导表达的融合蛋白产物,与预期结果相符。
![]() 图 2 pET32a-Pearlin重组质粒在BL21细菌中的IPTG诱导表达0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~7. IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白Figure 2. IPTG inducing expression of PET32a-Pearlin recombinant plasmid in BL21 bacteria0. whole cell protein without IPTG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~7. whole cell protein with IPIG-induced BL21(pET32a-Pearlin)
图 2 pET32a-Pearlin重组质粒在BL21细菌中的IPTG诱导表达0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~7. IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白Figure 2. IPTG inducing expression of PET32a-Pearlin recombinant plasmid in BL21 bacteria0. whole cell protein without IPTG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~7. whole cell protein with IPIG-induced BL21(pET32a-Pearlin)2.3 pET32a-Pearlin重组蛋白表达所需IPTG诱导浓度的优化
基因工程菌BL21(pET32a-Pearlin)经不同的IPTG浓度诱导培养6 h后,将全菌蛋白进行SDS-PAGE电泳检测,筛选最优IPTG浓度。结果显示,IPTG的终浓度为0 mmol·L-1时重组蛋白表达量较低。随着IPTG浓度的提高,蛋白表达量也随之提高。但在0.6~1.4 mmol·L-1的浓度范围内,表达量无明显变化(图 3)。考虑到《pET System Manual》建议带有T7lac启动子的载体(如pET32a)需要终浓度为1 mmol·L-1的IPTG才能完全诱导,并且IPTG对菌体有一定的毒性,因此选用终浓度为1.0 mmol·L-1的IPTG诱导重组蛋白。
![]() 图 3 不同IPTG诱导浓度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;P. BL21(pET32a)的IPTG终浓度为1.4 mmol·L-1;0~7. BL21(pET32a-Pearlin) 的IPTG终浓度依次为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1Figure 3. SDS-PAGE analysis of pET32a-Pearlin expression product at different concentrations of IPTGM. protein molecular weight standard; P. IPTG concentration of BL21 (pET32a) was 1.4 mmol·L-1; 0~7. IPTG concentrations of BL21(pET32a-Pearlin) were 0 mmol·L-1, 0.2 mmol·L-1, 0.4 mmol·L-1, 0.6 mmol·L-1, 0.8 mmol·L-1, 1.0 mmol·L-1, 1.2 mmol·L-1 and 1.4 mmol·L-1, respectively.
图 3 不同IPTG诱导浓度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;P. BL21(pET32a)的IPTG终浓度为1.4 mmol·L-1;0~7. BL21(pET32a-Pearlin) 的IPTG终浓度依次为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1Figure 3. SDS-PAGE analysis of pET32a-Pearlin expression product at different concentrations of IPTGM. protein molecular weight standard; P. IPTG concentration of BL21 (pET32a) was 1.4 mmol·L-1; 0~7. IPTG concentrations of BL21(pET32a-Pearlin) were 0 mmol·L-1, 0.2 mmol·L-1, 0.4 mmol·L-1, 0.6 mmol·L-1, 0.8 mmol·L-1, 1.0 mmol·L-1, 1.2 mmol·L-1 and 1.4 mmol·L-1, respectively.2.4 pET32a-Pearlin重组蛋白表达所需诱导温度的优化
SDS-PAGE电泳结果(图 4)表明,IPTG终浓度为1.0 mmol·L-1时,相同培养时间(6 h)下工程菌BL21(pET32a-Pearlin)在37 ℃表达蛋白相对较多。20 ℃低温下需过夜诱导(16~18 h)且表达量远低于37 ℃下的表达量。所以考虑到诱导时间的长短以及仪器设备的便捷性,选择37 ℃下诱导4~6 h。
![]() 图 4 不同诱导温度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、3、5. BL21(pET32a) 分别在20 ℃(16~18 h)、28℃(6 h)、37℃(6 h)下表达;2、4、6. BL21(pET32a-Pearlin)分别在20 ℃(16~18 h)、28 ℃(6 h)、37 ℃(6 h)下表达Figure 4. SDS-PAGE analysis of pET32a-Pearlin induced expression product at different temperaturesM. protein molecular weight standard; 1, 3, 5. BL21(pET32a) was expressed at 20 ℃ (16~18 h), 28 ℃ (6 h) and 37 ℃ (6 h), respectively; 2, 4, 6. BL21(pET32a-Pearlin)was expressed at 20 ℃ (16~18 h), 28 ℃(6 h) and 37 ℃ (6 h), respectively.
图 4 不同诱导温度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、3、5. BL21(pET32a) 分别在20 ℃(16~18 h)、28℃(6 h)、37℃(6 h)下表达;2、4、6. BL21(pET32a-Pearlin)分别在20 ℃(16~18 h)、28 ℃(6 h)、37 ℃(6 h)下表达Figure 4. SDS-PAGE analysis of pET32a-Pearlin induced expression product at different temperaturesM. protein molecular weight standard; 1, 3, 5. BL21(pET32a) was expressed at 20 ℃ (16~18 h), 28 ℃ (6 h) and 37 ℃ (6 h), respectively; 2, 4, 6. BL21(pET32a-Pearlin)was expressed at 20 ℃ (16~18 h), 28 ℃(6 h) and 37 ℃ (6 h), respectively.2.5 pET32a-Pearlin重组蛋白表达培养基pH的优化
工程菌BL21(pET32a-Pearlin)经不同pH的培养基培养和IPTG诱导后,将全菌蛋白进行SDS-PAGE电泳检测,结果显示如图 5。pET32a-Pearlin在实验pH分别为6.0、7.0、8.0的培养基中表达量相差不大。
![]() 图 5 不同pH培养基中pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、4、7. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;2、5、9. IPTG诱导的BL21(pET32a)全菌蛋白;3、6、8. IPTG诱导的BL21 (pET32a-Pearlin)全菌蛋白(1~3培养基pH为6.0;4~6培养基pH为7.0;7~9培养基pH为8.0)Figure 5. SDS-PAGE analysis of pET32a-Pearlin expression product with different pHs of mediumM. protein molecular weight standard; 1, 4, 7. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); 2, 5, 9. whole cell protein with IPIG-induced BL21(pET32a); 3, 6, 8. whole cell protein with IPTG-induced BL21 (pET32a-Pearlin) (1~3. pH of medium was 6.0;4~6. pH of medium was 7.0;7~9. pH of medium was 8.0)
图 5 不同pH培养基中pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、4、7. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;2、5、9. IPTG诱导的BL21(pET32a)全菌蛋白;3、6、8. IPTG诱导的BL21 (pET32a-Pearlin)全菌蛋白(1~3培养基pH为6.0;4~6培养基pH为7.0;7~9培养基pH为8.0)Figure 5. SDS-PAGE analysis of pET32a-Pearlin expression product with different pHs of mediumM. protein molecular weight standard; 1, 4, 7. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); 2, 5, 9. whole cell protein with IPIG-induced BL21(pET32a); 3, 6, 8. whole cell protein with IPTG-induced BL21 (pET32a-Pearlin) (1~3. pH of medium was 6.0;4~6. pH of medium was 7.0;7~9. pH of medium was 8.0)2.6 pET32a-Pearlin重组蛋白表达所需诱导时间的优化
SDS-PAGE电泳结果表明(图 6),IPTG终浓度为1.0 mmol·L-1时,随着诱导时间的增长,蛋白表达量也随之提高。但在4~6 h蛋白表达量变化不大。所以诱导pET32a-Pearlin蛋白表达的最佳时长为2~4 h。
![]() 图 6 不同诱导时间下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~6. IPTG分别诱导1 h、2 h、3 h、4 h、5 h、6 h后的BL21(pET32a-Pearlin)全菌蛋白Figure 6. SDS-PAGE analysis of pET32a-Pearlin expression products with different induction time0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21(pET32a); M. protein molecular weight standard; 1~6. whole cell protein BL21 (pET32a-Pearlin) with IPTG induction time of 1 h, 2 h, 3 h, 4 h, 5 h and 6 h, respectively.
图 6 不同诱导时间下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~6. IPTG分别诱导1 h、2 h、3 h、4 h、5 h、6 h后的BL21(pET32a-Pearlin)全菌蛋白Figure 6. SDS-PAGE analysis of pET32a-Pearlin expression products with different induction time0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21(pET32a); M. protein molecular weight standard; 1~6. whole cell protein BL21 (pET32a-Pearlin) with IPTG induction time of 1 h, 2 h, 3 h, 4 h, 5 h and 6 h, respectively.2.7 pET32a-Pearlin重组蛋白表达诱导时机的优化
转接pET32a-Pearlin 2~4 h后加IPTG诱导蛋白表达,SDS-PAGE电泳显示见图 7。在同样的诱导时间(6 h)下,转接2 h后再进行诱导表达的蛋白表达量远不如转接3~4 h再进行IPTG诱导的表达量。
![]() 图 7 不同诱导时机下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经iptg诱导的bl21(pet32a-pearlin)全菌蛋白;p. iptg诱导的bl21(pet32a)全菌蛋白;m. 蛋白质分子质量标准marker;1~3. 分别培养了2 h、3 h、4 h的pet32a-pearlin菌液经iptg诱导6 h后的bl21(pet32a-pearlin)全菌蛋白Figure 7. SDS-PAGE analysis of pET32a-Pearlin expression product with different induction timing0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~3. whole cell protein BL21 (pET32a-Pearlin) with induction of 2 h, 3 h and 4 h, respectively.
图 7 不同诱导时机下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经iptg诱导的bl21(pet32a-pearlin)全菌蛋白;p. iptg诱导的bl21(pet32a)全菌蛋白;m. 蛋白质分子质量标准marker;1~3. 分别培养了2 h、3 h、4 h的pet32a-pearlin菌液经iptg诱导6 h后的bl21(pet32a-pearlin)全菌蛋白Figure 7. SDS-PAGE analysis of pET32a-Pearlin expression product with different induction timing0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~3. whole cell protein BL21 (pET32a-Pearlin) with induction of 2 h, 3 h and 4 h, respectively.2.8 重组蛋白pET32a-Pearlin的可溶性检测
把工程菌BL21(pET32a-Pearlin)经超声波破碎后的沉淀和上清进行SDS-PAGE,在不同的诱导温度及诱导时间下,融合蛋白pET32a-Pearlin都主要以包涵体形式存在,极少部分存在于上清中(图 8)。根据《pET System Manual》建议,pET系统能很容易地通过降低诱导物的浓度来削弱蛋白表达,并且降低表达水平可能可以提高某些目的蛋白的可溶部分产量,所以调整IPTG诱导浓度为0.8 mmol·L-1。
![]() 图 8 融合蛋白pET32a-Pearlin的存在形式M. 蛋白质分子质量标准Marker;1. 未经IPTG诱导的BL21 (pET32a-Pearlin)在16 ℃表达菌体裂解液上清;2. 未经IPTG诱导的BL21(pET32a-Pearlin)菌体在16 ℃表达裂解液沉淀;3、5、7. IPTG诱导的BL21(pET32a-Pearlin)分别在16 ℃、28 ℃、37 ℃表达菌体裂解液上清;4、6、8、9. IPTG诱导的BL21(pET32a-Pearlin分别)在16 ℃、28 ℃、37 ℃表达菌体裂解液沉淀Figure 8. Form of fusion protein pET32a-PearlinM. protein molecular weight standard; 1. bacteria pyrolysis liquid supernatant of BL21(pET32a-Pearlin) without IPIG-induced at 16 ℃; 2. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) without IPIG-induced at 16 ℃; 3, 5, 7. bacteria pyrolysis liquid supernatant of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively; 4, 6, 8, 9. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively.
图 8 融合蛋白pET32a-Pearlin的存在形式M. 蛋白质分子质量标准Marker;1. 未经IPTG诱导的BL21 (pET32a-Pearlin)在16 ℃表达菌体裂解液上清;2. 未经IPTG诱导的BL21(pET32a-Pearlin)菌体在16 ℃表达裂解液沉淀;3、5、7. IPTG诱导的BL21(pET32a-Pearlin)分别在16 ℃、28 ℃、37 ℃表达菌体裂解液上清;4、6、8、9. IPTG诱导的BL21(pET32a-Pearlin分别)在16 ℃、28 ℃、37 ℃表达菌体裂解液沉淀Figure 8. Form of fusion protein pET32a-PearlinM. protein molecular weight standard; 1. bacteria pyrolysis liquid supernatant of BL21(pET32a-Pearlin) without IPIG-induced at 16 ℃; 2. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) without IPIG-induced at 16 ℃; 3, 5, 7. bacteria pyrolysis liquid supernatant of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively; 4, 6, 8, 9. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively.3. 讨论
目前中国珍珠生产过程中普遍存在珍珠品质下降的问题,严重制约了珍珠产业的可持续发展。然而珍珠形成的分子机理目前尚不清楚,相关的研究也还处于起步阶段。由于贝壳和珍珠在微观结构和化学组成上被认为是相同的物质,学者们普遍认为通过贝壳形成机理的研究可以阐明珍珠的形成机理[20-21]。贝壳和珍珠都是在基质蛋白的指导下形成,展开对壳基质蛋白的研究对揭示珍珠形成机理尤为重要。珍珠质形成基因的高表达与棱柱层形成基因的低表达有利于提高珍珠的品质,所以对珍珠层形成相关蛋白进行研究对珍珠品质的提升意义重大[22-25]。
随着分子克隆技术的普遍应用,大量有价值的蛋白在大肠杆菌中获得高效表达。而珍珠层壳基质蛋白Pearlin在贝壳和珍珠矿化结构中含量很低,用传统的生化分离技术很难大量获得。利用DNA重组技术在大肠杆菌中进行原核表达,为大量获得此类有价值的蛋白因子提供了可能性。外源目的基因在大肠杆菌中的表达量受诱导表达条件的影响较大[26]。因此,对不同的目的基因必须对其诱导条件进行优化,寻找适宜的表达条件,才能获得最大程度的表达。该研究采用单因子实验方法,通过SDS-PAGE电泳图谱分析表达条件如IPTG诱导浓度、培养温度、培养基pH及IPTG诱导时间、时机等因素对pET32a-Pearlin基因工程重组菌表达的影响。结果表明重组融合蛋白pET32a-Pearlin在IPTG诱导终浓度大于0.6 mmol·L-1后目的蛋白表达量不会继续升高。在IPTG终浓度为1.0 mmol·L-1,相同诱导时间(6 h)下,37 ℃表达蛋白最多。大肠杆菌生长的最适pH为6.8~7.6,有报道指出表达外源蛋白的最佳pH约为7.0[27],但该研究中重组蛋白在pH分别为6.0、7.0、8.0的培养基中表达量变化不大,原因可能是稍偏酸或碱的环境都有利于重组融合蛋白pET32a-Pearlin的表达。在IPTG诱导浓度一定的条件下,诱导4~6 h时蛋白表达量最多。在IPTG诱导浓度和诱导时间一定的条件下,在转接3~4 h后进行IPTG诱导蛋白表达量较理想。以上结果为重组蛋白pET32a-Pearlin的生产制备奠定了重要基础。
在整个研究过程中笔者发现,无论低温过夜诱导(16 ℃,16~18 h)还是改变诱导剂(IPTG)浓度等措施均不能实现融合蛋白pET32a-Pearlin由包涵体转向可溶性蛋白表达。这可能是由于表达水平过高导致蛋白合成速度过快,致使蛋白没有足够时间进行折叠、二硫键不能正确配对,同时还会导致蛋白间的非特异性结合增加,致蛋白无法达到原有的溶解度,最终形成不可溶的失去原始空间结构的包涵体[28-30]。
-
表 1 7种大环内酯类药物的定性离子对、定量离子对和碰撞能量
Table 1 Quality SRM transition, quantity SRM transition and collision energy of 7 macrolides in positive ion mode
化合物
compound定性离子对/m/z
quality SRM transition定量离子对/m/z
quantity SRM transition碰撞能量/eV
collision energy竹桃霉素OLD 688.4/158.1 688.4/544.3 688.4/544.3 28 16 红霉素ERM 734.4/158.2 734.4/576.2 734.4/576.2 28 18 吉他霉素KIT 772.4/109.4 772.4/174.3 772.4/174.3 33 30 交沙霉素JOS 828.3/109.4 828.3/174.1 828.3/174.1 35 32 螺旋霉素SPI 843.4/174.2 843.4/142.1 843.4/174.2 36 40 替米考星TIL 869.5/137.7 869.5/696.3 869.5/696.3 41 36 泰乐菌素TYL 916.4/174.2 916.4/772.2 916.4/174.2 36 29 表 2 梯度洗脱程序
Table 2 Gradient elution process
时间/min
time0.1%甲酸/%
0.1% acetate-acid乙腈/%
acetonitrile0 95 5 3.0 95 5 10.0 5 95 10.1 95 5 16.0 95 5 表 3 不同条件下基质效应的计算结果(n=3)
Table 3 Calculation results of matrix effect under different conditions
化合物
compound峰面积peak area 基质效应/%
matrix effectSet1 Set2 竹桃霉素OLD 7 332 689 6 948 742 94.8 红霉素ERM 9 182 405 7 038 229 76.6 吉他霉素KIT 1 380 166 1 299 271 94.1 交沙霉素JOS 5 866 797 4 883 207 83.2 螺旋霉素SPI 230 354 156 363 67.9 替米考星TIL 1 668 007 540 286 32.4 泰乐菌素TYL 2 727 157 2 575 583 94.4 表 4 线性方程、相关系数、检出限和定量限
Table 4 Linear equation, correlation coefficient, limit of detection and limit of quantification
化合物
compound线性方程
linear equation相关系数(R2)
correlation coefficient检出限/μg·kg-1
LOD定量限/μg·kg-1
LOQ竹桃霉素OLD y=-3 050.63+51 008.5x 0.999 7 1 4 红霉素ERM y=10 592.7+54 086.4x 0.999 4 1 4 吉他霉素KIT y=-3 573.14+13 001.6x 0.999 5 1 4 交沙霉素JOS y=3 628.95+57 449.6x 0.999 7 1 4 螺旋霉素SPI y=848.843+3 085.62x 0.995 3 1 4 替米考星TIL y=6 402.08+12 336.5x 0.996 7 1 4 泰乐菌素TYL y=-2 006.27+24 688.1x 0.999 5 1 4 表 5 凡纳滨对虾样品中添加回收率与精密度试验数据(n=6)
Table 5 Recovery and precision of drugs spiked in P.vannamei
项目
item加标水平/μg·kg-1
spiked level竹桃霉素
OLD红霉素
ERM吉他霉素
KIT交沙霉素
JOS螺旋霉素
SPI替米考星
TIL泰乐菌素
TYL回收率/% recovery 4 94.6 83.9 81.6 80.0 75.4 78.4 82.2 20 81.5 91.3 78.0 75.9 81.6 88.6 77.7 40 99.1 75.9 95.0 86.7 84.2 76.3 89.2 相对标准偏差/% RSD 4 5.41 10.80 4.82 6.69 7.08 12.90 9.26 20 2.67 2.05 3.79 2.26 7.32 2.05 0.67 40 4.88 5.73 8.17 2.16 10.30 8.23 2.54 表 6 不同水产品中添加回收率与精密度试验数据(n=6)
Table 6 Recovery and precision of drugs spiked in different aquatic products
% 化合物
compound杂色鲍
H.diversicolor日本鳗鲡
A.japonica加州鲈
M.salmoides锯缘青蟹
S.serrata大黄鱼
P.crocea罗非鱼
M.tilapia回收率 RSD 回收率 RSD 回收率 RSD 回收率 RSD 回收率 RSD 回收率 RSD 竹桃霉素OLD 91.2 8.29 96.9 3.58 78.7 4.82 81.9 4.33 83.1 4.15 106.0 6.39 红霉素ERM 97.4 4.04 93.1 6.09 95.2 2.51 80.5 2.55 76.5 8.57 92.9 4.93 吉他霉素KIT 81.8 5.66 91.0 6.53 88.2 4.33 102.0 5.84 96.3 5.33 80.4 6.81 交沙霉素JOS 85.4 4.11 91.4 6.38 92.4 3.15 102.0 12.30 85.1 5.52 87.4 7.63 螺旋霉素SPI 81.4 12.10 82.7 12.70 81.1 6.98 91.8 7.66 85.5 6.68 77.0 5.33 替米考星TIL 77.0 4.97 75.9 8.07 108.0 4.68 79.0 10.70 83.2 10.30 85.3 9.34 泰乐菌素TYL 83.3 4.01 97.0 5.07 87.8 3.42 83.8 6.59 90.8 3.91 84.3 6.47 -
[1] 刘永涛, 艾晓辉, 邹世平, 等. 水产品中螺旋霉素、替米考星、泰乐菌素与北里霉素残留量的超高效液相色谱-紫外检测法同时测定[J]. 分析测试学报, 2010, 29(3): 316-320. https://xueshu.baidu.com/usercenter/paper/show?paperid=38e858f47b5a2313e9e960a7215a9c11&site=xueshu_se LIU Yongtao, AI Xiaohui, ZOU Shiping, et al. Simultaneous determination of spiramycin, tilmicosin, tylosin and kitasamycin residues in fishery products by UPLC-TUV method[J]. J Instrumental Anal, 2010, 29(3): 316-320. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=38e858f47b5a2313e9e960a7215a9c11&site=xueshu_se
[2] 杨方, 李耀平, 方宇, 等. 高效液相色谱法同时检测水产品中螺旋霉素与泰乐菌素药物残留[J]. 理化检验-化学分册, 2007, 43(4): 272-274. doi: 10.3321/j.issn:1001-4020.2007.04.007 YANG Fang, LI Yaoping, FANG Yu, et al. Simultaneous determination of residual spiramycin and tylosin in aquatic products by HPLC[J]. Phys Test Chem Anal Part B: Chem Anal, 2007, 43(4): 272-274. (in Chinese) doi: 10.3321/j.issn:1001-4020.2007.04.007
[3] HORIEA M, SAITOA K, ISHⅡ R, et al. Simultaneous determination of five macrolide antibiotics in meat by high-performance liquid chromatography[J]. J Chromatogr A, 1998, 812(1/2): 295-302. https://xueshu.baidu.com/usercenter/paper/show?paperid=f88dbf37de104771017a437904b6aa97&site=xueshu_se&hitarticle=1
[4] LEAL C, CODONY R, COMPANO R, et al. Determination of macrolide antibiotics by liquid chromatography[J]. J Chromatogr A, 2001, 910(2): 285-290. doi: 10.1016/S0021-9673(00)01231-0
[5] 刘晔, 王洪新, 戴军, 等. 固相萃取-高效液相色谱法测定猪肝中的大环内酯类抗生素[J]. 食品与发酵工业, 2008, 34(5): 162-165. https://xueshu.baidu.com/usercenter/paper/show?paperid=ddd63acc670cdab3aa8f4ffd907e93f1&site=xueshu_se&hitarticle=1 LIU Ye, WANG Hongxin, DAI Jun, et al. Determination of macrolides in pig liver by solid-phase extraction coupled with HPLC[J]. Food Ferment Ind, 2008, 34(5): 162-165. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=ddd63acc670cdab3aa8f4ffd907e93f1&site=xueshu_se&hitarticle=1
[6] MAYOR M, GARCINUNO R, HEMANDO P, et al. Liquid chromatography-UV diode-array detection method for multi-residue determination of macrolide antibiotics in sheep's milk[J]. J Chromatogr A, 2006, 1122(1/2): 76-83. https://xueshu.baidu.com/usercenter/paper/show?paperid=cc7079a420fcd9e1bca8c2e1e614df9c&site=xueshu_se&hitarticle=1
[7] 于慧娟, 沈晓盛, 李庆, 等. 高效液相色谱-荧光法测定对虾组织中红霉素的残留量[J]. 分析试验室, 2006, 25(4): 82-85. https://xueshu.baidu.com/usercenter/paper/show?paperid=e1788b98f09fcfe51d841f432ec28b11&site=xueshu_se&hitarticle=1 YU Huijuan, SHEN Xiaosheng, LI Qing, et al. Analysis of erythromycin residues in shrimp by high performance liquid chromatography with fluorometric detection[J]. Chin J Anal Lab, 2006, 25(4): 82-85. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=e1788b98f09fcfe51d841f432ec28b11&site=xueshu_se&hitarticle=1
[8] 钮伟民, 刘晔, 戴军, 等. 动物性食品中大环内酯类抗生素的HPLC分析[J]. 食品机械, 2007, 23(6): 95-98. https://xueshu.baidu.com/usercenter/paper/show?paperid=1e1b344918046935e6e010512fdd8fe1&site=xueshu_se&hitarticle=1 NIU Weimin, LIU Ye, DAI Jun, et al. High performance liquid chromatography analysis of macrolide antibiotic residues in animal derived food[J]. Food Machinery, 2007, 23(6): 95-98. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=1e1b344918046935e6e010512fdd8fe1&site=xueshu_se&hitarticle=1
[9] 岳振峰, 陈小霞, 谢丽琪, 等. 高效液相色谱串联质谱法测定动物组织中林可酰胺类和大环内酯类抗生素残留[J]. 分析化学研究报告, 2007, 35(9): 1290-1294. https://xueshu.baidu.com/usercenter/paper/show?paperid=a92eadb93635600ef757a6fbb8e1f003&site=xueshu_se&hitarticle=1 YUE Zhenfeng, CHEN Xiaoxia, XIE Liqi, et al. Determination of residues of lincosamides and macrolides in animal tissue by high performance liquid chromatography tandem electrospray mass spectrometry[J]. Chin J Anal Chem, 2007, 35(9): 1290-1294. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=a92eadb93635600ef757a6fbb8e1f003&site=xueshu_se&hitarticle=1
[10] 王敏, 林维宣, 郭德华, 等. 高效液相色谱-串联质谱法同时检测动物性食品中多种大环内酯类药物[J]. 分析测试学报, 2007, 26(5): 675-678. doi: 10.3969/j.issn.1004-4957.2007.05.018 WANG Min, LIN Weixuan, GUO Dehua, et al. Determination of macrolides in animal origin food by HPLC-MS/MS[J]. J Instrumental Anal, 2007, 26(5): 675-678. (in Chinese) doi: 10.3969/j.issn.1004-4957.2007.05.018
[11] BERRADA H, BORRULL F, FONT G, et al. Determination of macrolide antibiotics in meat and fish using pressurized liquid extraction and liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2008, 1208(1/2): 83-89. https://xueshu.baidu.com/usercenter/paper/show?paperid=f3582c4e45ca3835b8731e3956628c32&site=xueshu_se
[12] 陈莹, 陈辉, 林谷园, 等. 超高效液相色谱串联质谱法对鳗鱼中大环内酯类、喹诺酮类和磺胺类兽药残留量的同时测定[J]. 分析测试学报, 2008, 27(5): 538-541. doi: 10.3969/j.issn.1004-4957.2008.05.021 CHEN Ying, CHEN Hui, LIN Guyuan, et al. Simultaneous determination of 25 macrolides, quinolones and sulfonamides residues in eels by ultra performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. J Instrumental Anal, 2008, 27(5): 538-541. (in Chinese) doi: 10.3969/j.issn.1004-4957.2008.05.021
[13] 夏敏, 贾丽, 季怡萍. 液相色谱-质谱法同时检测畜禽肉中五种大环内酯类抗生素[J]. 分析测试学报, 2004, 23(增刊): 217-220. https://xueshu.baidu.com/usercenter/paper/show?paperid=c960bdd47a2e60a16044dfbf65c5e0a0 XIA Min, JIA Li, JI Yiping. Simultaneous determination of 5 kinds of macrolide antibiotics in meat by liquid chromatography-mass spectrometry[J]. J Instrumental Anal, 2004, 23(Suppl): 217-220. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=c960bdd47a2e60a16044dfbf65c5e0a0
[14] HORIE M, TAKEGAMI H, TOYA K, et al. Determination of macrolide antibiotics in meat and fish by liquid chromatography-electrospray mass spectrometry[J]. Analytica Chimica Acta, 2003, 492: 187-197. doi: 10.1016/S0003-2670(03)00891-2
[15] 夏曦, 李晓薇, 江海洋, 等. 高效液相色谱-串联质谱法对猪肉中四种大环内酯类药物残留量的测定[J]. 分析测试学报, 2008, 27(增刊): 224-227. https://xueshu.baidu.com/usercenter/paper/show?paperid=f3034d910537f8f096f1b699cabfc385&site=xueshu_se XIA Xi, LI Xiaowei, JIANG Haiyang, et al. Determination of four macrolides in pork by high performance liquid chromatography-tandem mass spectrometry[J]. J Instrumental Anal, 2008, 27(Suppl): 224-227. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=f3034d910537f8f096f1b699cabfc385&site=xueshu_se
[16] 谢文, 丁慧瑛, 奚君阳, 等. 蜂王浆产品中5种大环内酯类抗生素残留量的高效液相色谱-质谱/质谱检测方法[J]. 色谱, 2007, 25(3): 404-407. doi: 10.3321/j.issn:1000-8713.2007.03.026 XIE Wen, DING Huiying, XI Junyang, et al. Determination of five macrolide antibiotic residues in royal jelly samples by using high performance liquid chromatography tandem mass spectrometry[J]. Chin J Chromatogr, 2007, 25(3): 404-407. (in Chinese) doi: 10.3321/j.issn:1000-8713.2007.03.026
[17] 徐锦忠, 吴宗贤, 杨雯筌, 等. 液相色谱-电喷雾串联质谱测定蜂蜜中8种大环内酯类药物残留[J]. 分析化学研究报告, 2007, 35(2): 166-170. https://xueshu.baidu.com/usercenter/paper/show?paperid=250479f225ea67b838d4780022bfab43&site=xueshu_se&hitarticle=1 XU Jinzhong, WU Zongxian, YANG Wenquan, et al. Determination of eight macrolide antibiotic residues in honey by liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Chin J Anal Chem, 2007, 35(2): 166-170. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=250479f225ea67b838d4780022bfab43&site=xueshu_se&hitarticle=1
[18] WANG Jian. Determination of five macrolide antibiotic residues in honey by LC-ESI-MS and LC-ESI-MS/MS[J]. J Agric Food Chem, 2004, 52(2): 171-181. doi: 10.1021/jf034823u
[19] WANG Jian, LEUNG D, LENZ S P. Determination of five macrolide antibiotic residues in raw milk using liquid chromatography-electrospray ionization tandem mass spectrometry[J]. J Agric Food Chem, 2006, 54(8): 2873-2880. doi: 10.1021/jf060068j
[20] 谢丽琪, 岳振峰, 唐少冰, 等. 高效液相色谱串联质谱法测定牛奶中林可酰胺类和大环内酯类抗生素残留量的研究[J]. 分析实验室, 2008, 27(3): 5-8. https://xueshu.baidu.com/usercenter/paper/show?paperid=a92eadb93635600ef757a6fbb8e1f003&site=xueshu_se XIE Liqi, YUE Zhenfeng, TANG Shaobing, et al. A study on determination of residues of lincosamides and macrolides in milk by high performance liquid chromatography tandem electrospray mass spectrometry[J]. Chin J Anal Lab, 2008, 27(3): 5-8. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=a92eadb93635600ef757a6fbb8e1f003&site=xueshu_se
[21] BOGIALLI S, CORCIA A, LAGANA A, et al. A simple and rapid confirmatory assay for analyzing antibiotic residues of the macrolide class and lincomycin in bovine milk and yogurt: hot water extraction followed by liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2007, 21(2): 237-246. doi: 10.1002/rcm.2835
[22] DUBOIS M, FLUCHARD D, SIOR E, et al. Identification and quantification of five macrolide antibiotics in several tissues, eggs and milk by liquid chromatography-electrospray tandem mass spectrometry[J]. J Chromatogr B, 2001, 753(2): 189-202. https://www.semanticscholar.org/paper/Identification-and-quantification-of-five-macrolide-Dubois-Fluchard/f10f2b93b8d7ae2ab650c4395b74a252f2005592
[23] 王凤美, 陈军辉, 林黎明, 等. UPLC-MS/MS法对动物源性食品中12种大环内酯类抗生素残留的测定[J]. 分析测试学报, 2009, 28(7): 784-788. https://xueshu.baidu.com/usercenter/paper/show?paperid=5d714e0d0abb0f526f113db7d3c08f76&site=xueshu_se WANG Fengmei, CHEN Junhui, LIN Liming, et al. Determination of 12 macrolide antibiotics residues in products of animal origin by ultra performance liquid chromatography coupled with tandem mass spectrometry[J]. J Instrumental Anal, 2009, 28(7): 784-788. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=5d714e0d0abb0f526f113db7d3c08f76&site=xueshu_se
[24] HERRERA M, DING HQ, MCCLANAHAN R, et al. Quantitative determination of tilmicosin in canine serum by high performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2007, 857(1): 9-14. https://xueshu.baidu.com/usercenter/paper/show?paperid=40a3c1417898d83284358718d9a364cf&site=xueshu_se&hitarticle=1
[25] 刘永涛, 刘振红, 丁运敏, 等. HPLC-MS/MS同时测定水产品中喹烯酮、喹乙醇和5种大环内酯类抗生素残留[J]. 分析试验室, 2010, 29(8): 44-47. https://xueshu.baidu.com/usercenter/paper/show?paperid=b893f7f29c4a3deb37139a0d6755db15&site=xueshu_se&hitarticle=1 LIU Yongtao, LIU Zhenhong, DING Yunmin, et al. Simultaneous determination of residues of quinocetone, olaquindox and five kinds of macrolide antibiotics in fishery products by high performance liquid chromatography tandem mass spectrometry[J]. Chin J Anal Lab, 2010, 29(8): 44-47. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=b893f7f29c4a3deb37139a0d6755db15&site=xueshu_se&hitarticle=1
[26] 刘玉春, 徐维海, 余莉莉, 等. 固相萃取液相色谱-质谱/质谱联用测定河水中大环内酯类抗生素[J]. 分析测试学报, 2006, 25(2): 1-5. https://xueshu.baidu.com/usercenter/paper/show?paperid=c61b6024a52d0e7017d4aabc1d19f3eb&site=xueshu_se&hitarticle=1 LIU Yuchun, XU Weihai, YU Lili, et al. Determination of trace macrolides in water using solid-phase extraction and liquid chromatography with tandem mass spectrometry[J]. J Instrumental Anal, 2006, 25(2): 1-5. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=c61b6024a52d0e7017d4aabc1d19f3eb&site=xueshu_se&hitarticle=1
[27] ZHA Weibin, SUN Jianguo, WANG Guangji, et al. LC-ESI-MS determination of roxithromycin in tissues of beagle dogs after multiple dosing of roxithromycin sustained release tablets[J]. Chromatographia, 2007, 66(7/8): 475-480. https://xueshu.baidu.com/usercenter/paper/show?paperid=fe98581a973df7c999ca4b9c5c46c0f4&site=xueshu_se&hitarticle=1
[28] AGUILERA-LUIZ M, MARTINEZ VIDAL J, ROMERO-GONZALEZ R, et al. Multi-residue determination of veterinary drugs in milk by ultra-high-pressure liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2008, 1205(1/2): 10-16. https://xueshu.baidu.com/usercenter/paper/show?paperid=50f7ae01c6affc4caf98cc6e60856f19&site=xueshu_se&hitarticle=1
[29] 徐锦忠, 储晓刚, 胡小钟, 等. 液相色谱在线净化-电喷雾串联质谱测定水产品中大环内酯和林可胺类药物残留[J]. 分析试验室, 2009, 28(12): 26-30. https://xueshu.baidu.com/usercenter/paper/show?paperid=83f9fd2fd6d50a4156a155634a51df96&site=xueshu_se&hitarticle=1 XU Jinzhong, CHU Xiaogang, HU Xiaozhong, et al. Determination of macrolide and lincoamide antibiotic residues in aquatic products by LC-ESI-MS/MS with online cleanup[J]. Chin J Anal Lab, 2009, 28(12): 26-30. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=83f9fd2fd6d50a4156a155634a51df96&site=xueshu_se&hitarticle=1



 下载:
下载:








 粤公网安备 44010502001741号
粤公网安备 44010502001741号
