Effects of temperature, salinity and pH on oxygen consumption of gill tissue in vitro of juvenile Trachinotus ovatus
-
摘要:
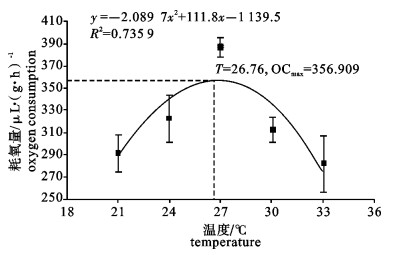
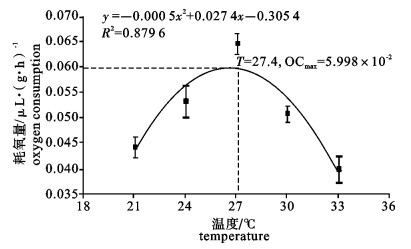
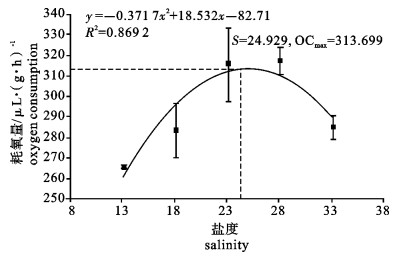
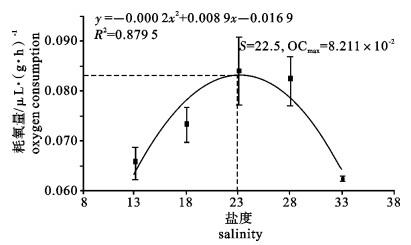
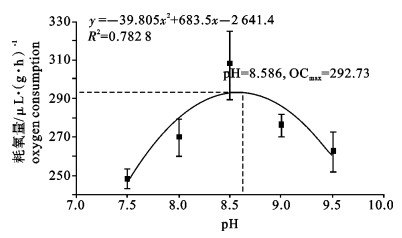
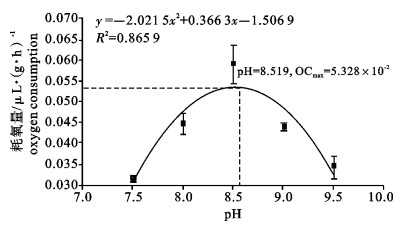
运用SKW-3微量呼吸仪对卵形鲳鲹(Trachinotus ovatus)幼鱼离体鳃组织的耗氧量进行了测定, 研究了温度、盐度、pH对卵形鲳鲹幼鱼离体鳃组织耗氧量和单位呼吸面积耗氧量的影响。结果显示, 卵形鲳鲹幼鱼离体鳃组织的耗氧量和单位呼吸面积的耗氧量均随着温度、盐度、pH的上升而逐渐增高, 在水温27 ℃、盐度28和pH 8.5时, 离体鳃组织的耗氧量达到最大值; 在水温27 ℃、盐度23和pH 8.5时单位呼吸面积的耗氧量达最大值; 随后耗氧量均逐渐减小。经方差分析, 温度、盐度、pH对离体鳃组织耗氧量的影响均显著(P < 0.05);温度和盐度对离体鳃组织单位呼吸面积的耗氧量影响极显著(P < 0.01);pH对离体鳃组织单位呼吸面积的耗氧量影响也达显著水平(P < 0.05);其中盐度为18和33这2组的离体鳃组织耗氧量差异不显著(P>0.05)。
Abstract:With SKW-3 instrument, we determined the oxygen consumption (OC) of gill tissue in vitro and of per unit respiratory area gill tissue in vitro of juvenile Trachinotus ovatus to investigate the effects of temperature, salinity and pH on them. The results reveal that with the increase of temperature, salinity and pH, the OC of gill tissue in vitro and of per unit respiratory area gill tissue in vitro of juvenile T.ovatus increase. Under the conditions of water temperature 27 ℃, salinity 28 and pH 8.5, the OC of gill tissue in vitro reaches the maximum value but then declines gradually; under the conditions of water temperature 27 ℃, salinity 23 and pH 8.5, the OC of per unit respiratory area gill tissue in vitro has the same situation as above. Water temperature, salinity and pH have significant effects on the OC of gill tissue in vitro (P < 0.05); temperature and salinity have very significant effects on the OC of per unit respiratory area (P < 0.01); pH has significant effect on the OC of per unit respiratory area (P < 0.05). There is no significant difference in the effects of salinity 18 and 33 on the OC of gill tissue in vitro of juvenile T.ovatus (P> 0.05).
-
Keywords:
- Trachinotus ovatus /
- juvenile /
- gill tissue in vitro /
- oxygen consumption
-
近年来,由于人类活动和全球气温上升的影响,中国南海近海海水中的重金属离子浓度逐年升高,尤其是汞离子(Hg2+)、镉离子(Cd2+)以及铅离子(Pb2+)[1-2]。重金属离子在海洋环境中随着生物链在海洋生物体内积累,对于绝大多数重金属离子,当其浓度高于生物可承受的阈值时对海洋生态系统中的动植物危害极大[3-5]。大型海藻处于海洋食物链的前端,其在早期发育阶段比其他水生动物对重金属离子更敏感[6]。通过探索海藻幼体对重金属离子的适应范围,得到的研究结果能指导合理地调控海水中的重金属离子,以避免育苗过程中海藻幼体受到重金属离子的毒害作用。单一重金属离子污染对大型海藻的毒性效应研究已有许多报道[7],而事实上,海洋环境的重金属污染常表现为复合污染,各种重金属离子对大型海藻的毒性相互影响,但迄今,复合重金属离子污染对海藻类联合毒性效应的研究报道较少[8]。国外关于多种重金属离子对褐藻产生联合毒性效应的研究起步较早[9-10],而中国鲜见此类研究报道。目前,关于海水中Hg2+、Cd2+、Pb2+对大型海藻幼孢子体的联合毒性效应未见有报道。
张氏马尾藻(Sargassum zhangii Tseng et Lu)隶属褐藻门、圆子纲、墨角藻目、马尾藻科、马尾藻属,主要分布于中国广东、海南等地[11]。作为褐藻门植物,张氏马尾藻的应用价值很高,但目前其育苗技术不完善严重制约着其养殖及推广。在育苗过程中,除了需要控制光照、温度等非生物因素之外[12],海水中的重金属离子浓度也直接影响幼孢子体生长和成活率。此研究以张氏马尾藻幼孢子体为实验材料,探究海水中不同浓度的Hg2+、Cd2+、Pb2+对张氏马尾藻幼孢子体的生物毒性效应,以期为马尾藻育苗过程中水质调控提供基础理论依据。
1. 材料与方法
1.1 张氏马尾藻幼孢子体的采集
从湛江市徐闻县北港码头采集已具有生殖托雏形的张氏马尾藻成体,及时运回实验室,用消毒海水清洗后,在暂养条件为温度(28±0.5) ℃,光照强度(4 000±100)lx,光暗周期14 h ∶ 10 h,盐度29±0.5,pH 8.0±0.2,充气培养。10 d后生殖托达到成熟后对生殖托进行升温促排,促排条件为温度30 ℃,盐度31,水流速度70 r · min-1,光照强度0 lx。将收集的受精卵在光照培养箱中进行培养,培养条件为温度(25±0.5) ℃,光照强度(2 500±100) lx,光暗周期10 h ∶ 14 h,盐度29±0.5,pH 8.0±0.2。当受精卵发育至长度为6~7 mm的幼孢子体阶段时,挑取长度和分枝数一致的幼孢子体进行毒性实验。
1.2 重金属离子胁迫实验设计
实验分为单因子实验和正交实验2个部分。单因子实验中Hg2+、Cd2+、Pb2+均按离子浓度设置0.04 μmol · L-1、0.2 μmol · L-1、1.0 μmol · L-1、5.0 μmol · L-1、25.0 μmol · L-15个实验组,实验进行12 d。正交实验采用三水平三因素正交设计,以Hg2+、Cd2+、Pb2+为三因素,以单因子实验得到的半抑制浓度为上下限设置三水平,即水平3为单因子实验中1~3 d的半抑制浓度,水平1为单因子实验中4~6 d的半抑制浓度[10],根据各因素及水平进行正交设计,正交实验进行3 d。在胁迫实验开始后,每3 d用游标卡尺测量幼孢子体的长度,每个幼孢子体测量3次,读数取平均值。在测量的同时,记录各组幼孢子体形态特征的变化[13-14],并用中性红染色法检测幼孢子体是否死亡,当死亡细胞数占细胞总数的80%以上即认定为孢子体死亡[15]。每3 d更换一次培养液。
1.3 胁迫实验条件
将氯化铅(PdCl2)、氯化镉(CdCl2 · 2.5H2O)、氯化汞(HgCl2)分析纯试剂用超纯水(Milli-Q)分别配制成离子质量浓度为1 000 mg · L-1的金属母液。实验前,用消毒海水(经0.45 μm的水相滤膜过滤)将金属母液进一步稀释成实验所需的各种离子浓度的培养液。每个实验组准确量取100 mL所需的培养液至150 mL小烧杯中。各组随机挑取30个幼孢子体,测量原始长度后放入烧杯中。每个实验组均设置3个平行组,以天然消毒海水为对照组。经电感耦合等离子体质谱仪(Agilent ICP-MS 7500CX)进行测定,天然消毒海水中Hg2+、Cd2+、Pb2+浓度分别为0.000 3 μmol · L-1、0.01 μmol ·L-1、0.008 μmol · L-1。每个实验组培养条件均为温度(28±0.5) ℃,光照强度(3 000±100) lx,光暗周期14 h : 10 h,盐度29±0.5,pH 8.0±0.2。实验中的盐度采用便携式盐度计(ATAGO)测定,光照强度采用分体式照度计(SMART SENSOR)测定,pH采用pH计(Sartorius PB-21)测定。
1.4 数据处理及统计分析
特定生长率计算公式:SGR=100(lnLt-lnL0)/t[16]。式中SGR为幼孢子体特定生长率(% ·d-1);t为实验天数(d);L0(mm)为实验开始时的幼孢子体平均长度;Lt(mm)为实验结束时的幼孢子体平均长度。抑制率计算公式:IR=(D0-Di)/D0×100%[17]。式中IR为各时段每个实验组对幼孢子体生长的抑制率(%);Di为各时段每个实验组的特定生长率;D0为各时段对照组的特定生长率。
将各个时段不同重金属离子浓度值与其对应的抑制率值用SPSS 18.0进行Probit回归分析得出各种重金属离子每个时段的生长半抑制浓度(IC50)。所得数据用SPSS 18.0进行分析,结果以平均值±标准差表示。采用方差分析以及Tukey多重比较检验处理组间的差异显著性(P<0.05),并用Origin 8.0作图[16]。
2. 结果与分析
2.1 Hg2+对幼孢子体生长率及形态变化的影响
海水中的Hg2+对幼孢子体的毒性效应与Hg2+浓度和胁迫时间有关。在1~3 d、3~6 d、7~9 d、10~12 d 4个不同时期,5组不同Hg2+浓度的实验组与对照组相比较,幼孢子体特定生长率均有明显差异(P<0.05)(表 1)。随着培养时间的延长,各实验组的幼孢子体特定生长率都逐渐降低,且各时期的特定生长率差异明显(P<0.05)。浓度为0.2 μmol · L-1时幼孢子体在6 d后停止生长,随着离子浓度的升高,幼孢子体停止生长的时间逐渐提前(图 1-A)。
表 1 张氏马尾藻幼孢子体在不同浓度Hg2+、Cd2+、Pb2+溶液胁迫12 d内的特定生长率Table 1. Specific growth rates of S. zhangii Tseng et Lu germlings with exposure to different concentrations of Hg2+, Cd2+ and Pb2+ during 12 d处理
treatment特定生长率/%·d-1 specific growth rate 1~3 d 4~6 d 7~9 d 10~12 d c(Hg2+)/μmol·L-1 0.04 0.93±0.08b 0.76±0.03b 0.55±0.06b 0.11±0.02b 0.2 0.25±0.05c 0.17±0.03c 0.00±0.00c 0.00±0.00c 1.0 0.13±0.02c 0.00±0.00d 0.00±0.00c 0.00±0.00c 5.0 0.00±0.00d 0.00±0.00d 0.00±0.00c 0.00±0.00c 25.0 0.00±0.00d 0.00±0.00d 0.00±0.00c 0.00±0.00c c(Cd2+)/μmol·L-1 0.04 1.81±0.04b 1.48±0.07b 0.93±0.05b 0.43±0.03b 0.2 1.25±0.02c 0.97±0.11c 0.53±0.05c 0.10±0.02c 1.0 1.11±0.05c 0.82±0.04c 0.12±0.02d 0.00±0.00d 5.0 0.47±0.08d 0.15±0.00d 0.00±0.00e 0.00±0.00d 25.0 0.13±0.02e 0.00±0.00d 0.00±0.00e 0.00±0.00d c(Pb2+)/μmol·L-1 0.04 2.36±0.04b 2.22±0.03b 1.60±0.06b 1.24±0.01b 0.2 1.56±0.02c 1.27±0.05c 0.88±0.02c 0.40±0.04c 1.0 1.36±0.04d 1.01±0.06d 0.53±0.05d 0.00±0.00d 5.0 0.56±0.05e 0.38±0.03e 0.00±0.00e 0.00±0.00d 25.0 0.33±0.02f 0.00±0.00f 0.00±0.00e 0.00±0.00d 自然海水natural seawater 2.65±0.05a 2.69±0.04a 3.02±0.04a 3.38±0.05a 注:不同小写字母表示处理间差异显著,根据方差分析和Tukey检验(P<0.05);数据为平均值±标准差(n=3)
Notes:Different lowercase letters represent significant difference among the treatments,according to ANOVA and Tukey′s posteriori test (P<0.05);date are X±SD (n=3).![]() 图 1 张氏马尾藻幼孢子体在不同浓度Hg2+、Cd2+、Pb2+溶液胁迫12 d内的特定生长率变化直方图不同小写字母表示处理间差异显著;Ns代表自然海水对照组Figure 1. Histograph for describing specific growth rate of S. zhangii Tseng et Lu germlings with exposure to different concentrations of Hg2+, Cd2+ and Pb2+ during 12 dDifferent lowercase letters represent significant difference among the treatments. Ns represents control group.
图 1 张氏马尾藻幼孢子体在不同浓度Hg2+、Cd2+、Pb2+溶液胁迫12 d内的特定生长率变化直方图不同小写字母表示处理间差异显著;Ns代表自然海水对照组Figure 1. Histograph for describing specific growth rate of S. zhangii Tseng et Lu germlings with exposure to different concentrations of Hg2+, Cd2+ and Pb2+ during 12 dDifferent lowercase letters represent significant difference among the treatments. Ns represents control group.分析表 2中的幼孢子体形态变化,同一时期内,随着Hg2+浓度升高,幼孢子体具不健康形态和颜色的分枝逐渐增多,甚至死亡;同一Hg2+浓度组,随着培养时间的延长,幼孢子体具不健康形态和颜色的分枝也逐渐增多或者死亡。当离子浓度为0.2 μmol · L-1时,幼孢子体在第12天时经检测死亡,随着离子浓度升高,幼孢子体死亡时间逐渐提前。由表 3得出,12 d内Hg2+对幼孢子体生长的半抑制浓度(IC50)为0.026~0.084 μmol · L-1,且随着胁迫时间的延长,Hg2+的半抑制浓度逐渐降低。比较半抑制浓度,Hg2+的值在各个时期时都为3种离子中最低。
表 2 张氏马尾藻幼孢子体在不同浓度Hg2+、Cd2+、Pb2+溶液胁迫12 d内的外部形态变化Table 2. Visual changes of S. zhangii Tseng et Lu germlings with exposure to different concentrations of Hg2+, Cd2+ and Pb2+ during 12 d处理
treatment实验周期/d duration of experiment 0 3 6 9 12 自然海水natural seawater H H H H H c(Hg2+)/μmol·L-1 0.04 H UL UL UM UM 0.2 H UM UM UA - 1.0 H UM UA - 5.0 H UM UA - 25.0 H UM UA - c(Cd2+)/μmol·L-1 0.04 H H H H H 0.2 H H UL UL UL 1.0 H H UL UM UM 5.0 H UL UM UM UA 25.0 H UM UM UA - c(Pb2+)/μmol·L-1 0.04 H H H H H 0.2 H H H UL UL 1.0 H H UL UL UM 5.0 H UL UL UM UM 25.0 H UL UM UM UA 注:H. 张氏马尾藻幼孢子体形态健康,各分枝呈淡黄色;UL. 幼孢子体有部分分枝呈暗黑色,少数分枝脱落;UM. 幼孢子体大多数分枝颜色呈深黑,且脱落;UA. 幼孢子体所有的分枝呈深黑色,且断裂脱落;-. 幼孢子体死亡
Note:H. S. zhangii Tseng et Lu germlings appeared healthy with all the faint yellow branches; UL. germlings appeared unhealthy with little furvous and deciduous branches; UM. germlings appeared unhealthy with most furvous and deciduous branches; UA. germlings appeared unhealthy with all the furvous and deciduous branches; -. germlings appeared to be dead表 3 12 d内各种重金属离子对张氏马尾藻幼孢子体的半抑制浓度Table 3. Median inhibitory concentrations of single heavy metal ion in natural seawater to S. zhangii Tseng et Lu germlings during 12 d重金属离子
heavy metal ion半抑制浓度IC50/μmol·L-1 median inhibitory concentration 1~3 d 4~6 d 7~9 d 10~12 d Hg2+ 0.084±0.018 0.057±0.001 0.031±0.001 0.026±0.000 Cd2+ 2.887±0.297 0.688±0.081 0.093±0.001 0.040±0.000 Pb2+ 6.413±0.173 1.594±0.015 0.286±0.018 0.073±0.002 2.2 Cd2+对幼孢子体生长率及形态变化的影响
海水中的Cd2+对幼孢子体的毒性效应与Cd2+浓度和胁迫时间有关。在4个不同时期,5组不同Cd2+浓度的实验组与对照组相比较,幼孢子体特定生长率都有明显差异(P<0.05)(表 1)。随着培养时间的延长,各实验组的幼孢子体特定生长率都逐渐降低,且各时期的特定生长率差异明显(P<0.05)。离子浓度为1 μmol · L-1时幼孢子体在9 d后停止生长,随着离子浓度的升高,幼孢子体停止生长的时间逐渐提前(图 1-B)。
分析表 2中的幼孢子体形态变化,同一时期内,随着海水中Cd2+浓度的升高,幼孢子体具不健康形态和颜色的分枝逐渐增多;同一Cd2+浓度组,随着培养时间的延长,幼孢子体具不健康形态和颜色的分枝也逐渐增多,甚至死亡。在离子浓度为25 μmol · L-1时,幼孢子体在第12天时经检测死亡。离子浓度低于25 μmol · L-1时幼孢子体在12 d内未见死亡,但高浓度组的幼孢子体受损严重。12 d内Cd2+对幼孢子体生长的IC50为0.040~2.887 μmol · L-1,且随着胁迫时间的延长,Cd2+的半抑制浓度逐渐降低(表 3)。比较半抑制浓度,Cd2+的值在各个时期都高于Hg2+的值而低于Pb2+的值。
2.3 Pb2+对幼孢子体生长率及形态变化的影响
海水中的Pb2+对幼孢子体的毒性效应与Pb2+浓度和胁迫时间有关。在4个不同时期,5组不同Pb2+浓度的实验组与对照组相比较,幼孢子体的特定生长率都有明显差异(P<0.05)(表 1)。随着培养时间的延长,各实验组的幼孢子体特定生长率都逐渐降低,且各时期的特定生长率差异明显(P<0.05)。离子浓度为1 μmol · L-1时幼孢子体在9 d后停止生长,随着离子浓度的升高,幼孢子体停止生长的时间逐渐提前(图 1-C)。
分析表 2中的幼孢子体形态变化,同一时期内,随着海水中Pb2+浓度的升高,幼孢子体具不健康形态和颜色的分枝逐渐增多;同一Pb2+浓度组,随着培养时间的延长,幼孢子体具不健康形态和颜色的分枝也逐渐增多。在12 d内各组未见死亡幼孢子体,但高浓度组的幼孢子体受损严重。12 d内Pb2+对幼孢子体生长的半抑制浓度IC50为0.073~6.413 μmol · L-1,且随着胁迫时间的延长,Pb2+的半抑制浓度逐渐降低(表 3)。比较半抑制浓度,Pb2+的值在各个时期都高于Hg2+和Cd2+的值。
2.4 Hg2+、Cd2+、Pb2+对幼孢子体生长的联合影响
分析表 4中各实验组的特定生长率,各实验组与对照组相比差异显著(P<0.05),且有多个实验组间的差异也显著(P<0.05)。通过对特定生长率进行计算得到抑制率,进而对抑制率进行一般线性模型分析,得到单因素统计量Kn值见表 4。比较各重金属离子的Kn值,3种不同Hg2+浓度对应的K值间差异显著(P<0.05),当浓度处于水平3时,K值最大;3种不同Cd2+浓度对应的K值间差异显著(P<0.05),浓度处于水平3时K值最大;Pb2+浓度处于水平1和2时各自对应的K值间差异不显著(P>0.05),当浓度处于水平3时,K值最小且与K1、K2差异显著(P<0.05)。分析各重金属离子Kn的极差值R,其大小为Hg2+>Cd2+>Pb2+。此外,比较各种重金属离子在同一浓度水平时的K值,离子浓度同为水平3时3种重金属离子的K值大小为Hg2+>Cd2+>Pb2+,且差异显著(P<0.05);离子浓度同为水平2时3种重金属离子的K值大小为Hg2+<Cd2+<Pb2+,且Hg2+、Cd2+的K值之间差异显著(P<0.05),Cd2+、Pb2+的K值之间差异不显著(P>0.05);离子浓度同为水平1时,3种重金属离子的K值大小为Hg2+<Cd2+<Pb2+,且差异显著(P<0.05)。对单因素统计量Kn值进行Probit回归分析,得到表 5中正交实验3 d内各重金属离子的半抑制浓度IC50分别为0.076 μmol · L-1(Hg2+)、2.738 μmol · L-1(Cd2+)、6.469 μmol · L-1(Pb2+)。
表 4 正交设计表及其响应值Table 4. Orthogonal design of three levels and response value组别
groupHg2+水平
Hg2+ levelCd2+水平
Cd2+ levelPb2+水平
Pb2+ level特定生长率/%·d-1
specific growth rate抑制率/%
inhibitory rate1 3 3 1 1.02±0.05h 61.3±2.0a 2 1 2 3 2.05±0.02c 22.4±0.9f 3 3 1 3 1.30±0.03f 50.9±1.2c 4 1 3 2 1.97±0.01c 25.7±0.4f 5 2 3 3 1.58±0.03e 40.3±1.4d 6 3 2 2 1.12±0.03g 57.5±1.2b 7 2 2 1 1.66±0.02de 37.4±0.7de 8 2 1 2 1.73±0.02d 34.5±1.0e 9 1 1 1 2.16±0.02b 18.3±0.8g 对照组control - - - 2.65±0.05a - 显著值P significance 0.000 0.000 0.090 K1 22.1±0.4c 34.6±0.4b 39.0±0.4a K2 37.4±0.4b 39.1±0.4a 39.2±0.4a K3 56.6±0.4a 42.4±0.4b 37.8±0.4c R极差range 34.5 7.8 1.4 主次顺序important order Hg2+>Cd2+>Pb2+ 最优组合optimal combination 3 3 2 注:Kn. 3种不同重金属离子抑制率均值,n. 3种不同的浓度水平;不同小写字母表示处理间差异显著,根据方差分析和Tukey检验(P<0.05);数据为平均值±标准差(n=3)
Note: Kn represents average value of inhibitory rates of three kinds of heavy metal ions at different levels; n represents range of different levels. Different lowercase letters represent significant difference among the treatments,according to bifactorial ANOVA and Tukey′s a posteriori test (P<0.05);date are X ±SD (n=3).表 5 正交设计中各因素水平对应的浓度值及IC50值Table 5. Concentrations of different levels for orthogonal design and IC50 value水平
level因素 factor c(Hg2+)/μmol·L-1 c(Cd2+)/μmol·L-1 c(Pb2+)/μmol·L-1 1 0.06 0.7 1.5 2 0.07 1.4 3.0 3 0.08 2.8 6.0 半抑制浓度IC50 median inhibitory concentration 0.076 2.738 6.469 3. 讨论
3.1 Hg2+对张氏马尾藻幼孢子体的生物毒性
近海海水环境中的Hg2+浓度相比于Cd2+、Pb2+小[2, 18],但Hg2+的生物毒性在三者中最强,其在低质量浓度(0.87~1.5 μg · L-1)时就能产生高毒性作用,并沿着食物链进行生物浓缩[19],对海洋生物危害极大[20]。这与此研究中Hg2+对幼孢子体的生物毒性特点相符合。此研究得出,海水中Hg2+浓度范围为0.04~1.0 μmol · L-1时,含不同浓度Hg2+的海水对幼孢子体生长均有抑制作用,且抑制作用随Hg2+浓度升高而显著增强。此外,含不同浓度Hg2+的海水对幼孢子体的生长抑制效果随胁迫时间延长而逐渐累积。在已有的研究中,Hg2+对其他各种大型海藻幼孢子体生长的IC50范围为36~463 μg · L-1[21-22],相比于前者,此研究中Hg2+对张氏马尾藻幼孢子体生长的IC50(5.2~16.8 μg · L-1)为最低,说明张氏马尾藻幼孢子体对Hg2+的耐受力低。此研究中含Hg2+实验组的幼孢子体形态和颜色的变化规律与生长率变化规律基本一致,从形态学方面证明了Hg2+对幼孢子体具有强生物毒性,且随浓度升高和时间延长而变化明显。综上所述,建议在张氏马尾藻育苗过程中海水中的Hg2+浓度控制在0.04 μmol · L-1以下。
3.2 Cd2+对张氏马尾藻幼孢子体的生物毒性
研究得出,海水中Cd2+浓度范围为0.04~25 μmol · L-1时,含不同浓度Cd2+的海水对幼孢子体生长都有抑制作用,且抑制作用随Cd2+浓度升高而显著增强。从细胞水平分析其原因可能为实验初期,海水中的Cd2+首先与细胞壁上的藻朊酸盐等多糖结合,再通过细胞膜离子交换进入细胞,并逐渐累积,在一定时间内达到交换平衡。海水中的Cd2+浓度越大,细胞的离子交换达到平衡需要时间越短,故随着Cd2+浓度升高,Cd2+在早期对幼孢子体的抑制越强[23],这与实验结果相符。此外,含不同浓度Cd2+的海水对幼孢子体的生长抑制效果随胁迫时间延长而逐渐累积。随着胁迫时间延长,进入细胞内的Cd2+对细胞酶系统、遗传物质等损伤加重,同时细胞膜功能也会受到严重破坏,甚至失去选择透过功能[24]。结果造成后期大量的Cd2+进入细胞内,使细胞功能大量丧失,进而导致细胞死亡。
此外,Cd2+对大多数大型海藻的细胞毒性会通过藻体外部形态表现出来[13],如HAN等[25]通过研究石莼(Ulva)的藻体形态及颜色变化与重金属毒性的关系,发现重金属离子的高生物毒性导致藻体形态及颜色变化显著。该研究中Cd2+实验组的幼孢子体形态和颜色的变化规律与生长率变化规律基本一致,进一步说明Cd2+对幼孢子体有较强的生物毒性,且随浓度升高和时间延长而变化明显。通过分析半抑制浓度得出,海水中Cd2+对幼孢子体生长的抑制效果比Hg2+弱而强于Pb2+。综上所述,建议在育苗过程中海水中的Cd2+浓度控制在0.04 μmol · L-1以下。
3.3 Pb2+对张氏马尾藻幼孢子体的生物毒性
研究结果表明,海水中Pb2+浓度为0.04~25 μmol · L-1时,含不同浓度Pb2+的海水对幼孢子体生长都有抑制作用,且抑制作用随Pb2+浓度升高而显著增强。且含不同浓度Pb2+的海水对幼孢子体的生长抑制效果随胁迫时间延长而逐渐累积。Pb2+作用于海藻细胞的毒性机理与Hg2+、Cd2+相似,其以离子交换的方式进入细胞内,作用于抗氧化系统、电子转运链等细胞组分,造成细胞损伤[26]。中国近海岸污染严重区域的沉积物中Pb质量浓度可达约50 mg · L-1,相比Cd、Hg为最高;且已有研究也表明,沉积物中的重金属含量与海水中的Pb2+含量基本成正相关[27],故相比于Cd2+和Hg2+,Pb2+在海水中的含量高。而藻体细胞的细胞膜上的官能团更倾向结合Pb2+,所以藻体细胞内Pb2+的含量最多[28-29]。但此研究表明海水中Pb2+对幼孢子体生长抑制效果比Hg2+、Cd2+弱。其原因可能为Pb2+作用于细胞各组分的具体机制与Hg2+、Cd2+不同,从而幼孢子体对其耐受性较强。在已往的大多数研究也发现Pb2+对大型海藻的毒性相对较弱[2, 30]。另外,与已有的研究进行比较表明,不同物种对这3种重金属离子的耐受力也不同。如HAN等[31]研究重金属离子对海带(Saccharina japonica)幼孢子体的毒性效应,对IC50进行分析,发现重金属离子对幼孢子体的毒性强弱为Hg2+>Pb2+>Cd2+,而该研究结果为Hg2+>Cd2+>Pb2+。海水中的Pb2+也对海藻外部形态产生影响[32],该研究中Pb2+实验组的幼孢子体形态和颜色变化规律与生长率变化规律基本一致,进一步表明Pb2+对幼孢子体有较强的生物毒性,且随浓度升高和时间延长而变化明显。综上所述,建议在育苗过程中海水中的Pb2+浓度控制在0.04 μmol · L-1以下。
3.4 Hg2+、Cd2+、Pb2+对张氏马尾藻的联合毒性作用
混合重金属离子对海洋生物的毒性机理受到离子浓度、环境条件等多种因素影响,其作用于海洋生物的机理是复杂的。复合污染对生物体的联合效应通常比其相应单因子污染作用要复杂得多,可表现为协同、加和、拮抗等多种作用[8-10, 14, 33]。通过分析特定生长率,得出各重金属离子组合对幼孢子体的联合毒性效果具有明显差异,说明重金属离子联合作用机理复杂。在某一水平下K值越大,表明重金属离子在该水平下对幼孢子体的毒性越强,由此得出,当Hg2+、Cd2+、Pb2+浓度分别以0.08 μmol · L-1、2.8 μmol · L-1、3 μmol · L-1共存时,对幼孢子体的毒性最强。另外,根据结果分析中的极差值得出当3种重金属离子联合作用时其毒性大小为Hg2+>Cd2+>Pb2+。
此外,通过比较各种重金属离子在同一浓度水平时的K值,判断3种水平下各重金属离子对幼孢子体生长的抑制效应大小。当离子浓度同为水平3时,3种重金属离子对幼孢子体的抑制效应大小为Hg2+>Cd2+>Pb2+;而离子浓度同为水平2时,抑制效应大小为Hg2+<Cd2+<Pb2+;同理,离子浓度同为水平1时,抑制效应大小为Hg2+<Cd2+<Pb2+。根据大型海藻细胞膜的离子交换机制,离子交换后细胞内外电位达到平衡,且细胞所能交换的离子总量在一定条件下是恒定的。细胞正常时,细胞壁表面的酸性官能团结合的重金属离子所带电荷与被交换出去的钠离子总电荷相等[23]。而当Hg2+、Cd2+、Pb2+同时存在时,官能团的选择系数即离子亲和强度为Hg2+<Cd2+<Pb2+[34]。在产生联合毒性时,各重金属离子处于低浓度水平时,对Pb2+的吸附量相比于Hg2+、Cd2+较多。虽然Pb2+毒性效应相对最弱,但最终细胞内含量大,所以Pb2+起主导抑制效应,Cd2+其次。各重金属离子处于高浓度水平时,Hg2+吸附量逐渐增大。即使最终细胞内的Hg2+含量不及Pb2+,但其毒性远强于Cd2+、Pb2+,所以Hg2+起主导抑制效应,Cd2+其次。
比较正交实验中各重金属离子对幼孢子体的半抑制浓度IC50与单因子实验中的半抑制浓度IC50。正交实验中,Hg2+、Cd2+对幼孢子体的生长抑制程度相比于单因子实验有所加深,而Pb2+对幼孢子体的生长抑制程度稍有减弱。根据上述的离子交换原理,在实验前期,幼孢子体细胞的细胞膜未受到破坏,各细胞离子交换量是相对一定的。所以各种重金属离子的交换量主要同其与酸性官能团的亲和度有关,其次与海水环境中各重金属离子浓度有关。进行联合毒性时,各重金属离子浓度水平的设置相对一致,Pb2+的官能团亲和力最强,但其在联合作用时对生长的抑制减弱;据此推测其原因可能是Hg2+、Cd2+对Pb2+产生了拮抗减弱效应。同理,Hg2+、Cd2+两者呈现协同增强效应。综上所述,建议在育苗过程中应严格控制Hg2+、Cd2+、Pb2+的浓度,避免海水中3种重金属离子的联合作用,特别是Hg2+、Cd2+两者的联合作用。但海水中存在的其他重金属离子对幼孢子体产生的毒性作用以及它们之间的联合效应仍需探究。
-
-
[1] 区又君, 李加儿. 卵形鲳鲹的早期胚胎发育[J]. 中国水产科学, 2005, 12(6): 787-789. https://xueshu.baidu.com/usercenter/paper/show?paperid=ffa9cdf555812f7f4469c63bee73a14c&site=xueshu_se&hitarticle=1 OU Youjun, LI Jia'er. Early embryonic development in Trachinotus ovatus[J]. J Fish Sci China, 2005, 12(6): 787-789. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=ffa9cdf555812f7f4469c63bee73a14c&site=xueshu_se&hitarticle=1
[2] 成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 341-342. https://xueshu.baidu.com/usercenter/paper/show?paperid=a5d5ac39e8a89442ea7f063f7b4129b0&site=xueshu_se CHENG Qingtai, ZHENG Baoshan. Systematic synopsis of Chinese fishes[M]. Beijing: Science Press, 1987: 341-342. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=a5d5ac39e8a89442ea7f063f7b4129b0&site=xueshu_se
[3] 麦贤杰, 黄伟健, 叶富良, 等. 海水鱼类繁殖生物学和人工繁育[M]. 北京: 海洋出版社, 2006: 106-114. https://xueshu.baidu.com/usercenter/paper/show?paperid=2f87e2bf8e59c3e8a8ee575781f34d30&site=xueshu_se&hitarticle=1 MAI Xianjie, HUANG Weijian, YE Fuliang, et al. Marine fish breeding biology and artificial breeding[M]. Beijing: Ocean Press, 2006: 106-114. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=2f87e2bf8e59c3e8a8ee575781f34d30&site=xueshu_se&hitarticle=1
[4] 许晓娟, 李加儿, 区又君. 盐度对卵形鲳鲹胚胎发育和早期仔鱼的影响[J]. 南方水产, 2009, 5(6): 31-35. doi: 10.3969/j.issn.1673-2227.2009.06.006 XU Xiaojuan, LI Jia'er, OU Youjun. Effects of salinity on embryonic development and early larvae in ovate pompano Trachinotus ovatus[J]. South China Fish Sci, 2009, 5(6): 31-35. (in Chinese) doi: 10.3969/j.issn.1673-2227.2009.06.006
[5] 陈伟洲, 许鼎盛, 王德强, 等. 卵形鲳鲹人工繁殖及育苗技术研究[J]. 台湾海峡, 2007, 26(3): 435-442. doi: 10.3969/j.issn.1000-8160.2007.03.019 CHEN Weizhou, XU Dingsheng, WANG Deqiang, et al. Study on the spawning and hatching technique for Trachinotus ovatus[J]. J Oceanogr Taiwan Strait, 2007, 26(3): 435-442. (in Chinese) doi: 10.3969/j.issn.1000-8160.2007.03.019
[6] 许晓娟, 李加儿, 区又君, 等. 深水网箱养殖卵形鲳鲹血液指标[J]. 动物学杂志, 2008, 43(6): 109-116. doi: 10.3969/j.issn.0250-3263.2008.06.016 XU Xiaojuan, LI Jia'er, OU Youjun. Hematological indices in Trachinotus ovatus reared in submersible cage[J]. Chin J Zool, 2008, 43(6): 109-116. (in Chinese) doi: 10.3969/j.issn.0250-3263.2008.06.016
[7] 王刚, 李加儿, 区又君, 等. 卵形鲳鲹幼鱼耗氧率和排氨率的初步研究[J]. 动物学杂志, 2010, 45(3): 116-121. https://xueshu.baidu.com/usercenter/paper/show?paperid=700cedd89295c6ea86a3a743b6677333&site=xueshu_se&hitarticle=1 WANG Gang, LI Jia'er, OU Youjun, et al. Oxygen consumption and ammonia excretion of the juvenile Trachinoms ovatus[J]. Chin J Zool, 2010, 45(3): 116-121. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=700cedd89295c6ea86a3a743b6677333&site=xueshu_se&hitarticle=1
[8] 王刚, 李加儿, 区又君, 等. 卵形鲳鲹胚胎及早期仔鱼耗氧量的研究[J]. 生态科学, 2010, 29(6): 518-523. doi: 10.3969/j.issn.1008-8873.2010.06.004 WANG Gang, LI Jia'er, OU Youjun, et al. Study on oxygen consumption of embryo and early larva Trachinoms ovatus[J]. Ecol Sci, 2010, 29(6): 518-523. (in Chinese) doi: 10.3969/j.issn.1008-8873.2010.06.004
[9] 关云凌, 李永凡. 牡蛎离体鳃组织耗氧量的初步研究[J]. 海洋与湖沼, 1988, 19(3): 210-214. https://xueshu.baidu.com/usercenter/paper/show?paperid=112fb6a5ab7869c49a2185b6b433d2fb&site=xueshu_se&hitarticle=1 GUAN Yunling, LI Yongfan. Preliminary studies on the oxygen consumption of gill tissue separated the oyster, Crassostrea rivularis[J]. Oceanlogia et Limnologia Sinica, 1988, 19(3): 210-214. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=112fb6a5ab7869c49a2185b6b433d2fb&site=xueshu_se&hitarticle=1
[10] 何永亮, 卵形鲳鲹早期发育阶段的研究[D]. 上海: 上海海洋大学, 2009: 52-54. HE Yongliang. Studies on early developmental stages of Trachinotus ovatus[D]. Shanghai: Shanghai Ocean University, 2009: 52-54. (in Chinese)
[11] HUGHES G M. The dimension of fish gills in relation to their function[J]. J Exp Biol, 1966, 45(1): 177-195. doi: 10.1242/jeb.45.1.177
[12] 殷名称. 鱼类生态学[M]. 北京: 中国农业出版社, 1995: 137-138. https://xueshu.baidu.com/usercenter/paper/show?paperid=57ce72a57694feba4d0f887226ad1faf&site=xueshu_se YIN Mingcheng. Fish ecology[M]. Beijing: China Agriculture Press, 1995: 137-138. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=57ce72a57694feba4d0f887226ad1faf&site=xueshu_se
[13] 朴树德, 周元聪, 胡彩钦. 低温下离体组织耗氧量的研究[J]. 中华外科杂志, 1961, 4: 301-303. https://xueshu.baidu.com/usercenter/paper/show?paperid=7c013a9155d58897b4a79eaaf09eb75c&site=xueshu_se&hitarticle=1 PIAO Shude, ZHOU Yuancong, HU Caiqin. Low temperatures from the oxygen consumption of tissue[J]. Chin J Surg, 1961, 4: 301-303. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=7c013a9155d58897b4a79eaaf09eb75c&site=xueshu_se&hitarticle=1
[14] RAO G M M. Oxygen consumption of rainbow trout Salmo gairdneri in relation to activity and salinity[J]. Can J Zool, 1968, 46(4): 781-786. doi: 10.1139/z68-108
[15] 王晓杰, 张秀梅, 姜明. 盐度胁迫对许氏平鲉鳃、头肾、脾脏超微结构的影响[J]. 中国海洋大学学报: 自然科学版, 2006, 36(增刊): 85-90. https://xueshu.baidu.com/usercenter/paper/show?paperid=1589335abbe5bb7746cc6e8b1ca9f875&site=xueshu_se&hitarticle=1 WANG Xiaojie, ZHANG Xiumei, JIANG Ming. Salinity stress on the ultrastructure of gill, head kidney and spleen of rockfish (Sebastes schlegeli)[J]. Periodic Ocean Univ China: Natural Science, 2006, 36(Suppl): 85-90. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=1589335abbe5bb7746cc6e8b1ca9f875&site=xueshu_se&hitarticle=1
[16] PISAM M, RAMBOURG A. Mitochondria-rich cells in the gill epithelium of teleost fishes: an ultrastructural approach[J]. Int Rev Cytol, 1991, 130(4): 191-232. https://xueshu.baidu.com/usercenter/paper/show?paperid=b0ecabd19d8be0b3ba7e6c2426beae55&site=xueshu_se&hitarticle=1
[17] CARMONA R, GARCIA-GALLEGO M, SANZ A, et al. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: ultrastructural modifications in seawater-acclimated specimens[J]. J Fish Biol, 2004, 64(2): 553-566. doi: 10.1111/j.0022-1112.2004.00321.x
[18] 王艳, 胡先成. 不同盐度下鲈鱼稚鱼鳃的显微结构观察[J]. 海洋科学, 2009, 33(12): 138-142. https://xueshu.baidu.com/usercenter/paper/show?paperid=ad3a4e6e2077922ca0890c9af9a9392b&site=xueshu_se WANG Yan, HU Xiancheng. Microscopical observation on the gill structure of juvenile Lateolabrax japonicas under different salinities[J]. Mar Sci, 2009, 33(12): 138-142. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=ad3a4e6e2077922ca0890c9af9a9392b&site=xueshu_se
[19] 魏渲辉, 汝少国, 徐路, 等. 海水和淡水适应过程中广盐性鱼类鳃氯细胞的形态与功能变化及其激素调节[J]. 海洋科学, 2001, 25(4): 16-20. https://xueshu.baidu.com/usercenter/paper/show?paperid=8c3cad1af52479c080b3b47ba3b8e868&site=xueshu_se&hitarticle=1 WEI Xuanhui, RU Shaoguo, XU Lu, et al. Structural and functional changes of euryhaline fish bronchial chloride cell and hormonal regulation during seawater and freshwater adaptation[J]. Mar Sci, 2001, 25(4): 16-20. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=8c3cad1af52479c080b3b47ba3b8e868&site=xueshu_se&hitarticle=1
[20] SINGER T, BALLANTYNE J. Sturgeon and paddlefish metabolism[J]. Fish Fish Ser, 2005, 27(1): 167-194.
[21] 张甫英, 李辛夫. 低pH对鱼类胚胎发育、鱼苗生长及鳃组织损伤影响的研究[J]. 水生生物学报, 1992, 16(2): 175-182. https://xueshu.baidu.com/usercenter/paper/show?paperid=fb1ca1559a64d2ff7c2123a040da3dec&site=xueshu_se&hitarticle=1 ZHANG Fuying, LI Xinfu. Studies on the effects of low pH on embryonic development, growth of the fry and the damage of gills of fishes[J]. Acta Hydrobiologica Sinica, 1992, 16(2): 175-182. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=fb1ca1559a64d2ff7c2123a040da3dec&site=xueshu_se&hitarticle=1
[22] 马广智, 唐玫, 徐军. 低pH对草鱼鳃和肝组织超氧化物歧化酶活性的影响[J]. 中国水产科学, 2001, 8(1): 23-25. https://xueshu.baidu.com/usercenter/paper/show?paperid=b2bf1022ddf2594286b0d2781b7f0e1c&site=xueshu_se&hitarticle=1 MA Guangzhi, TANG Mei, XU Jun. Effect of low pH on superoxide dismutase (SOD) activities of branchial and liver tissue of grass carp[J]. J Fish Sci China, 2001, 8(1): 23-25. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=b2bf1022ddf2594286b0d2781b7f0e1c&site=xueshu_se&hitarticle=1
[23] RANDALL D, LIN H, WRIGHT P A. Gill water flow and chemistry of the boundary layer[J]. Physiol Biochem Zool, 1991, 64(1): 26-38.
[24] 吴常文, 朱爱意, 赵向炯. 海水养殖杂交鲟耗氧量、耗氧率和窒息点的研究[J]. 浙江海洋学院学报, 2005, 24(2): 100-104. https://xueshu.baidu.com/usercenter/paper/show?paperid=7088bd4a6176ff2400994926f3955fa4&site=xueshu_se&hitarticle=1 WU Changwen, ZHU Aiyi, ZHAO Xiangjiong. Study on oxygen uptake, oxygen uptake rate and asphyxiation point of mari-culture hybrid sturgeon[J]. J Zhejiang Ocean Univ, 2005, 14(2): 100-104. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=7088bd4a6176ff2400994926f3955fa4&site=xueshu_se&hitarticle=1
[25] 闫茂仓, 单乐州, 邵鑫斌, 等. 盐度和pH值对 
YAN Maocang, SHAN Lezhou, SHAO Xinbin, et al. Influence of salinity and pH on the rates of oxygen consumption and ammonia excretion of juvenile Miichthy mijuy [J]. J Oceanogr Taiwan Strait, 2007, 26(1): 85-91. (in Chinese)
-
期刊类型引用(3)
1. 谭红林,谭均军,石小涛,李振,柯森繁,刘志雄. 鱼道进口诱鱼技术研究进展. 生态学杂志. 2021(04): 1198-1209 .  百度学术
百度学术
2. 张宁,林晨宇,许家炜,施家月,罗佳,白艳勤,尹入成,石小涛. 水流对草鱼幼鱼趋光行为的影响. 水生生物学报. 2019(06): 1253-1261 .  百度学术
百度学术
3. 王琼,林晨宇,罗佳,祝银,刘雁,刘国勇,刘德富,石小涛. 流水和静水条件下鲢幼鱼对不同强度光源的趋性研究. 水生态学杂志. 2018(05): 60-66 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
