Application of endogenous enzymes in astaxanthin extraction from shrimp shell
-
摘要:
文章探讨了内源酶对虾青素提取效果的影响,并以高效液相色谱法(HPLC)测定样品中虾青素的质量浓度,研究了pH、温度和酶解时间这3个因素对虾青素提取效果的影响,采用正交试验进行优化,以虾壳虾青素的萃取率作为评价提取效果的指标。结果表明,当酶解最佳工艺条件为pH 4.0,温度50 ℃,酶解时间1.5 h时,虾青素的萃取率最高,可达32.16 μg·g-1湿虾壳,比直接超声提取提高28%。通过空白试验可知,外加脂肪酶对虾青素提取无促进作用,仅利用内源酶即可达到较好的提取效果,且经济节约。
Abstract:The extraction of astaxanthin from shrimp shell with endogenous enzyme is studied, and astaxanthin content in the extract is determined by high performance liquid chromatography (HPLC).The pH, temperature and hydrolysis time are considered as the factors to study the extraction effect. Orthogonal test is adopted for optimization, taking the yield of astaxanthin from shrimp shell as the evaluation indicator. The results show that the optimum process conditions are 4.0 pH, 50 ℃ and 1.5 h hydrolysis time, with the astaxanthin extraction from wet shrimp shell of 32.16 μg·g-1, which is 28% more than the extraction by direct ultrasonic treatment. No significant effect on the yield of astaxanthin is observed by adding lipase. Extracting astaxanthin by endogenous enzymes achieves better extraction effect and is economical.
-
Keywords:
- shrimp shell /
- astaxanthin /
- endogenous enzyme /
- orthogonal test
-
弧菌病是常见的水产养殖病害[1]。近年来随着水产养殖品种的增加和养殖规模的扩大,尤其是高密度养殖使水体自身调节能力降低,弧菌病害和氨氮 (NH4 +-N) 过量对水产养殖的负面影响越来越严重,有关水产养殖过程中弧菌病防治和水体污染治理的研究备受关注[2]。目前主要采用化学、物理手段进行弧菌病的防治,但物理手段会造成水体二次污染,化学手段会导致病原菌的抗药性,打破水域生态平衡,而生物手段则弥补了化学手段的不足,这类生态友好型的治理手段已成研发热点[3],生产上亟需更多的微生物制剂用于水产病害和水污染治理[4]。
光合细菌 (Photosynthetic bacteria, PSB) 是在厌氧条件下以光为能源,以二氧化碳 (CO2) 或有机物为碳源,进行不生氧光合作用的原核生物[5]。目前所知的光合细菌可分为着色杆菌科、外硫红螺菌科、紫色非硫细菌、绿色硫细菌、多细胞丝状绿细菌、螺旋杆菌科、含细菌叶绿素的专性好氧菌7大类群,其中在水产养殖方面应用最多的为紫色非硫细菌[6-8]。光合细菌将水体中的有机物转化为自身生长所需的能量,与病原微生物形成竞争关系,从而成为优势菌群,抑制病原菌的生长繁殖[9],降低水产养殖病害的发生率,而且光合细菌所含的营养物质能够提高养殖鱼虾的免疫力,大幅提升其产量[10]。光合细菌作为生防菌株,已有研究主要针对其能够高效降解水体中的三态氮、硫化氢等有害物质[11],而对同时具有弧菌拮抗作用和降解NH4 +-N、亚硝态氮 (NO2 −-N) 复合功能的光合细菌的研究较少。本研究通过分离筛选对弧菌具有抑制作用并能降解NH4 +-N和NO2 −-N的优良光合细菌,以期为水产养殖病害的生物防治和养殖水污染治理提供优良菌株。
1. 材料与方法
1.1 试验材料
1.1.1 供试培养基
光合细菌富集培养基为氯化钠 (NaCl) 2 g,七水硫酸镁 (MgSO4·7H2O) 0.2 g,氯化铵 (NH4Cl) 1 g,磷酸二氢钾 (KH2PO4) 1.75 g,乙酸钠 (CH3COONa) 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g 碳酸氢钠 (NaHCO3)。光合细菌分离培养基为光合细菌富集培养基添加1.7%琼脂。光合细菌发酵培养基为LB培养基。弧菌的培养及抑菌作用测定培养基为2216E培养基 (蛋白胨5 g、酵母膏1 g、磷酸高铁0.01 g,琼脂20 g,陈海水1 000 mL,pH 8.0)。NH4 +-N降解培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,硫酸铵[(NH4)2SO4] 0.2358 g,KH2PO4 1.75 g,CH3COONa 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3 (NH4 +-N质量浓度为50 mg·L−1)。NO2 −-N降解培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,NaNO2 0.246 4 g,KH2PO4 1.75 g,CH3COONa 3 g,酵母粉1 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3 (NO2 −-N质量浓度为50 mg·L−1)。柠檬酸盐利用培养基为NaCl 2 g,MgSO4·7H2O 0.2 g,NH4Cl 1 g,KH2PO4 1.75 g,柠檬酸钠3 g,蒸馏水1 000 mL,pH 7.0,灭菌后加入2 g NaHCO3。
1.1.2 病原菌
副溶血弧菌 (Vibrio parahemolyticus)、鳗弧菌 (V. anguillarum)、创伤弧菌 (V. vulnificus) 由本实验室保藏提供。
1.2 样品的采集与富集
从连云港海域海州湾、车牛山岛、灌河入海口等区域采集海水样品20个,海泥样品4个,从南通市如东、启东地区海域采集海水样品4个,海泥样品2个。
取5 mL样品于25 mL富集培养基中,置于50 mL螺口离心管中,再加5 mL无菌液状石蜡,30 ℃,2 000 lx光照条件下富集培养,至培养物出现不同颜色。取1 mL培养物接种于新的富集培养基中继续培养,重复3~4次,得到深色培养液。
1.3 海洋光合细菌的分离纯化
采用双层平板涂布法和双层平板划线法。取不同的样品富集液,进行梯度稀释,分别取不同样品10−4、10−5、10−6稀释浓度的稀释液0.2 mL涂布于光合细菌分离培养基平板上,用一层融化后冷却至约45 ℃的分离培养基覆盖,静置凝固后,30 ℃光照条件下培养4 d。挑取红色、紫色、棕色和绿色等不同颜色菌落至新的分离培养基的平板上进行三区划线,进一步纯化,至在显微镜下观察菌体形态一致。
1.4 海洋光合细菌对弧菌的抑制作用测定
1.4.1 光合细菌菌悬液的制备
将分离得到的光合细菌菌株接种于装有25 mL LB液体培养基的50 mL离心管内,加入5 mL灭菌石蜡,在30 ℃、光照强度2 000 lx下培养4 d,菌液用无菌液体培养基调整光密度 (OD660 nm) 相等且OD660 nm≥1.5。
1.4.2 对弧菌的抑菌作用测定
采用牛津杯法。将在2216E培养基斜面上培养24 h的供试3种弧菌用无菌生理盐水洗下,制备成浓度为107个·mL−1的菌悬液,取0.1 mL菌悬液涂布在2216E培养基平板上。在距离培养皿边缘1.5 cm处的含菌平板四周均匀放置牛津杯,每个牛津杯中注入200 μL光合细菌不同菌株浓度为107个·mL−1的菌悬液,以等量的无菌培养基为对照,28 ℃恒温培养48 h,观察测定抑菌圈直径。每个菌株3个重复。
1.5 不同光合细菌菌株降解NH4 +-N和NO2 −-N作用测定
1.5.1 标准工作曲线制作
分别采用靛酚蓝分光光度法和盐酸萘乙二胺分光光度法 (GB/T 11889—1989) 测定溶液中NH4 +-N和NO2 −-N质量浓度。分别以NH4 +-N质量浓度和NO2 −-N质量浓度为横坐标,OD637 nm和OD538 nm为纵坐标,制作标准曲线,建立回归方程。
1.5.2 降解率测定
将光合细菌菌悬液 (OD660 nm≥1.5) 按10%的接种量接入装有25 mL液体降解培养基的50 mL离心管中,加入5 mL灭菌石蜡,每个菌株3个平行,在30 ℃、光照强度2 000 lx下静置培养4 d。发酵液于4 ℃、5 000 r·min−1条件下离心20 min,取上清液,测定不同菌株上清液的吸光值,根据标准曲线计算不同菌株发酵液中的氮质量浓度,以未接种的培养基作为对照,计算不同菌株的降解率。
$$ R=({{C}_{t}}-{{C}_{0}})/{{C}_{0}}\times 100{\text{%}} $$ (1) 式中:R为降解率;Ct为对照浓度;C0为处理浓度。
1.6 抑菌并高效降解NH4 +-N和NO2 −-N光合细菌菌株的初步鉴定
1.6.1 形态学观察
将筛选出的抑菌并高效降解NH4 +-N和NO2 −-N的光合细菌菌株接种于光合细菌分离培养基上,在30 ℃、光照强度2 000 lx下静置培养4 d,通过解剖镜观察培养基上菌落形态及颜色,挑取单菌落,进行革兰氏染色和鞭毛染色,显微镜观察菌体大小、形态和染色结果。
1.6.2 生理生化试验
挑取菌株3个单菌落至含2 mL无菌水的离心管中,振荡均匀并制成0.5麦氏浊度的均一菌悬液,吸取50~100 µL菌悬液接种至不同的生化管中,按照说明书于不同条件下培养,观察反应管的显色结果,将显色结果与《结果诠释表》比对,确定反应结果,以大肠杆菌为对照菌。
柠檬酸盐利用试验:将光合细菌菌悬液 (OD660 nm≥1.5) 按10%的接种量接入装有25 mL柠檬酸盐利用培养基的50 mL离心管中,加入5 mL灭菌石蜡,在30 ℃、2 000 lx下静置培养4 d,观察培养基颜色变化,确认菌株是否生长。
根据形态观察和生理生化反应结果,对照《伯杰细菌鉴定手册》 《常见细菌系统鉴定手册》对菌株进行初步鉴定。
1.6.3 16S rDNA序列分析
将P-3菌株样品送至上海生工生物工程有限公司,测定菌株的16S rDNA序列。所得的基因序列拼接完整后与NCBI数据库中的已知序列进行BLAST比对,选取近源序列,采用MEGA 7.0软件构建16S rDNA基因序列系统发育树。
2. 结果
2.1 海洋光合细菌的富集
在光照厌氧条件下30个不同样品多次富集培养,有6个样品出现了颜色变化,分离自灌河入海口海泥 (A) 为棕色,车牛山岛海水 (B) 和南通如东海泥 (C) 均为深红色,南通启东海水 (D) 和连云港高公岛表层海水 (E) 为红色,海州湾海水 (F) 为绿色 (图1),其他样品浑浊,未变色。
![]() 图 1 富集筛选培养后的培养液A. 灌河入海口海泥;B. 车牛山岛海水;C. 南通如东海泥;D. 南通启东海水;E. 连云港高公岛表层海水;F. 海州湾海水。Fig. 1 Culture medium after enrichment and screeningA. Sea mud of the river empties into the sea; B. Cheniushan Island sea water; C. Sea mud of Rudong, Nantong; D. Sea water of Qidong, Nantong; E. Surface water of Gaogong Island, Lianyungang; F. Sea water of Haizhou Bay.
图 1 富集筛选培养后的培养液A. 灌河入海口海泥;B. 车牛山岛海水;C. 南通如东海泥;D. 南通启东海水;E. 连云港高公岛表层海水;F. 海州湾海水。Fig. 1 Culture medium after enrichment and screeningA. Sea mud of the river empties into the sea; B. Cheniushan Island sea water; C. Sea mud of Rudong, Nantong; D. Sea water of Qidong, Nantong; E. Surface water of Gaogong Island, Lianyungang; F. Sea water of Haizhou Bay.2.2 海洋光合细菌的分离纯化
将富集的30个样品涂布于光合细菌平板上,从连云港高公岛海域海水分离纯化得到了橙红色的P-1菌株,从南通如东海泥中分离得到红色的P-2菌株,从连云港车牛山岛海域海水分离得到深红色P-3菌株。3个菌株的形态特征见表1、图2和图3,符合光合细菌的特征。
表 1 分离得到的3个光合细菌菌株的形态特征Table 1 Morphological characteristics of three isolates of photosynthetic bacteria菌株编号
Strain No.菌体形态
Mycelial morphology细胞大小
Cell size/μm革兰氏染色
Gram stain液体培养
Liquid culture菌落形态
Colony morphologyP-1 短杆状 1.47×0.83 G– 橙红色 橙色,边缘整齐,圆形,高突起 P-2 卵球状 1.02×0.23 G– 红色 深红色,边缘整齐,圆形,低突起,表面有光泽 P-3 细杆状 1.49×0.15 G– 深红色 红色,边缘整齐,圆形,表面低突 2.3 光合细菌菌株对3种弧菌的抑制作用
菌株P-3对3种弧菌均有抑制作用,对鳗弧菌的抑菌圈较明显,抑菌圈平均直径为 (5.26±0.03) mm。菌株P-1、P-2在平板对峙试验中,牛津杯周围基本上未现抑菌圈,说明这2株菌对副溶血弧菌、鳗弧菌和创伤弧菌没有拮抗作用 (表2、图4)。
表 2 不同光合细菌菌株对弧菌的抗菌效果Table 2 Antibacterial effect of strains against Vibrios指示菌
Indicator bacteria抑菌圈平均直径
Average diameter of inhibition zone/mmP-1 P-2 P-3 副溶血弧菌
V. Parahemolyticus— — 2.27±0.04 鳗弧菌 V. anguillarum — — 5.26±0.03 创伤弧菌 V. vulnificus 2.40±0.01 — 2.10±0.08 注:—. 无明显抑菌圈。 Note: —. No obvious bacteriostatic zone. 2.4 具有抑菌作用的光合细菌菌株降解NH4 +-N和NO2 −-N作用的测定
将光合细菌菌液加入含50 mg·L−1 NH4 +-N、NO2 −-N降解培养基中,光照厌氧条件30 ℃培养4 d,测定发酵液的吸光值,并通过回归方程计算氮浓度,结果见表3。3株菌株降解氮的能力较强,其中菌株P-2的NH4 +-N降解率最高 (93.39%),菌株P-3的NO2 −-N降解率最高 (94.98%)。
表 3 3株海洋光合细菌对氨氮和亚硝态氮的降解率Table 3 Ammonia nitrogen and nitrite nitrogen degradation rate of three marine photosynthetic bacteria菌株
编号
Strain No.氨氮 NH4 +-N 亚硝态氮 NO2 −-N 质量浓度
Concentration/
(mg·L−1)降解率
Degradation
rate/%质量浓度
Concentration/
(mg·L−1)降解率
Degradation
rate/%CK 48.78±0.00 — 48.91±0.35 — P-1 6.02±0.21 87.66±0.42 7.12±1.39 85.44±1.27 P-2 3.22±0.08 93.39±0.16 15.24±0.42 68.83±0.85 P-3 5.03±0.36 89.68±0.73 0.98±0.29 94.98±0.60 2.5 抑菌并高效降解NH4 +-N和NO2 −-N光合细菌菌株的鉴定
根据不同菌株抑菌作用、NH4 +-N和NO2 −-N降解作用结果,菌株P-3对3种弧菌的抑制作用以及对NO2 −-N的降解作用最强,同时对NH4 +-N的降解率较高,作为高效抑菌降解NH4 +-N和NO2 −-N的优良菌株进行初步鉴定。
2.5.1 形态学观察
菌落形态为红色圆球状,边缘整齐,表面低突 (图5);该菌为革兰氏阴性菌,细胞短杆状,大小为 (1.34~1.62) × (0.33~0.59) μm,单根极生鞭毛 (图6-a);菌株P-3在光照厌氧条件下,培养液呈深红色 (图6-b)。
2.5.2 生理生化特性
菌株P-3在麦芽糖、阿拉伯糖生化鉴定管颜色变为黄色、阳性,葡萄糖管颜色无变化,说明该菌具有分解阿拉伯糖和麦芽糖的能力,不能利用葡萄糖作为碳源;尿素酶、赖氨酸脱羧酶、精氨酸双水解酶实验呈阳性,表明菌株P-3能分解氨基酸使其脱羧生成胺;苯丙氨酸、肌醇试验为阴性;柠檬酸钠作为唯一碳源培养4 d,培养液颜色变为红色,为阳性,表明菌株P-3可以利用柠檬酸盐 (表4)。
表 4 菌株P-3生理生化试验结果Table 4 Physiological and biochemical characteristics of P-3 strain测定项目
Parameter反应结果 Reaction 菌株P-3
P-3 strain大肠杆菌 (对照)
Escherichia coli
(Control)肌醇 Inositol − − 明胶 Gelatin + − 尿素酶 Urease + − 赖氨酸脱羧酶 Lysine decarboxylase + − 精氨酸双水解酶 Arginine dihydrolase + + 苯丙氨酸 Phenylalanine − − 葡萄糖 Glucose − − 阿拉伯糖 Arabinose + + 麦芽糖 Malt dust + + 柠檬酸盐 Citrate + − 注:+. 阳性;−. 阴性;下同。 Note: +. Positive; −. Negative; the same below. 根据形态观察结果和生理生化试验,参照《伯杰细菌系统鉴定手册》和《常见细菌系统鉴定手册》对菌株P-3进行初步鉴定。
在厌氧光照条件下培养物为深红色的光合细菌有红假单胞菌属、红螺菌属和红微菌属,红螺菌属菌体为螺旋状,不具有脱氮能力,生境为淡水环境;红微菌属菌体为卵圆形至柠檬状,依靠周生鞭毛运动,且不能利用柠檬酸盐为碳源;红假单胞菌属的菌体为球形或杆状,单根极生鞭毛运动,不能利用葡萄糖,可以利用柠檬酸盐且具有脱氮作用,生境为海水环境,菌株P-3细胞形态、生理生化特性等与红螺菌属和红微菌属不同,而与红假单胞菌属的形态和生理生化特性一致,初步认为菌株P-3为红假单胞菌 (Rhodopseudomonas sp.,表5)。
表 5 红假单胞菌属菌株P-3鉴别特征Table 5 Identification characteristics of Rhodopseudomonas P-3性状
Characteristics菌株P-3
P-3 strain红假单胞菌属
Rhodopseudomonas sp.红螺菌属
Rhodospirillum sp.红微菌属
Rhodomicrobium sp.细胞大小 Cell size/μm (1.34~1.62) × (0.33~0.59) (0.6~5.0) × (0.4~0.5) 0.8~1.5 (2~2.8) × (1~1.2) 革兰氏染色 Gram stain G− G− G− G− 菌体形态 Strain morphology 杆状 球形或杆状 螺旋状 卵圆形至柠檬状 厌氧光照培养物颜色 Anaerobic lighting culture colour 深红色 深红色 红色至棕色 深红至红褐色 光照厌氧生长 Anaerobic growth under light + + + + 利用葡萄糖 Utilization of glucose − − − − 肌醇 Inositol − − 生境 Habitat 海水 淡水、海水和泥土 淡水 淡水和海水 明胶 Gelatin + ± 柠檬酸钠 Sodium citrate + + ± − 脱氮 Denitrifcation + + − ± 鞭毛 Flagella 极生 极生 极生 周生 注:G−. 革兰氏阴性;±. 部分菌株阳性,部分菌株阴性。 Note: G−. Gram-negative; ±. Some were positive and some were negative. 2.5.3 菌株P-3 16S rDNA序列分析
将菌株P-3的16S rDNA基因序列与NCBI中的序列进行比对,选取同属内同源相似性较高的不同菌株的16S rDNA序列,采用MEGA 7.0软件构建系统发育树,菌株P-3的16S rDNA与多株沼泽红假单胞菌 (R. palustris) 的相似性为99.31%,结果见图7。
3. 讨论
有学者认为光合细菌具有类胡萝卜素[12-13]、细菌叶绿素[14]等光合色素,在光照培养条件下,其培养液大多呈红色、紫色或者绿色等[5],如张小倩等[15]从辽河入海口筛选出1株产红色色素能力较强的红假单胞菌属菌株,王蕊等[16]从凡纳滨对虾 (Litopenaeus vannamei) 池塘水样、底泥中分离到1株类胡萝卜素含量较高的粪红假单胞菌 (R. faecalis)。本研究分离到的3株光合细菌厌氧培养液颜色均为红色,与已有的研究中菌液颜色相符,利用这一特性初步筛选菌株,有助于寻找到更多的光合菌株资源。
弧菌属是水产养殖中一种常见的细菌性病原[17-18],目前用于弧菌病的拮抗菌主要有乳酸菌[19]、芽孢杆菌[20]、光合细菌[21]等。张信娣等[22]研究发现球形红假单胞菌X3在平板扩散法中对水产致病菌有微弱的抑制作用。本研究中的沼泽红假单胞菌对副溶血弧菌、鳗弧菌和创伤弧菌均具有拮抗作用,与张信娣等[22]的研究结果相似。
光合细菌可以吸收水体中的NH4 +-N、硝态氮 (NO3 −-N) 和NO2 −-N,起到改善水质、修复水环境的作用[23-25]。目前对改善养殖环境的光合细菌种类研究颇多,如海洋着色菌 (Marichromatium gracile) [26]、红假单胞菌[27]、类球红细菌 (Rhodobacter sphaeroides) [28]、沙氏外硫红螺菌 (Ectothiorhodospira shaposhnikovii) [29]等,这些光合菌降解效率各不相同。本试验分离筛选得到的菌株P-3与金春英等[30]和刘珍珠等[31]研究的沼泽红假单胞菌降解效果相近。金春英等[30]分离出1株沼泽红假单胞菌CQV97,其对不同质量浓度的NH4 +-N和NO2 −-N最大去除率分别为35%~96%和46.850%~99.998%;刘珍珠等[31]从冰川前缘原生裸地土壤中分离出1株为沼泽红假单胞菌LG,菌株对NH4 +-N的转化率最高为65.71%,对NO3 −-N的转化率为95.58%,已有的研究表明光合细菌在养殖水体的NH4 +-N和亚硝酸盐降解中发挥了重要作用。
本试验分离筛选得到的菌株P-3在NH4 +-N和NO2 −-N质量浓度为50 mg·L−1时,对NH4 +-N和NO2 −-N的降解率分别达89.68%和94.98%,同时对副溶血弧菌、鳗弧菌和创伤弧菌均具有抑制作用,具有复合功能,表现出潜在的开发应用前景。
-
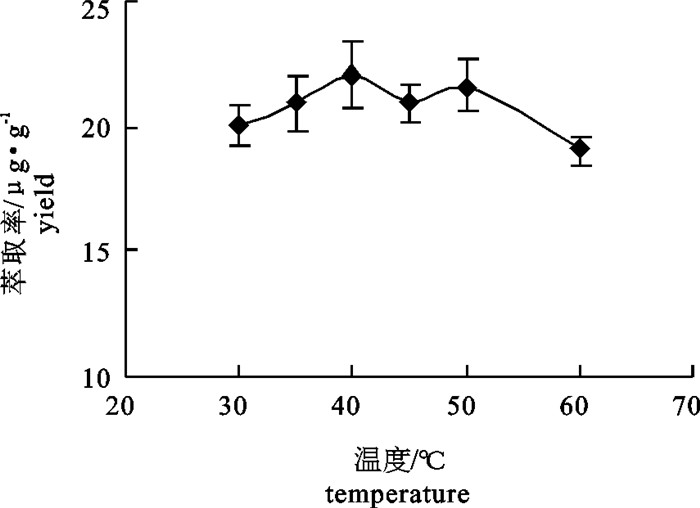
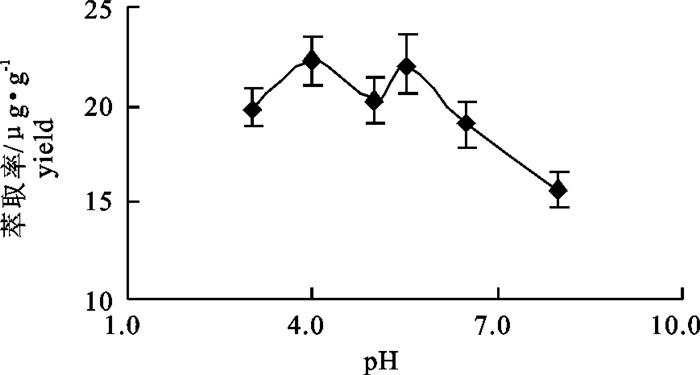
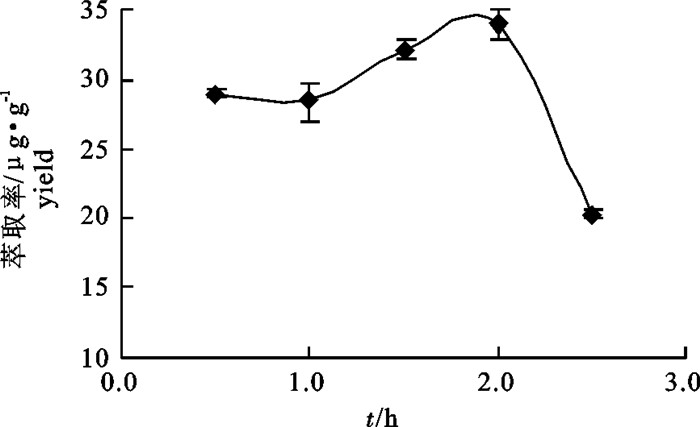
表 1 内源酶酶解因素水平表[L9(34)]
Table 1 Factors and levels of[L9(34)] orthogonal test of hydrolysis by endogenous enzymes
水平
level因素 factor A: pH B: 温度/℃ C: 时间/h 1 4.0 40 1.0 2 5.0 45 1.5 3 6.0 50 2.0 表 2 L9(34)内源酶酶解正交试验表
Table 2 L9(34) orthogonal test of hydrolysis by endogenous enzymes
试验号
trial No.因素 factor 萃取率/μg·g-1
yieldA: pH B: 温度/℃ C: 时间/h 1 1 1 1 26.68 2 2 2 2 32.06 3 3 3 3 28.29 4 1 2 3 28.43 5 2 3 1 28.28 6 3 1 2 31.24 7 1 3 2 32.16 8 2 1 3 26.90 9 3 2 1 27.61 k1 29.09 28.28 27.53 k2 29.08 29.37 31.82 k3 29.05 29.58 27.88 R 0.04 1.30 4.30 表 3 L9(34)内源酶解正交表方差分析
Table 3 L9(34) analysis of orthogonal test of hydrolysis by endogenous enzymes
因素
factor偏差平方和
sum of square of deviations自由度
degree of freedomF比
ratio of FF临界值
critical value of F显著性
significancepH 0 2 0 6.94 温度 temperature 2.93 2 2.00 6.94 时间 time 34.16 2 23.28 6.94 * 误差 error 2.94 4 注:*.水平显著(P < 0.05)
Note: *. significant difference(P < 0.05)表 4 脂肪酶对虾青素提取效果的影响
Table 4 Effect of lipase on astaxanthin extraction
脂肪酶量
addition of lipasepH 温度/℃
temperature时间/h
time萃取率/μg·g-1
yield平均萃取率/μg·g-1
average yield相对标准偏差/%
RSD0 4.0 50 1.5 32.85 0 4.0 50 1.5 33.23 32.98 0.22 0 4.0 50 1.5 32.86 2% 4.0 50 1.5 30.62 2% 4.0 50 1.5 34.36 32.63 1.89 2% 4.0 50 1.5 32.91 -
[1] GOTO S, KOGURE K, ABE K, et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochim Biophys Acta, 2001, 1512(2): 251-258. doi: 10.1016/S0005-2736(01)00326-1
[2] NAGUIB Y M A. Antioxidant activities of astaxanthin and related carotenoids[J]. J Agric Food Chem, 2000, 48(4): 1150-1154. doi: 10.1021/jf991106k
[3] SAVOUREN, BRIAND G, AMORYTMC, et al. Vitamin A status and metabolism of cutaneous polyamines in the hair-less mouse after UV irradiation: action of beta-carotene and astaxanthin[J]. Int J Vitam Nutr Res, 1995, 65(2): 79-86. https://pubmed.ncbi.nlm.nih.gov/7591536/
[4] 魏东, 严小君. 天然虾青素的超级抗氧化活性及其应用[J]. 中国海洋药物, 2001, 20(4): 45-50. doi: 10.3969/j.issn.1002-3461.2001.04.011 WEI Dong, YAN Xiaojun. Super-antioxidant activity of natural astaxanthin and its application[J]. China J Mar Med, 2001, 20(4): 45-50. (in Chinese) doi: 10.3969/j.issn.1002-3461.2001.04.011
[5] 李艳艳, 翟占军, 张银花, 等. 虾青素在水产养殖上的应用[J]. 北京农学院学报, 2009, 24(2): 78-80. doi: 10.3969/j.issn.1002-3186.2009.02.021 LI Yanyan, ZHAI Zhanjun, ZHANG Yinhua, et al. Application in aquatic animal of astaxanthin[J]. J Beijing Univ Agric, 2009, 24(2): 78-80. (in Chinese) doi: 10.3969/j.issn.1002-3186.2009.02.021
[6] 彭光华, 李忠, 张声华, 等. 6种类胡萝卜素对人乳腺癌细胞株细胞间隙连接通讯功能影响的比较[J]. 食品科学, 2008, 29(6): 45-48. doi: 10.3321/j.issn:1002-6630.2008.06.003 PENG Guanghua, LI Zhong, ZHANG Shenghua, et al. Comparison of effect of six kinds of carotenoids on gap junctional intercellular communication of human breast cancer cell[J]. Food Sci, 2008, 29(6): 45-48. (in Chinese) doi: 10.3321/j.issn:1002-6630.2008.06.003
[7] 刘宏超, 杨丹. 从虾壳中提取虾青素工艺及其生物活性应用研究进展[J]. 化学试剂, 2009, 31(2), 105-108. doi: 10.3969/j.issn.0258-3283.2009.02.007 LIU Hongchao, YANG Dan. Progress in research on extracting astaxanthin from shrimp shell and application of its biological activity[J]. Chem Reagent, 2009, 31(2), 105-108. (in Chinese) doi: 10.3969/j.issn.0258-3283.2009.02.007
[8] 焦雪峰. 虾青素在化妆品中的应用[J]. 广东化工, 2006, 33(1): 13-15. doi: 10.3969/j.issn.1007-1865.2006.01.007 JIAO Xuefeng. Application of astaxanthin on cosmetics[J]. Guangdong Chem Ind, 2006, 33(1): 13-15. (in Chinese) doi: 10.3969/j.issn.1007-1865.2006.01.007
[9] 陆开形, 蒋霞敏, 翟兴文. 虾青素的生物学功能及应用[J]. 宁波大学学报, 2006, 16 (1): 95-98. doi: 10.3969/j.issn.1001-5132.2003.01.021 LU Kaixing, JIANG Xiamin, ZHAI Xingwen. Biological function and application of astaxanthin[J]. J Ningbo Univ, 2006, 16(1): 95-98. (in Chinese) doi: 10.3969/j.issn.1001-5132.2003.01.021
[10] 胡雅馨, 惠伯棣, 李阳. 食用虾中虾青素类化合物的含量和组成[J]. 食品科学, 2007, 28, (8): 389-392. doi: 10.3321/j.issn:1002-6630.2007.08.094 HU Yaxin, HUI Bodi, LI Yang. Content and composition of astaxanthin related compounds in shrimp[J]. Food Sci, 2007, 28(8): 389-392. (in Chinese) doi: 10.3321/j.issn:1002-6630.2007.08.094
[11] 何秋生, 李向阳, 方振华, 等. 淡水鱼的加工及综合利用初探[J]. 中国水产, 1999(7): 44-46. HE Qiusheng, LI Xiangyang, FANG Zhenhua, et al. The first exploration on processing and comprehensive unilization of freshwater fish[J]. China Fish, 1999(7): 44-46. (in Chinese)
[12] 顾晨光, 王建军. 虾脑酱的制作[J]. 食品科学, 1991(7): 23-24. GU Chenguang, WANG Jianjun. Process of shrimp brain sauce[J]. Food Sci, 1991(7): 23-24. (in Chinese)
[13] 徐竞. 正交试验优化天然虾青素的提取工艺研究[J]. 南方水产, 2008, 4(2): 69-74. doi: 10.3969/j.issn.2095-0780.2008.02.011 XU Jing. Study on the extraction of natural astaxanthin by orthogonal test[J]. South China Fish Sci. 2008, 4(2): 69-74. (in Chinese) doi: 10.3969/j.issn.2095-0780.2008.02.011
[14] 张华, 杨鑫, 马莺, 等. 固相萃取-反相高效液相色谱法同时测定饲料中的角黄素和虾青素[J]. 色谱, 2008, 26(3): 392-394. doi: 10.3321/j.issn:1000-8713.2008.03.027 ZHANG Hua, YANG Xin, MA Ying, et al. Simultaneous determination of canthaxanthin and astaxanthin in feed stuffs using solid phase extraction-reversed-phase high performance liquid chromatography[J]. Chinese J Chromatogr, 2008, 26(3): 392-394. (in Chinese) doi: 10.3321/j.issn:1000-8713.2008.03.027
[15] 李福生, 徐宁, 李爱芬, 等. 一种稳定的雨生红球藻色素分析方法[J]. 食品科技, 2009, 34(7): 274-277. LI Fusheng, XU Ning, LI Aifen, et al. A stable method used for characterization of pigments in Haematococcus pluvialis[J]. Food Sci Technol, 2009, 34(7): 274-277. (in Chinese)
[16] 章超桦, 邓尚贵, 杨丽明, 等. 紫外线和温度对虾快速自溶的影响[J]. 湛江水产学院学报, 1994, 14(2): 51-56. https://xueshu.baidu.com/usercenter/paper/show?paperid=e43bc5e9e885b3563a36614ee8c10cb9&site=xueshu_se ZHANG Chaohua, DENG Shanggui, YANG Liming, et al. Effects of ultraviolet ray and temperature on quick autolysis of shrimp[J]. J Zhanjiang Fish College, 1994, 14(2): 51-56. (in Chinese) https://xueshu.baidu.com/usercenter/paper/show?paperid=e43bc5e9e885b3563a36614ee8c10cb9&site=xueshu_se
[17] O'CONNOR I, O'BRIEN N. Modulation of UVA light-induced oxidative stress by beta-carotene, lutein and astaxanthin in culture fibroblasts[J]. Dermatol Sci, 1998, 16(3): 226-230. doi: 10.1016/s0923-1811(97)00058-3
[18] 李香春. 脂肪酶的研究进展[J]. 肉类工业, 2003(4): 45-48. LI Xiangchun. Progress in research on lipase[J]. Meat Ind, 2003(4): 45-48. (in Chinese)
[19] 赵仪, 陈兴才. 木瓜蛋白酶在虾仁加工废弃物中提取虾青素的应用[J]. 福州大学学报: 自然科学版, 2006, 34(3): 453-457. doi: 10.3969/j.issn.1000-2243.2006.03.031 ZHAO Yi, CHEN Xingcai. The application of papain in astaxanthin extraction from prawn waste[J]. J Fuzhou Univ: Natural Science, 2006, 34(3): 453-457. (in Chinese) doi: 10.3969/j.issn.1000-2243.2006.03.031
[20] 钱飞, 刘海英, 过世东. 木瓜蛋白酶水解克氏原螯虾虾壳提取虾青素的研究[J]. 食品与生物技术学报, 2010, 29(2): 237-242. QIAN Fei, LIU Haiying, GUO Shidong. The application of papain in astaxanthin extraction from crayfish shell[J]. J Food Sci Biotechnol, 2010, 29(2): 237-242. (in Chinese)
[21] 张影霞, 武利刚, 罗志辉, 等. 虾青素的提取及其稳定性的研究[J]. 现代食品科技, 2008, 24(12): 1288-1291. doi: 10.3969/j.issn.1673-9078.2008.12.027 ZHANG Yingxia, WU Ligang, LUO Zhihui, et al. Extraction of astaxanthin from shrimp and its stability[J]. Modern Food Sci Technol, 2008, 24(12): 1288-1291. (in Chinese) doi: 10.3969/j.issn.1673-9078.2008.12.027
-
期刊类型引用(6)
1. 郑杰秋,邢东旭,李庆荣,黎尔纳,符兵,廖森泰,邹宇晓,周东来. 沼泽红假单胞菌的生物学功能及其在水产养殖中的研究进展. 中国畜牧兽医. 2025(02): 707-717 .  百度学术
百度学术
2. 冯元泰,史荣君,李俊伟,区又君,齐占会,黄洪辉,贾旭颖. 不同日龄四指马鲅幼鱼肠道结构和菌群组成变化分析. 南方水产科学. 2025(01): 153-163 .  本站查看
本站查看
3. 梁帅,黄哲,丛玉婷,卢亚楠,王媛,王丽,王连顺,杨国军. 光合细菌在水产养殖中的应用研究进展. 饲料研究. 2024(24): 142-146 .  百度学术
百度学术
4. 靳鹏,和子涵,武婧玉,贾一然,张晓彤,张建新. 1株光合细菌的分离鉴定、培养基优化及脱氮特性研究. 河南农业科学. 2023(07): 136-143 .  百度学术
百度学术
5. 鲁晏宏,王蕊,王珺,胡婷,付维来,朱传忠,汪攀. 1株耐盐耐低温沼泽红假单胞菌的分离筛选及培养基优化. 饲料研究. 2023(20): 103-108 .  百度学术
百度学术
6. 谷雪勤,王庆奎,王洋. 海水鱼循环水养殖系统中细菌群落结构研究进展. 天津农学院学报. 2022(02): 76-84 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
