Effects of salinities on growth, survival and digestive enzymes activity of larval hybrid tilapia (Oreochromis niloticus×O.aureus)
-
摘要:
研究了不同盐度对奥尼罗非鱼仔、稚鱼生长、存活和消化酶活力的影响。试验设计2、4、6、8、10和纯净淡水0(对照组)共6个盐度梯度组,仔鱼的初始体重0.008±0.001 g。结果表明,不同盐度对奥尼罗非鱼仔、稚鱼生长有显著差异(P < 0.05),盐度4和6时,仔、稚鱼的生长速度和绝对增重率最高,分别为0.08 cm·d-1和0.033 g·d-1;盐度10时较低,只有0.06 cm·d-1和0.023 g·d-1;仔、稚鱼的肥满度介于3.43~3.81,各组之间差异不显著(P>0.05);盐度0~10时,各组存活率介于92.3%~94.7%,幼鱼所占比例介于66.0%~67.3%,各组之间差异不显著(P>0.05);胃蛋白酶和胰蛋白酶活力随盐度升高而降低,均在盐度0时活力最高,10时最低;脂肪酶和淀粉酶活力在盐度4时达到最高,10时最低。根据试验结果,奥尼罗非鱼仔、稚鱼培育的盐度最好控制在4.6左右。
Abstract:Influences of salinity on growth, survival and digestive enzymes of larval hybrid tilapia were investigated in the present study. Tilapia at an initial average weight of 0.008±0.001 g were divided into triplicate groups and were observed at salinities of 2, 4, 6, 8, 10 and freshwater 0. The results showed that the effects of different salinities on tilapia growth were significant (P < 0.05), and larval growth was faster when salinities were 4 and 6 with a growth rate of 0.08 cm·d-1 and an absolute growth rate of 0.033 g·d-1.When the salinity was 10, the growth of larval tilapia was slower; the growth rate was 0.06 cm·d-1 and the absolute growth rate was 0.023 g·d-1. Since the condition factors of six groups were 3.43~3.81, each group was not significantly different (P>0.05).Within the salinities of 0~10, the ratio of hybrid tilapia juvenile was 66.0%~67.3% and the survival rate was 92.3%~94.7%; each group did not differ significantly (P>0.05).Moreover, the activities of pepsin and trypsin were weakening with increasing salinity, being the highest at salinity of 0, while the activities of lipase and amylase were the highest at salinity of 4 and the lowest at 10. The results suggested that the suitable salinity for larval tilapia was about 4.6.
-
Keywords:
- Oreochromis niloticus×O.aureus /
- larvae /
- salinity /
- growth /
- survival /
- digestive enzyme
-
盐度是与鱼类生活密切相关的环境因子之一,其变化不仅影响鱼类的食物摄食水平[1]、饲料利用率[2]和饲料中营养物质的比例[3-4],还影响其消化酶活力[5]、耗氧率、临界溶氧和窒息点[6-7],进而影响鱼类的活动与生长[8-10]。罗非鱼是中国目前主要养殖的淡水鱼类之一。大多数罗非鱼品种属于广盐性种类[11],可适应咸、淡水养殖,海水罗非鱼比淡水罗非鱼具有更高的经济价值。因此,了解罗非鱼在不同盐度条件下的消化生理是实现其人工培育、饲料科学配制与合理投喂的理论基础。关于罗非鱼消化酶的特点以及环境温度对其消化酶活力的影响,在国内外已见一些报道[12-13],但有关盐度对罗非鱼消化酶活力影响的研究目前还不多见,仅有FANG和CHIOU[14]研究了不同盐度对尼罗罗非鱼成鱼的蛋白酶活力影响,然而盐度对奥尼罗非鱼仔、稚鱼生长、存活和消化酶活力的影响则尚未见相关报道。该研究旨在通过生长试验确定罗非鱼仔、稚鱼生长的最适盐度,及盐度对其存活和消化酶活力的影响,为罗非鱼的人工养殖提供理论依据。
1. 材料与方法
1.1 材料
试验所用仔、稚鱼由广东省茂名市“三高”国家级罗非鱼良种繁殖基地提供。选取同一批人工孵化的仔鱼2 000尾,暂养7 d后开始试验。奥尼罗非鱼仔鱼初始体长0.74±0.028 cm,体重0.008±0.001 g。
1.2 试验方法
选取其中1 800尾随机放入18个50 L的塑料桶中开始试验,每桶放置100尾,采用静水连续充气,溶氧保持在5.5 mg·L-1以上,日换水量1/2。采用虹吸法将桶底废物吸出。试验设计6个盐度组,每组3个平行,用海水晶分别配制盐度为2、4、6、8和10的试验用水以及纯净淡水0(对照组),各桶内水温由控温仪控制,温度28±0.5℃,pH 7.3左右。每天投喂人工配合饲料4次,投喂量为仔、稚鱼体重的12%。
在第0、7、14、21和28天分别测量奥尼罗非鱼的体长和体重,用吸水纸轻轻擦净鱼体上的水,测量体长(精确到0.01 cm);体重(精确到0.001 g)。并在试验结束时统计每桶鱼的数量和发育情况(注:幼鱼期的特征为全身被鳞、侧线明显、胸鳍鳍条末端分枝,体色和斑纹与成鱼相似)。
绝对增重率(AGR)(g·d-1)=(Wt-W0)/(t2-t1)
生长速度(GR)(cm·d-1)=(Lt-L0)/(t2-t1)
存活率(S)(%)=(Nt/N0)×100
式中W0为初始体重(g),Wt为终末体重(g),L0为初始体长(cm),Lt为终末体长(cm),t2为试验结束时间(d),t1为试验开始时间(d),Nt为终末存活数,N0为起始尾数。
1.3 酶液的制备
试验结束后,将奥尼罗非鱼活鱼运回生化室,进行生物学测定后,将所取仔、稚鱼置于冰盘上致死,取其内脏,然后在样品中加入4倍体积(W/V)预冷生理盐水,匀浆后用0~1℃冷冻离心机(8 000 r·min-1)离心10 min,取上清液分别作胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶活力的测定。置于4℃保存,在24 h内测定完毕。
1.4 酶活性的测定
整个试验中胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶活性的测定使用南京建成生物工程研究所生产的试剂盒,蛋白浓度用考马斯亮蓝染色法测定。
酶的活力以比活力表示,单位为酶活力单位·mg蛋白-1(U·mgprot-1)。
1.5 统计分析
数据结果用平均值±标准差(Mean±SD),试验数据用SPSS 15.0统计软件进行方差分析及Duncan氏多重比较(显著水平P=0.05)[17]。
2. 结果
2.1 不同盐度下仔、稚鱼生长性能
不同盐度对奥尼罗非鱼仔、稚鱼生长性能有显著影响(P < 0.05)(表 1、表 2和图 1)。
表 1 盐度对奥尼罗非鱼仔、稚鱼生长的影响Table 1 Effects of different salinities on the growth of hybrid tilapia larvae(Mean±SD)测定项目
item时间/d
time盐度 salinity 0 2 4 6 8 10 初始体长/cm
initial body length0 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 终末体长/cm
final body length28 2.82a±0.459 2.84a±0.558 2.96a±0.528 2.99a±0.382 2.82a±0.391 2.53b±0.405 生长率/cm·d-1
growth rate28 0.07ab±0.016 0.07ab±0.020 0.08a±0.019 0.08a±0.013 0.07a±0.014 0.06b±0.014 初始体重/g
initial body weight0 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 终末体重/g
final body weight28 0.904a±0.452 0.914a±0.506 0.927a±0.406 0.936a±0.346 0.891a±0.370 0.645b±0.403 绝对增重率/g·d-1
absolute growth rate
of weight28 0.032a±0.016 0.032a±0.018 0.033a±0.014 0.033a±0.012 0.032a±0.013 0.023b±0.014 肥满度/K
condition factor28 3.81a±0.596 3.63a±0.297 3.43a±0.556 3.45a±0.976 3.80a±0.341 3.62a±1.178 注:同一栏平均值右上角标有不同字母者表示有显著差异(P < 0.05)。下同。
Note:Means in the same column which have different letters on the top right have significant difference(P < 0.05).The same as below.表 2 不同盐度下奥尼罗非鱼仔、稚鱼发育阶段和存活率Table 2 Developmental stage and survival of hybrid tilapia larvae by different salinities(Mean±SD)测定项目
item时间/d
time盐度 salinity 0 2 4 6 8 10 发育阶段
developmental stage28 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 幼鱼所占比例/%
proportion of juvenile28 66.7a±2.516 67.0a±2.646 66.7a±3.055 67.3a±4.163 66.0a±1.732 66.3a±2.081 存活率/%
survival28 94.7a±1.155 93.3a±1.155 94.3a±2.081 94.7a±1.528 92.3a±0.577 94.0a±1.732 盐度0~10时,生长速度介于0.06~0.08 cm·d-1,盐度4和6时,仔、稚鱼生长速度最快(0.08 cm·d-1);盐度10时生长速度较慢(0.06 cm·d-1),各组之间差异显著(P < 0.05)。
盐度4和6时,仔、稚鱼的绝对增重率较高(0.033 g·d-1);盐度10时较低(0.023 g·d-1),各组之间差异显著(P < 0.05)。
仔、稚鱼的肥满度介于3.43~3.81,各试验组无显著差异(P>0.05)。
盐度0~10时,与终末体重之间的关系见图 2,y=-0.0102x2+0.0938x+0.7484,R2=0.9328(其中y代表终末体重,x代表盐度),当x=4.6时,y值最大(0.964)。
2.2 不同盐度下仔、稚鱼发育阶段和存活率
饲喂28 d后,各试验组罗非鱼处于稚、幼鱼阶段,幼鱼所占比例介于66.0%~67.3%,各组之间差异不显著(P>0.05)。
不同盐度对各试验组仔、稚鱼的成活率无显著影响(P>0.05),存活率介于92.3%~94.7%。
2.3 不同盐度下仔、稚鱼胃蛋白酶活力
盐度0~10时,奥尼罗非鱼仔、稚鱼的胃蛋白酶活力随着盐度增加而显著降低(P < 0.05)(图 3)。盐度0时,活力最高(12.607 U·mgprot-1);盐度10时活力最低(2.108 U·mgprot-1)。
![]() 图 3 不同盐度下奥尼罗非鱼仔、稚鱼胃蛋白酶活力注:图标上方不同小写字母,表示不同盐度下仔、稚鱼消化酶活力差异显著(P < 0.05)。后图同此。Fig. 3 Pepsin activity of hybrid tilapia larvae by different salinitiesNote: Different lowercases in the above figure mean different salinities that significantly affect the digestive enzyme′s activity (P < 0.05). The same in the following figures.
图 3 不同盐度下奥尼罗非鱼仔、稚鱼胃蛋白酶活力注:图标上方不同小写字母,表示不同盐度下仔、稚鱼消化酶活力差异显著(P < 0.05)。后图同此。Fig. 3 Pepsin activity of hybrid tilapia larvae by different salinitiesNote: Different lowercases in the above figure mean different salinities that significantly affect the digestive enzyme′s activity (P < 0.05). The same in the following figures.2.4 不同盐度下仔、稚鱼胰蛋白酶活力
胰蛋白酶活力的变化趋势与胃蛋白酶相似(图 4)。盐度0时活力最高(2 581.835 U·mgprot-1);盐度10时活力最低(658.628 U·mgprot-1),各组之间差异显著(P < 0.05)。
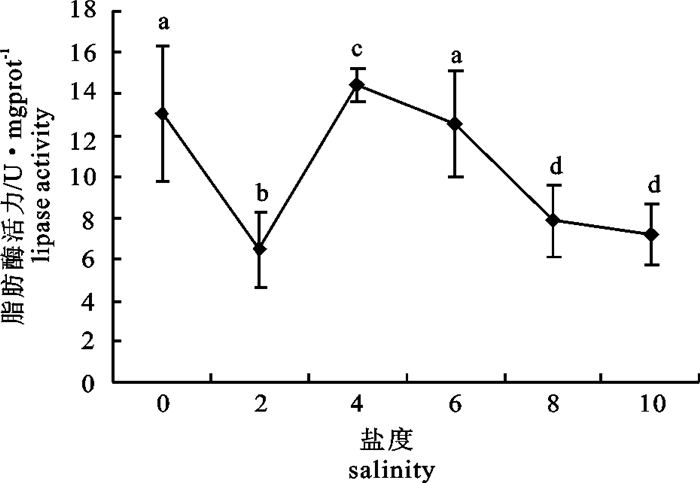
2.5 不同盐度下仔、稚鱼脂肪酶活力
盐度2时,仔、稚鱼的脂肪酶活力最低(6.490 U·mgprot-1);盐度0和4时活力较高,分别为13.065和14.465 U·mgprot-1,各组之间差异显著(P < 0.05)(图 5)。
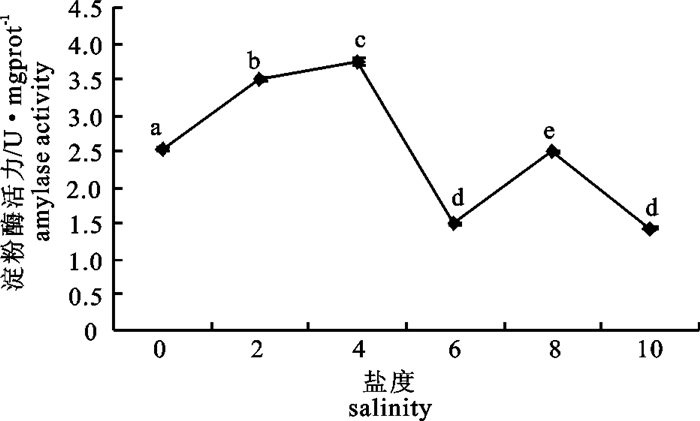
2.6 不同盐度下仔、稚鱼淀粉酶活力
当盐度0~10时,仔、稚鱼的淀粉酶活力呈先上升后下降的变化趋势(图 6)。盐度4时活力最高(3.754 U·mgprot-1);盐度6和10时活力较低,分别为1.500和1.440 U·mgprot-1,各组之间差异显著(P < 0.05)。
3. 讨论
3.1 不同盐度对仔、稚鱼生长性能的影响
奥尼罗非鱼在不同盐度下的适应性生长能力介于父本奥利亚罗非鱼和母本尼罗罗非鱼之间[18]。该试验发现,奥尼罗非鱼的生长与盐度密切相关,当盐度在0~6时,仔、稚鱼经过28 d的培育,终末体重介于0.904~0.936,盐度提升可以促进奥尼罗非鱼的生长,但各组之间差异不显著(P>0.05);盐度10时,终末体重显著下降(P < 0.05)。这与刘贤敏等[19]的研究结果相似。作为长期进化的结果,不同品种的鱼对其适应的盐度有很大差异。草鱼(Ctenopharyngodon idella)仔、稚鱼在盐度0的养殖水体中生长速度最快,随着盐度增加而逐渐下降[20];鲤鱼(Cyprinus carpio)幼鱼在0~14.5的半咸水中养殖96 h,生长速度在淡水中最高,并且随着盐度升高而显著降低[21]。按照等渗调节原理[22-24],鱼类在等渗点时渗透压力最小,用于调节机体适应环境和维持生命活动的能量较少,而用于生长的能量较多,因此,鱼类的代谢率最低,生长率最高,许多广盐性鱼类具有这种特性。FEBRY和LUTZ[25]研究发现,罗非鱼在淡水、等渗海水和海水3种养殖水体中生长时,在等渗海水中用于调节渗透压所消耗的能量低于其他2种养殖水体。在盐度0~10时,奥尼罗非鱼仔、稚鱼的终末体重(y)与盐度(x)之间关系为y=-0.0102x2+0.0938x+0.7484,R2=0.9328,当x=4.6时,y值最大(0.964)。因此,当盐度4.6左右时,可能更接近奥尼罗非鱼仔、稚鱼的等渗点,用于调节渗透压所消耗的能量较少,奥尼罗非鱼表现出良好的生长情况;但盐度达到10时,可能已经超过其渗透压的调节能力,该盐度条件成为仔、稚鱼生长的胁迫因子,造成机体代谢混乱,摄食量减少,从而导致生长性能下降。而奥尼罗非鱼仔、稚鱼的肥满度在不同盐度条件下无显著差异(P>0.05),这与李学军等[8]的研究结果一致。
在该试验中,奥尼罗非鱼仔、稚鱼在盐度0~10时,存活率和发育速度没有显著差别(P>0.05)。
3.2 不同盐度对仔、稚鱼消化酶活力的影响
消化酶的活力可以反映鱼类基本的消化生理特征。环境盐度的改变会导致鱼体消化道内消化酶活力的变化,具体可归结为3种情况:1)激活作用[26];2)没有影响[14];3)抑制作用[27]。黄鳍鲷(Sparus latus)[28]幼鱼在盐度10时,蛋白酶活力最高,盐度高于25对其活力有抑制作用;真鲷(Pagrosomus major)[29]幼鱼在盐度25时,蛋白酶活力最高,升高或降低盐度对其活力都有抑制作用。该试验结果表明,当盐度0~10时,随着盐度增加奥尼罗非鱼仔、稚鱼的胃蛋白酶和胰蛋白酶活力均呈下降趋势,表明盐度对其胃蛋白酶和胰蛋白酶活力具有抑制作用,这与FANG和CHIOU[14]对不同盐度下尼罗罗非鱼成鱼的蛋白酶变化的研究有所不同,这可能与养殖时间的长短和研究的阶段不同有关。对于消化器官中的蛋白酶来说,盐度较低时,罗非鱼生长比较适宜,代谢水平较高,蛋白酶储存作用相对较低,消化器官的蛋白酶活力较高。随着盐度的上升,代谢作用明显减低,蛋白酶活力也会随之下降。VONCK等[30]研究表明,在低盐度条件下,罗非鱼调节其血浆中矿物质各成分相当有效,随着盐度升高,这种能力随之降低,导致血浆中钠离子、钙离子和氯化物增加,形成血浆渗透压,进而导致鳃Na+-K+ ATPase酶活力的下降和鳃上皮氯细胞密度的减少,从而影响奥尼罗非鱼的各种生理活动和其消化酶活力。
同时,奥尼罗非鱼仔、稚鱼在半咸水中生长时,许多无机离子是消化酶的激活剂,可以直接对酶活力产生影响[31]。大菱鲆(Scophthalmus maximus)消化道中的淀粉酶活力在0.05~0.1 mol·L-1浓度的氯离子条件下可以被激活[32];黄鳍鲷幼鱼的脂肪酶活力在氯离子浓度为2%时有明显的激活作用[28]。试验中发现,在等渗点4.6附近,奥尼罗非鱼仔、稚鱼的淀粉酶和脂肪酶活力均达到最高。鱼类在等渗点时一般生长速度最快,对食物的吸收利用效率也是最高[5],消化酶的分泌活性与其饱食程度有关[33-34],盐度4.6时,奥尼罗非鱼仔、稚鱼的生长速度最快,但是随着盐度的升高,当超过仔、稚鱼生活的适宜无机离子浓度时,其消化酶活力便会受到抑制。
-
图 3 不同盐度下奥尼罗非鱼仔、稚鱼胃蛋白酶活力
注:图标上方不同小写字母,表示不同盐度下仔、稚鱼消化酶活力差异显著(P < 0.05)。后图同此。
Figure 3. Pepsin activity of hybrid tilapia larvae by different salinities
Note: Different lowercases in the above figure mean different salinities that significantly affect the digestive enzyme′s activity (P < 0.05). The same in the following figures.
表 1 盐度对奥尼罗非鱼仔、稚鱼生长的影响
Table 1 Effects of different salinities on the growth of hybrid tilapia larvae(Mean±SD)
测定项目
item时间/d
time盐度 salinity 0 2 4 6 8 10 初始体长/cm
initial body length0 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 0.74±0.028 终末体长/cm
final body length28 2.82a±0.459 2.84a±0.558 2.96a±0.528 2.99a±0.382 2.82a±0.391 2.53b±0.405 生长率/cm·d-1
growth rate28 0.07ab±0.016 0.07ab±0.020 0.08a±0.019 0.08a±0.013 0.07a±0.014 0.06b±0.014 初始体重/g
initial body weight0 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 0.008±0.001 终末体重/g
final body weight28 0.904a±0.452 0.914a±0.506 0.927a±0.406 0.936a±0.346 0.891a±0.370 0.645b±0.403 绝对增重率/g·d-1
absolute growth rate
of weight28 0.032a±0.016 0.032a±0.018 0.033a±0.014 0.033a±0.012 0.032a±0.013 0.023b±0.014 肥满度/K
condition factor28 3.81a±0.596 3.63a±0.297 3.43a±0.556 3.45a±0.976 3.80a±0.341 3.62a±1.178 注:同一栏平均值右上角标有不同字母者表示有显著差异(P < 0.05)。下同。
Note:Means in the same column which have different letters on the top right have significant difference(P < 0.05).The same as below.表 2 不同盐度下奥尼罗非鱼仔、稚鱼发育阶段和存活率
Table 2 Developmental stage and survival of hybrid tilapia larvae by different salinities(Mean±SD)
测定项目
item时间/d
time盐度 salinity 0 2 4 6 8 10 发育阶段
developmental stage28 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 稚、幼鱼 幼鱼所占比例/%
proportion of juvenile28 66.7a±2.516 67.0a±2.646 66.7a±3.055 67.3a±4.163 66.0a±1.732 66.3a±2.081 存活率/%
survival28 94.7a±1.155 93.3a±1.155 94.3a±2.081 94.7a±1.528 92.3a±0.577 94.0a±1.732 -
[1] LUZ R K, MARTINEZ-ÁLVAREZ R M, PEDRO N D, et al. Growth, food intake regulation and metabolic adaptations in goldfish (Carassius auratus) exposed to different salinities[J]. Aquac, 2008, 276(1/4): 171-178. doi: 10.1016/j.aquaculture.2008.01.042
[2] LIKONGWE J S, STECKO T D, STAUFFER J R, et al. Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia Oreochromis niloticus (Linneaus)[J]. Aquac, 1996, 146(1/2): 37-46. doi: 10.1016/S0044-8486(96)01360-9
[3] EL-SAYED A M, MANSOUR C R, EZZAT A A. Effects of dietary protein level on spawning performance of Nile tilapia (Oreochromis niloticus) brood stock reared at different water salinities[J]. Aquac, 2003, 220(1/4): 619-632. doi: 10.1016/S0044-8486(02)00221-1
[4] EL-SAYED A M, MANSOUR C R, EZZAT A A. Effects of dietary lipid source on spawning performance of Nile tilapia (Oreochromis niloticus) brood stock reared at different water salinities[J]. Aquac, 2005, 248(1/4): 187-196. doi: 10.1016/j.aquaculture.2005.04.024
[5] 庄平, 章龙珍, 田宏杰, 等. 盐度对施氏鲟幼鱼消化酶活力的影响[J]. 中国水产科学, 2008, 15(2): 189-203. doi: 10.3321/j.issn:1005-8737.2008.02.001 [6] 李学军, 李爱景, 彭新亮, 等. 不同盐度下萨罗罗非鱼、尼罗罗非鱼和以色列红罗非鱼耗氧率、临界溶氧和窒息点的比较分析[J]. 河南师范大学学报, 2007, 35(2): 137-141. doi: 10.3969/j.issn.1000-2367.2007.02.040 [7] 雷思佳. 盐度与体重对台湾红罗非鱼耗氧率的影响[J]. 应用生态学报, 2002, 13(6): 739-742. doi: 10.3321/j.issn:1001-9332.2002.06.023 [8] 李学军, 李思发, 么宗利, 等. 不同盐度下尼罗罗非鱼、萨罗罗非鱼和以色列红罗非鱼幼鱼生长、成活率及肥满系数的差异[J]. 中国水产科学, 2005, 12(3): 245-251. doi: 10.3321/j.issn:1005-8737.2005.03.003 [9] DOROSHEV S I, ARONOVICH T M. The effects of salinity on embryonic and larval development of Eleginus nauaga (Pallas), Boreogadus saida (Lepechin) and Liopsetta glacIalis (Pallas)[J]. Aquac, 1974, 4(1): 353-362. doi: 10.1016/0044-8486(74)90064-7
[10] TANDLER A, ANAV F A, CHOSHNIAK I. The effect of salinity on growth rate, survival and swim bladder inflation in gilthead seabream, Sparus aurata, larvae and juvenile[J]. Aquac, 1995, 135(4): 343-353. doi: 10.1016/0044-8486(95)01029-7
[11] SURESH A V, KWEI L C. Tilapia culture in saline waters: a review[J]. Aquac, 1992, 106(3/4): 201-226. doi: 10.1016/0044-8486(92)90253-H
[12] MORRISON C M, WRIGHT J R. A study of the histology of the digestive tract of the Nile tilapia[J]. J Fish Biol, 1999, 54(3): 597-606. doi: 10.1111/j.1095-8649.1999.tb00638.x
[13] 黎军胜, 李建林, 吴婷婷. 饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J]. 中国水产科学, 2004, 11(6): 585-588. doi: 10.3321/j.issn:1005-8737.2004.06.018 [14] FANG L S, CHIOU S F. Effect of salinity on the activities of digestive proteases from the tilapia fish, Oreochromis niloticus in different culture environments[J]. Comp Biochem Physiol, 1989, 96A(2): 439-443. doi: 10.1016/0300-9629(89)90063-7
[15] 胡国成, 李思发, 何学军, 等. 不同饲料蛋白质水平对吉富品系尼罗罗非鱼幼鱼生长和鱼体组成的影响[J]. 饲料工业, 2006, 27(6): 24-27. doi: 10.3969/j.issn.1001-991X.2006.06.009 [16] 杨淞, 卢迈新, 黄樟翰, 等. 5种杂交F1罗非鱼生长性能比较研究[J]. 淡水渔业, 2006, 36(4): 41-44. doi: 10.3969/j.issn.1000-6907.2006.04.010 [17] 蔡一林, 岳永生. 水产生物统计[M]. 北京: 中国农业出版社, 2004, 86-91. [18] 林建喜, 袁重桂, 阮成旭, 等. 不同盐度下奥尼罗非鱼幼鱼生长的研究[J]. 福州大学学报, 2004, 34(6): 925-928. doi: 10.3969/j.issn.1000-2243.2006.06.032 [19] 刘贤敏, 李星星, 冷向军, 等. 盐度对奥尼罗非鱼和乌鳢生长及肌肉成分影响的比较研究[J]. 上海水产大学学报, 2008, 17(2): 242-246. https://wf.pub/perios/article:shscdxxb200802021 [20] KILAMBI R V, ZDINAK A. The effect of acclimation on the salinity tolerance of grass carp (Ctenopharyngodon idella Val)[J]. J Fish Biol, 1980, 16(2): 171-175. doi: 10.1111/j.1095-8649.1980.tb03696.x
[21] WANG J Q, LIU H L. Influence of salinity on food consumption, growth and energy conversion efficiency of common carp (Cyprinus carpio) fingerlings[J]. Aquac, 1990, 148(2/3): 115-124. doi: 10.1016/S0044-8486(96)01334-8
[22] BOEUF G, PAYAN P. How should salinity influence fish growth?[J]. Comp Biochem Physiol Part C, 2001, 130(4): 411-423. doi: 10.1016/S1532-0456(01)00268-X
[23] HWULER E F. Influence of temperature and salinity on routine metabolic rate and growth of young Atlantic menhaden[J]. J Fish Biol, 1976, 8(1): 55-65. doi: 10.1111/j.1095-8649.1976.tb03907.x
[24] KILAMBI R V M. Food consumption, growth and survival of grass carp Ctenopharyngodon idella Val at four sanilities[J]. J Fish Biol, 1980, 17(6): 613-618. doi: 10.1111/j.1095-8649.1980.tb02794.x
[25] FEBRY R, LUTZ P. Energy partitioning in fish: the activity-related cost of osmoregulation in a Euryhaline Cichlid[J]. J Exp Biol, 1987, 128(1): 63-85. doi: 10.1242/jeb.128.1.63
[26] SANCHEZ-CHIANG L, CISTERNAS E, PONCE O. Partial purification of pepsins from adult and juvenile salmon fish Oncorhynchus keta, effect of NaCI on proteolytic activities[J]. Comp Biochem Physiol, 1987, 87(4): 793-797. doi: 10.1016/0305-0491(87)90390-7
[27] 林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 2002. https://xueshu.baidu.com/usercenter/paper/show?paperid=89415f4ae2bf3db0c9cfda6c9efb14be [28] 李希国, 李加儿, 区又君. 盐度对黄鳍鲷幼鱼消化酶活性的影响及消化酶活性的昼夜变化[J]. 海洋水产研究, 2006, 27(1): 40-45. doi: 10.3969/j.issn.1000-7075.2006.01.007 [29] 陈品健, 王重刚, 郑森林. 盐度影响真鲷幼鱼消化酶活力的研究[J]. 厦门大学学报: 自然科学版, 1998, 37(5): 754-756. [30] VONCK A, BONGA S, FLIK G. Sodium and calcium balance in Mozambique tilapia, Oreochromis mossambicus, raised at different salinities[J]. Comp Biochem Phsiol, 1998, 119(2): 441-449. doi: 10.1016/S1095-6433(97)00450-9
[31] 谢一荣, 吴锐全. 鱼类消化酶研究及其在水产养殖中的应用[J]. 广东饲料, 2005, 14(2): 15-18. doi: 10.3969/j.issn.1005-8613.2005.02.008 [32] 陈慕雁. 大菱鲆不同发育阶段消化生理的研究[D]. 青岛: 中国海洋大学, 2004. [33] INFANTE J L I, CAHU C. Sea bass(Dicentrarchus labrax) larvae and juvenile fed different Artemia ratins; growth, pancreas enzymatic response and development of digestive function[J]. Aquac, 1996, 139(1/2): 129-138. doi: 10.1016/0044-8486(95)01149-8
[34] KOHLA U, SAINT-PAUL U, FRIEBE J. Growth, digestive enzyme activities and hepatic glycogen levels in juvenile Colosoma macropomum Cuvier from South America during feeding, starvation and refeeding[J]. Nutr Abst Rev (Series B), 1993, 63(6): 3 130. doi: 10.1111/j.1365-2109.1992.tb00610.x



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
