Stress resistance of young seedlings of Sargassum horneri to a variety of temperatures, irradiances and salinities revealed by chlorophyll fluorescence measurements
-
摘要:
2008年以全人工条件下培育的铜藻Sargassum horneri幼苗为材料,利用叶绿素荧光测定仪,通过测量经过暗适应后最大叶绿素荧光量子产量变化(Fv/Fm),研究了不同温度、光照强度和盐度条件下铜藻幼苗光合作用的变化。数据表明,幼苗存活温度上限为28℃,最适生长温度为22~24℃。在消减的太阳光照射下,受胁迫的幼苗即时荧光产量(Fm′)最低降到0.4。随着光强降低,Fm′可恢复到初始值0.73;在室外太阳光直射下,胁迫幼苗的Fm′最低降到0.11,24 h恢复后为0.5,叶片有萎焉现象。结果表明,铜藻幼苗易受高温、强光胁迫,最好进行遮光培育。9~60盐度的胁迫6 h以内对幼苗的Fv/Fm影响不明显,淡水在1 h内对铜藻的Fv/Fm无影响,可以将苗帘直接浸泡在淡水中以清除对低盐敏感的附生杂藻。
Abstract:In 2008, photosynthetic performances of young seedlings of Sargassum horneri were investigated under various temperatures, irradiances and salinities by use of chlorophyll fluorescence measurements. Results showed that the highest survival temperature of young seedlings was 28℃ and the appropriate growth temperature ranged from 22 to 24℃. Under reduced solar irradiance, in situ fluorescence yields Fm′ decreased to 0.4, but recovered to 0.73 when the irradiance declined over time. Under full spectrum of solar irradiance, the Fm′of the seedlings decreased to 0.11 and recovered to 0.5 after 24 h under standard culture condition. Therefore young seedlings of this alga needed a shaded light climate for growth under greenhouse condition. Six hours treatments in 9~60 salinity of seawater and 1 h in fresh water did not affect the optimal chlorophyll fluorescence quantum yields (Fv/Fm), so epiphytic algae that were sensitive to osmotic changes could be removed by such treatments at fixed time intervals.
-
Keywords:
- Sargassum horneri /
- chlorophyll fluorescence quantum yields /
- PAM /
- seaweed cultivation /
- stress
-
铜藻Sargassum horneri(Turn)属褐藻门马尾藻属,为北太平洋西部特有的暖温带性大型海藻,生长在低潮带深沼中或大干潮线深至4 m处的岩石上[1]。铜藻不仅是海藻工业的优质原料,还被广泛应用到医药、食品、饲料和有机肥料等方面,具有较高的商业价值。铜藻具有生长快速和生物量巨大的特点,因而被海洋生态学家列为重建海底藻场和实施海洋生态修复的重要物种之一[2]。目前,关于铜藻的报道多集中在对其繁殖、生理和生态方面的研究[2-4]。中国是一个海藻养殖大国,从暖温带到亚热带,每年鲜海藻产量高达400万t,铜藻作为一个潜在的人工栽培海藻物种,相应的胁迫生理研究目前是空白,而幼苗时期对各种不良环境条件的反应和相应处理措施通常是实现一种海藻人工栽培所必须要了解的。
叶绿素荧光技术(chlorophyll fluorescence measurements)是20世纪80年代崛起的一种有效、操作简单、对受试对象无伤害的快速光合生理测定技术,被广泛应用在陆地作物和海藻胁迫生理的研究领域[5]。该技术可以在不破损活体样品(甚至不发生任何接触)的情况下用来了解海藻光合生理状态,判断其转化光能的效率,测定电子传递的速率,估计其受环境条件胁迫(如温度、光照等)的程度。因此,叶绿素荧光技术不仅可以应用于基础光合作用研究领域,而且可以应用到植物生态生理学领域。2007~2008年在全人工条件下,采用同步受精技术实现了大规模铜藻苗种培育。此项研究的主要目的是利用叶绿素荧光测量技术了解全人工铜藻幼苗在不同温度、光照强度和盐度等胁迫条件下光合效率的表现,从而为今后苗种的大规模栽培提供直接技术支持。
1. 材料与方法
1.1 试验材料
2007~2008年在中国科学院海洋研究所海洋生物种质库种质培养室80 L(65 cm×45 cm×35 cm)PP水箱中人工培育的铜藻幼苗,按照大小相近原则随机挑选健康藻体,质量0.039±0.05 g,藻体叶片4~6片,最长叶长1.78±0.02 cm,主茎长度约0.3 cm。
1.2 试验方法
用Mini-PAM光量子分析仪(Walz Effeltrich,德国产)测量叶绿素荧光参数,包括PSII最大荧光量子产量(Fv/Fm)和即时叶绿素荧光量子产量(Fm′)。测量经温度、室外太阳直射光以及高、低盐度处理样品的Fv/Fm值,基本方法参照PANG等[6],将藻体分别置于9 cm培养皿中,培养皿中加入20 mL PES(provasli enriched seawater),用载玻片(76.2 mm×25.4 mm×1.2 mm)盖压藻体,从而保证测量时,光源和藻体距离恒定。测量前首先将样品暗适应20 min。测量时PAM光纤探头的末端垂直对准藻体基部。测量室内消减的太阳光条件下培养藻体的Fm′的测量方法参考图 1。将5棵藻体用橡皮筋分别固定在图 1所示的5个斜面装置下部平台上,藻体基部对准斜面小孔,保证PAM光纤末端以固定的距离对准藻体基部,5个重复的斜面装置并排放到水箱中,藻体没于水面下5 cm。固定的距离可以保持5个重复测量的一致性。除特殊说明均用光度计(SAMPO-LX1330A)记录光照强度,紫外强度计(TN-2340)记录紫外光强度,溶解氧电导仪记录温度。
1.3 试验设计
1.3.1 温度试验
试验1设置3个温度(25、30和35℃)和室温对照(18℃)。20棵铜藻分别投入2 L烧杯,每烧杯5棵,加入1 600 mL PES,放入25±0.5、30±0.5和35±0.5℃光照培养箱(宁波江南仪器厂)和室温培养架上(18±0.5℃),通气培养。盐度30.8,光强90~100 μmol photons · m-2 · s-1,除特殊说明此试验光照周期均为光照12 h · d-1。分别测量在胁迫培养1 h后和在对照条件下恢复24 h后的Fv/Fm。试验2设置3个温度(26、28和30℃)和室温对照(18℃)。20棵铜藻分别投入2 L烧杯,每烧杯5棵,加入1 600 mL PES,放入26±0.5、28±0.5和30±0.5℃光照培养箱和室温培养架上,通气培养10 d后,在对照条件下恢复培养24 h,每天更换培养液。盐度29.8~31.9,光照强度同试验1。每天测量Fv/Fm,记录试验个体的初始和最终重量(g)。试验3设置3个温度(22、24和26℃)和室温对照(18℃)。20棵铜藻分别投入2 L烧杯,每烧杯5棵,加入1 600 mL PES,放入22±0.5、24±0.5和26±0.5℃光照培养箱和室温培养架上,通气培养。10 d后恢复培养24 h,每天更换PES。光照强度同试验1。每天测量Fv/Fm,记录初始和最终重量(g)和最长叶长(cm)。
1.3.2 光照胁迫
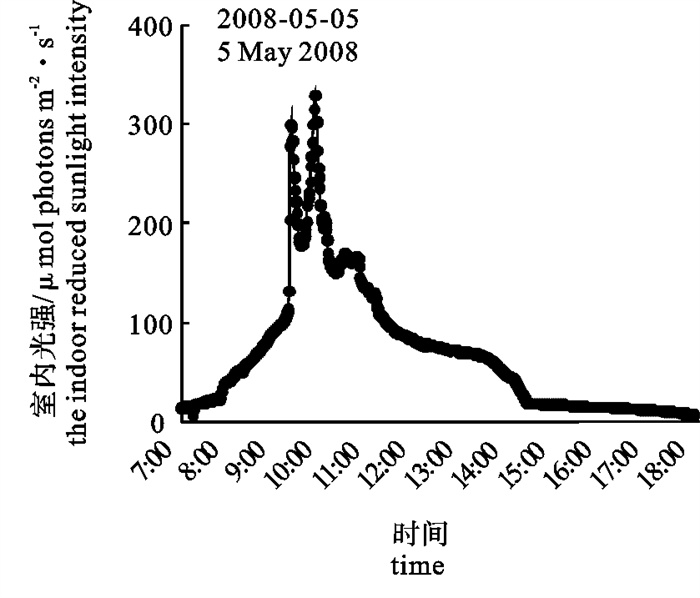
(1) 室外实验。将铜藻幼苗固定在长塑料板(57.5 cm×9.8 cm×1 cm)上,置于室外水箱中(200 cm×57 cm×50 cm),藻体没于水下约5 cm,在太阳直射光下培养1、2、3、4、5和6 h后分别取藻体5棵,测量Fv/Fm,全程记录直射光和紫外线强度(280~320 nm),之后,室内通气恢复培养24 h,光强98 μmol photons · m-2 · s-1,测量Fv/Fm。室外水箱水温变化范围17.5~22.9℃。(2)室内消减的太阳光胁迫(直射太阳光的70%,不含紫外线)。试验在室内80 L翻滚式充气培养PP水箱(82 cm×40 cm×30 cm)中进行,室内可接受70%日光照射[6]。将5棵藻体用橡皮筋分别固定在图 1所示的5个斜面装置中,藻体基部对准斜面小孔,保证PAM光纤末端对准藻体基部,将装置并排放到水箱中,藻体没于水面下5 cm处,从7: 00~18: 00每1 h测量藻体的即时荧光产量(Fm′)。用球形光度计(Biospherical,美国产)在线记录室内光强。水箱水温17.6℃,盐度30.6。
1.3.3 盐度胁迫
(1) 高盐胁迫。试验设置3个盐度(30、45和60),其中盐度30作为对照。60棵铜藻分别投入2 L烧杯,每烧杯20棵,加入1 600 mL PES,培养架上(18±0.5℃)通气培养。光强90~100 μmol photons · m-2 · s-1。处理30 min,1、3和6 h后,每个处理随机取样5棵,测量Fv/Fm。恢复培养24 h后测Fv/Fm。(2)低盐胁迫。试验设置4个盐度(30、21、9和0),30作为对照。80棵铜藻分别投入2 L烧杯,每烧杯20棵,加入1 600 mL PES,培养架上18±0.5℃通气培养。光强90~100 μmol photons · m-2 · s-1。处理30 min,1、3和6 h后,每个处理取样5棵,测量Fv/Fm。恢复培养24 h后测Fv/Fm。
1.4 数据处理
试验数据经One-Way ANOVA统计处理,P < 0.05表示显著差异。
2. 结果
2.1 温度试验
2.1.1 温度试验1
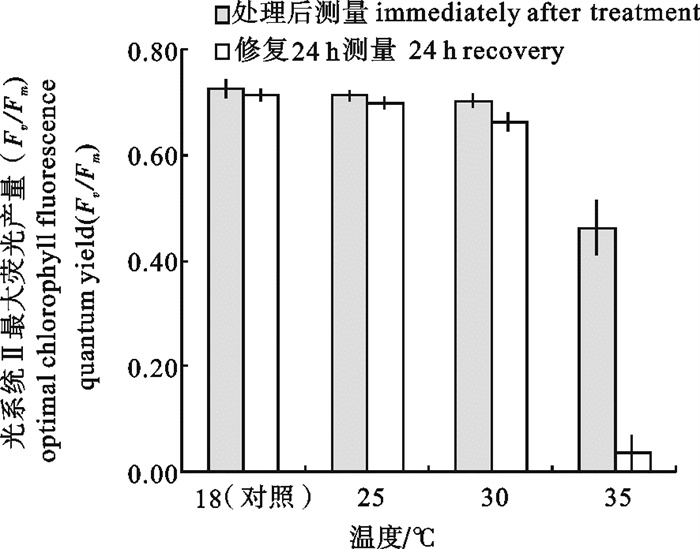
和对照相比,35℃胁迫1 h铜藻的Fv/Fm降到对照的63%,经24 h恢复仅为4.96%,个别参数甚至降到0(图 2)。原本黄褐色的叶片明显萎焉苍白,个别叶片甚至脱落,短时间35℃高温会明显不可逆转的破坏铜藻幼苗光合系统。
2.1.2 温度试验2
和对照相比,10 d内经28℃处理铜藻幼苗的Fv/Fm明显下降(P < 0.05),且叶片明显萎缩,但24 h恢复后的Fv/Fm同对照相比无显著差异。30℃处理后以及经过24 h恢复后的Fv/Fm同对照相比有显著差异(P < 0.05) (表 1);28℃处理组生长速度仅为0.83% · d-1,30℃处理组生长速度呈负值,为-0.88% · d-1 (表 2)。可以看出在此试验条件下铜藻幼苗生长的温度上限为28℃。
表 1 3种温度条件下跟踪铜藻幼苗10 d, 起始和24 h修复后的Fv/Fm(n=5)Table 1 Initial and final optimal chlorophyll fluorescence quantum yields (Fv/Fm) of the seedlings of S.horneri after exposed to three temperatures for 10 d and the corresponding recovered values after 24 hMeans±SD 时间time 18℃(对照) (control) 26℃ 28℃ 30℃ 初始值initial value 0.73±0.01 0.73±0.01 0.72±0.02 0.72±0.01* 第10天tenth day 0.73±0.01 0.72±0.01 0.66±0.02* 0.55±0.02* 恢复24 h 24 h recovery 0.73±0.01 0.72±0.01 0.68±0.02 0.53±0.02* 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)表 2 3种温度条件下处理10 d后铜藻幼苗的相对生长速度(n=5)Table 2 Relative growth rates in weights of S.horneri seedlings after exposure to three temperatures for 10 days18℃(对照) (control) 26℃ 28℃ 30℃ 起始平均重量/g initial average weight 0.046±0.01 0.045±0.01 0.046±0.01 0.046±0.01 最终平均重量/g ultimate average weight 0.072±0.02 0.058±0.01* 0.050±0.01* 0.043±0.05* 相对生长速度/%·d-1 relative growth rate 4.48 2.56 0.83 -0.88 注:*.与对照相比有显著差异(P < 0.05)
Note:*.statistically significant with the initial control (P < 0.05)2.1.3 温度试验3
22、24和26℃处理10 d的幼苗的鲜重增长速度为4.53,5.99和2.59% · d-1,叶长增长的速度为2.32,2.04和0.52% · d-1,22和24℃处理的最终平均重量和叶长同对照相比有显著差异(P<0.05)(表 3)。因此,在此试验条件下,铜藻幼苗最适生长温度是22~24℃。
表 3 3种温度条件下处理10 d后铜藻幼苗的生长速度(n=5)Table 3 Relative growth rates in weights and the longest leaves of S.horneri seedlings after exposure to three temperatures for 10 days18℃(对照) (control) 22℃ 24℃ 26℃ 起始平均重量/g initial averaged weight 0.036±0.001 0.038±0.001 0.038±0.003 0.038±0.004 最终平均重量/g ultimate averaged weight 0.05±0.007 0.06±0.006* 0.069±0.006* 0.049±0.001 相对生长速率(重量)/%·d-1 relative growth rates in weights 3.85 4.53 5.99 2.59 起始平均最长叶长/cm initial averaged length of the longest leaves 1.88±0.08 1.76±0.05 1.86±0.13 1.67±0.11 最终平均最长叶长/cm ultimate averaged length of longest leaves 2.18±0.08 2.22±0.19 2.28±0.21 1.76±0.2* 相对生长速率(最长叶长)/%·d-1 relative growth rates in length 1.48 2.32 2.04 0.52 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)2.2 光胁迫
2.2.1 室内消减的太阳光胁迫(70%太阳光,不含紫外线)
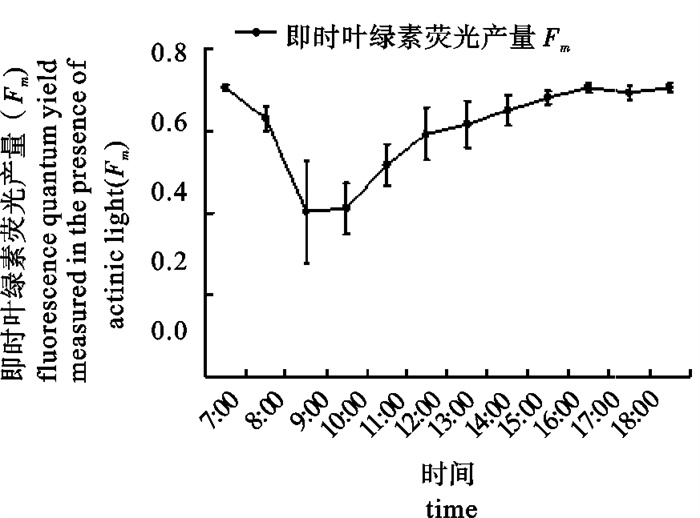
Fm′随光强增加而降低,上午9: 00~10: 00,最高光强320 μmol photons · m-2 · s-1,Fm′最低降到0.4左右(图 3)。随着光强降低,Fm′逐渐恢复,到16: 00时基本恢复到上午7: 00时的水平(图 4)。
2.2.2 室外光胁迫
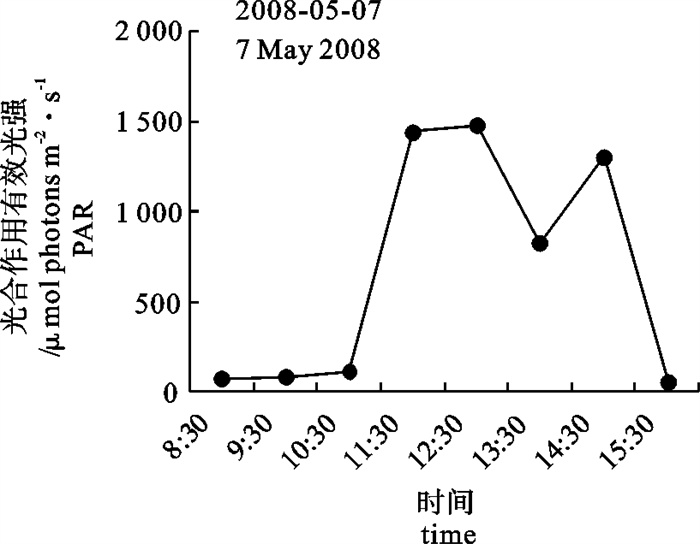
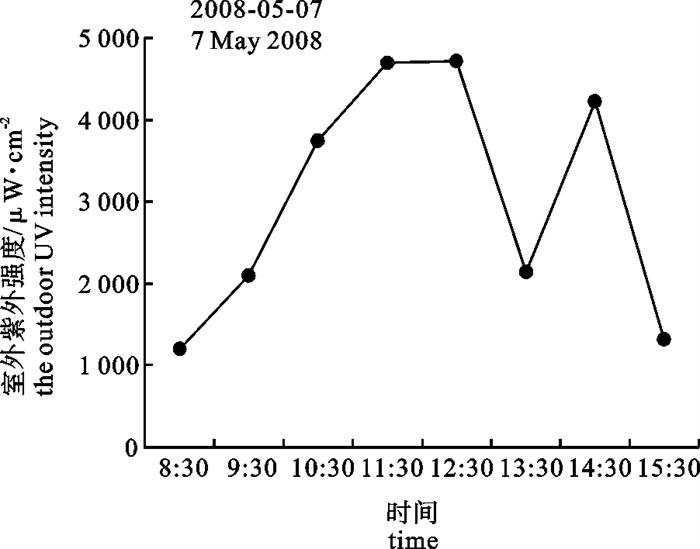
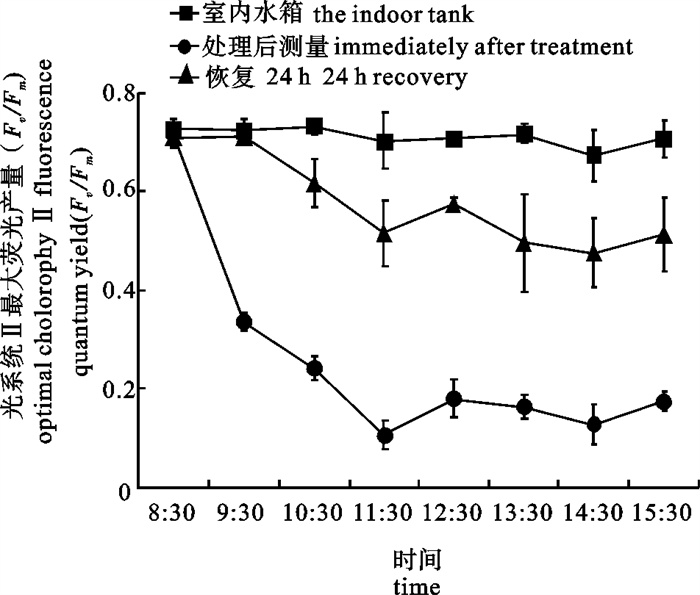
8: 30开始将铜藻幼苗暴露在室外水箱中仅1 h,Fv/Fm就降到0.36,随着光强和紫外强度的增强,Fv/Fm急剧下降,11: 30(最高1 490 μmol photons · m-2 · s-1和最高紫外光4 720 μW · cm-2)时降到0.11(图 5、图 6和图 7),仅为同一时间室内对照水箱的15%左右,随着光强和紫外光的降低稍有回升。经过24 h室内恢复后,处理1 h幼苗的Fv/Fm基本恢复到对照水平,超过1 h处理幼苗的Fv/Fm虽都有不同程度的恢复(图 7),但是幼苗叶片明显萎焉。
![]() 图 7 暴露在室外水箱以及24 h室内恢复后铜藻幼苗的Fv/Fm以室内水箱同一时刻铜藻的Fv/Fm作对照 (n=5)Fig. 7 Optimal chlorophyll fluorescence quantum yields (Fv/Fm)of seedlings of S.horneri after exposure to direct solar irradiation in outdoor tank and the corresponding recovered values after 24 h indoor cultureFv/Fm of S.horneri in indoor tank at the same time was used as the control (n=5)
图 7 暴露在室外水箱以及24 h室内恢复后铜藻幼苗的Fv/Fm以室内水箱同一时刻铜藻的Fv/Fm作对照 (n=5)Fig. 7 Optimal chlorophyll fluorescence quantum yields (Fv/Fm)of seedlings of S.horneri after exposure to direct solar irradiation in outdoor tank and the corresponding recovered values after 24 h indoor cultureFv/Fm of S.horneri in indoor tank at the same time was used as the control (n=5)2.3 盐胁迫
2.3.1 高盐胁迫
随着盐度增加,处理时间的延长,幼苗的Fv/Fm明显降低,24 h恢复后,即使在盐度60处理6 h的Fv/Fm也恢复到正常水平(P>0.05)(表 4)。藻体色泽无变化。表明幼苗能够耐受较高渗透压变化。
表 4 3个盐度条件下处理0.5、1, 3和6 h以及恢复24 h的铜藻的Fv/Fm(n=5)Table 4 Optimal chlorophyll fluorescence quantum yield (Fv/Fm) of seedlings of S.horneri after exposure to three different salinities for 0.5, 1, 3 and 6 h, respectively, and the recovered Fv/Fm after 24 hMeans±SD 盐度salinity 处理treatment 0.5 h 1 h 3 h 6 h 30 处理后测量 0.75±0.01 0.74±0.01 0.73±0.01 0.73±0.01 修复24 h后 0.72±0.01 0.72±0.02 0.72±0.01 0.72±0.01 45 处理后测量 0.69±0.02 0.68±0.02 0.68±0.01 0.68±0.02 修复24 h后 0.73±0.04 0.73±0.01 0.74±0.02 0.70±0.01 60 处理后测量 0.64±0.04* 0.7±0.02 0.66±0.02 0.61±0.01* 修复24 h后 0.72±0.01 0.72±0.02 0.69±0.02 0.68±0.02 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)2.3.2 低盐胁迫
随着盐度降低和处理时间的延长,幼苗的Fv/Fm均呈下降趋势。盐度0处理0.5,1,3和6 h的Fv/Fm分别为对照组的95.77%,78.38%,50.00%和36.49%,经24 h恢复后藻体的Fv/Fm分别为对照组的97.18%,76.71%,44.44%和28.38%,因此,即使在淡水中处理1 h,幼苗的Fv/Fm基本可恢复(P>0.05),幼苗依然健康,色泽无变化;盐度9和21在6 h以内处理以及恢复的Fv/Fm分别为对照组的98.65%和90.54%,和对照组相比虽然有所降低,但不明显(P>0.05)(表 5)。结果表明,渗透压的降低对铜藻的影响不大,与羊栖菜(Sargassum fusiforme)的结果相似,但羊栖菜在淡水中处理6 h,Fv/Fm也可基本完全恢复[6]。
表 5 4种盐度条件下处理0.5, 1, 3和6 h以及24 h恢复后的铜藻幼苗的Fv/Fm(n=5)Table 5 Optimal chlorophyll fluorescence quantum yield (Fv/Fm) of seedlings of S.horneri after exposure to four salinities for 0.5, 1, 3 and 6 h, respectively, and the recovered Fv/Fm after 24 hMeans±SD 盐度salinity 处理treatment 0.5 h 1 h 3 h 6 h 30 处理后测量 0.72±0.01 0.74±0.01 0.72±0.01 0.74±0.01 修复24 h后 0.71±0.01 0.73±0.03 0.72±0.02 0.74±0.01 21 处理后测量 0.71±0.01 0.74±0.03 0.72±0.02 0.73±0.01 修复24 h后 0.71±0.01 0.73±0.02 0.73±0.01 0.67±0.02 9 处理后测量 0.71±0.01 0.71±0.02 0.68±0.03 0.67±0.02 修复24 h后 0.71±0.01 0.72±0.02 0.66±0.06* 0.60±0.02* 0 处理后测量 0.68±0.01 0.58±0.01* 0.36±0.07* 0.27±0.20* 修复24 h后 0.69±0.01 0.56±0.01* 0.32±0.10* 0.21±0.10* 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)3. 讨论
叶绿素荧光作为光合作用能量转换的天然探针,含有极其丰富的光合作用信息,因易受逆境胁迫影响,广泛用于研究和探测逆境对植物光合作用生理的影响[7-8]。Fv/Fm表示PSII最大光量子产量,即PSII原初光能转换效率,是衡量PSII完整性的指标,SCHANSKER等[9]发现,当Fv/Fm大于0.44时,PSII活性随着Fv/Fm的降低而降低,当小于0.44时就完全失去活性,表现出反应中心的破坏。PSII反应中心失活分为PSII反应中心可逆失活和PSII反应中心遭到破坏[10]。
通过测量胁迫环境条件下铜藻幼苗的叶绿素荧光产量的变化,结果表明,35℃的高温在1 h已经对铜藻的PSII造成了不可逆转的损伤,幼苗可耐受的温度上限为28℃,不耐较强室外光胁迫,此试验最高1 490 μmol photons · m-2 · s-1和最高紫外光4 720 μW · cm-2已经对铜藻造成致命伤害,室内消减的太阳光320 μmol photons · m-2 · s-1虽然能对铜藻造成光抑制,但可恢复。铜藻具有较强耐受高盐(盐度60处理6 h)和淡水能力(盐度0处理1 h)。同为马尾藻属、马尾藻科,羊栖菜却能耐受40℃的高温长达6 h,室外强光胁迫(1 800 μmol photons · m-2 · s-1)和低盐胁迫(淡水6 h)[6]。此试验的环境因子都是影响海洋藻类生长的关键因素。
目前,国内外对高等植物生理胁迫的研究较多,但对大型海藻的研究较少[7, 11-12]。在高等植物中,有关高温胁迫机制的研究较为成熟。大量研究表明,PSII是最易热敏感的色素蛋白复合体之一[13-14],其活性在高温时受到抑制。还有报道称,类囊体膜对高温非常敏感,高温也会导致类囊体膜结构的改变,此种改变是由D1蛋白结构的改变所导致,高温使LHCII(捕光色素蛋白复合体II)与PSII反映中心脱离,与高等植物相比,大型藻类中含有藻体蛋白,最复杂的藻体蛋白位于类囊体膜的表面。高温会导致此类大型藻类PSII失活,并且使藻胆体的(PBS)从PSII反应中心脱离出来,还会导致藻胆蛋白降解[15]。由于Fv/Fm反映的是暗适应状态下光系统II的量子产量,强光导致Fv/Fm的不可逆说明,光抑制直接作用于光系统II的反应中心(包括天线色素)。照光后光系统II的量子产量降低,不仅是因为部分光系统II反应中心关闭,也是因为热耗散的增加,长时间暴露在室外光下幼苗的Fv/Fm明显降低,说明PSII光合能力下降,几乎所有吸收来的光能都被转化为热能,而没被转化为光合能[7, 16]。铜藻幼苗受室内消减太阳光可逆抑制的能力与海带(Laminaria japonica)、孔石莼(Ulva pertusa)、掌状红皮藻(Palmaria palmata)相同。
在此项研究中,铜藻幼苗最适生长温度为22~24℃,结果符合自然种群幼苗出现时间基本在夏季早期的观察[2]。由于铜藻的商业化栽培或者大规模重建铜藻藻场还没有实现,相关研究基本是空白,此项研究的结果提供了有价值的科学数据。另外,附生杂藻的去除是海藻人工栽培过程中一大难题。附生杂藻同要培养的海藻竞争生存空间、营养和光照[6]。在海带苗种培育过程中,每天都要用大量的海水冲洗苗帘来去除附生杂藻。在紫菜(Porphyra spp.)养殖中,随着潮汐变化,苗网每天都会干出一段时间,杂藻从而得到有效抑制(生产实践)。在铜藻人工苗种的人工培育过程中,根据此项研究可以采用自来水短暂浸泡的方法来有效地消除一些对渗透压敏感的杂藻种类,如石莼属(Ulva spp.)、多管藻属(Polysiphonia spp.)和水云属(Ectocarpus spp.)中的种类。采用叶绿素荧光技术检测海藻光合生理变化的最大优点是快速、简便、灵敏、以及对受测试的藻体无损伤[6],可以预测,该种技术将被广泛地应用在海藻人工栽培的研究中。
致谢: 实验室技术员高素芹和宋春华在开展培养过程中所提供的热心帮助和支持,孙建璋老师在实验过程中给予了帮助,谨此致谢! -
图 7 暴露在室外水箱以及24 h室内恢复后铜藻幼苗的Fv/Fm
以室内水箱同一时刻铜藻的Fv/Fm作对照 (n=5)
Figure 7. Optimal chlorophyll fluorescence quantum yields (Fv/Fm)of seedlings of S.horneri after exposure to direct solar irradiation in outdoor tank and the corresponding recovered values after 24 h indoor culture
Fv/Fm of S.horneri in indoor tank at the same time was used as the control (n=5)
表 1 3种温度条件下跟踪铜藻幼苗10 d, 起始和24 h修复后的Fv/Fm(n=5)
Table 1 Initial and final optimal chlorophyll fluorescence quantum yields (Fv/Fm) of the seedlings of S.horneri after exposed to three temperatures for 10 d and the corresponding recovered values after 24 h
Means±SD 时间time 18℃(对照) (control) 26℃ 28℃ 30℃ 初始值initial value 0.73±0.01 0.73±0.01 0.72±0.02 0.72±0.01* 第10天tenth day 0.73±0.01 0.72±0.01 0.66±0.02* 0.55±0.02* 恢复24 h 24 h recovery 0.73±0.01 0.72±0.01 0.68±0.02 0.53±0.02* 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)表 2 3种温度条件下处理10 d后铜藻幼苗的相对生长速度(n=5)
Table 2 Relative growth rates in weights of S.horneri seedlings after exposure to three temperatures for 10 days
18℃(对照) (control) 26℃ 28℃ 30℃ 起始平均重量/g initial average weight 0.046±0.01 0.045±0.01 0.046±0.01 0.046±0.01 最终平均重量/g ultimate average weight 0.072±0.02 0.058±0.01* 0.050±0.01* 0.043±0.05* 相对生长速度/%·d-1 relative growth rate 4.48 2.56 0.83 -0.88 注:*.与对照相比有显著差异(P < 0.05)
Note:*.statistically significant with the initial control (P < 0.05)表 3 3种温度条件下处理10 d后铜藻幼苗的生长速度(n=5)
Table 3 Relative growth rates in weights and the longest leaves of S.horneri seedlings after exposure to three temperatures for 10 days
18℃(对照) (control) 22℃ 24℃ 26℃ 起始平均重量/g initial averaged weight 0.036±0.001 0.038±0.001 0.038±0.003 0.038±0.004 最终平均重量/g ultimate averaged weight 0.05±0.007 0.06±0.006* 0.069±0.006* 0.049±0.001 相对生长速率(重量)/%·d-1 relative growth rates in weights 3.85 4.53 5.99 2.59 起始平均最长叶长/cm initial averaged length of the longest leaves 1.88±0.08 1.76±0.05 1.86±0.13 1.67±0.11 最终平均最长叶长/cm ultimate averaged length of longest leaves 2.18±0.08 2.22±0.19 2.28±0.21 1.76±0.2* 相对生长速率(最长叶长)/%·d-1 relative growth rates in length 1.48 2.32 2.04 0.52 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)表 4 3个盐度条件下处理0.5、1, 3和6 h以及恢复24 h的铜藻的Fv/Fm(n=5)
Table 4 Optimal chlorophyll fluorescence quantum yield (Fv/Fm) of seedlings of S.horneri after exposure to three different salinities for 0.5, 1, 3 and 6 h, respectively, and the recovered Fv/Fm after 24 h
Means±SD 盐度salinity 处理treatment 0.5 h 1 h 3 h 6 h 30 处理后测量 0.75±0.01 0.74±0.01 0.73±0.01 0.73±0.01 修复24 h后 0.72±0.01 0.72±0.02 0.72±0.01 0.72±0.01 45 处理后测量 0.69±0.02 0.68±0.02 0.68±0.01 0.68±0.02 修复24 h后 0.73±0.04 0.73±0.01 0.74±0.02 0.70±0.01 60 处理后测量 0.64±0.04* 0.7±0.02 0.66±0.02 0.61±0.01* 修复24 h后 0.72±0.01 0.72±0.02 0.69±0.02 0.68±0.02 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05)表 5 4种盐度条件下处理0.5, 1, 3和6 h以及24 h恢复后的铜藻幼苗的Fv/Fm(n=5)
Table 5 Optimal chlorophyll fluorescence quantum yield (Fv/Fm) of seedlings of S.horneri after exposure to four salinities for 0.5, 1, 3 and 6 h, respectively, and the recovered Fv/Fm after 24 h
Means±SD 盐度salinity 处理treatment 0.5 h 1 h 3 h 6 h 30 处理后测量 0.72±0.01 0.74±0.01 0.72±0.01 0.74±0.01 修复24 h后 0.71±0.01 0.73±0.03 0.72±0.02 0.74±0.01 21 处理后测量 0.71±0.01 0.74±0.03 0.72±0.02 0.73±0.01 修复24 h后 0.71±0.01 0.73±0.02 0.73±0.01 0.67±0.02 9 处理后测量 0.71±0.01 0.71±0.02 0.68±0.03 0.67±0.02 修复24 h后 0.71±0.01 0.72±0.02 0.66±0.06* 0.60±0.02* 0 处理后测量 0.68±0.01 0.58±0.01* 0.36±0.07* 0.27±0.20* 修复24 h后 0.69±0.01 0.56±0.01* 0.32±0.10* 0.21±0.10* 注:*. 与对照相比有显著差异(P < 0.05)
Note:*. statistically significant with the initial control (P < 0.05) -
[1] 曾呈奎. 海带养殖学[M]. 北京: 科学出版社, 1962. [2] 孙建璋, 庄定根, 陈万东, 等. 铜藻Sargassum horneri繁殖生物学及种苗培育研究[J]. 南方水产, 2008, 4(2): 7-13. doi: 10.3969/j.issn.2095-0780.2008.02.002 [3] 孙建璋, 陈万东, 庄定根, 等. 中国南麂列岛铜藻Sargassum horneri实地生态学的初步研究[J]. 南方水产, 2008, 4(3): 58-63. doi: 10.3969/j.issn.2095-0780.2008.03.010 [4] UCHIDA T. The life circle of Sargassum horneri (Phaeophyta) in laboratory culture[J]. J Phycol, 1993, 29(2): 231-235. doi: 10.1111/j.0022-3646.1993.00231.x
[5] SCHREIBER U. Pulse-Amplitude-Modulation (PAM) fluorometry and saturation pulse method: an overview[M] //PAPAGEORGIOU G C, GOVINDJEE (Eds). Advances in photosynthesis and respiration, vol. 19. Chlorophyll a fluorescenc: a signature of photosynthesis. Berlin: Springer, 2004: 321-362. doi: 10.1007/978-1-4020-3218-9_11
[6] PANG S J, ZHANG Z H, ZHAO H J, et al. Cultivation of the brown alga Hizikia fusiformis (Harvey) Okamura: stress resistance of artificially raised young seedlings revealed by chlorophyll fluorescence measurement[J]. J Appl Phycol, 2007, 19(5): 557-565. doi: 10.1007/s10811-007-9170-y
[7] BAKER N R, ROSENQVIST E. Application of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities[J]. J Exp Botany, 2004, 55(403): 1 607-1 621. doi: 10.1093/jxb/erh196
[8] ADAMS III W W, DEMMIG-ADAMS B. Chlorophyll fluorescence as a tool to monitor plant response to the environment[M] //PAPAGEORGIOU G C, GOVINDJEE(Eds). Adavance in photosynthesis and respiration, vol. 19. Cholophyll a fluorescence: a signature of photosynthesis. Berlin: Springer, 2004: 598. doi: 10.1007/978-1-4020-3218-9_22
[9] SCHANSKER G, van RENSEN J J S. Performance of active photosystem II centers in photoinhibited pea leaves[J]. Photosynthesis Res, 1999, 62(2/3): 175-184. doi: 10.1023/A:1006374707722
[10] 郭延平, 周惠芬, 曹光辉, 等. 高温胁迫对柑橘光合速率和光系统活性的影响[J]. 应用生态学报, 2003, 14(6): 867-870. [11] LARKINDALE J, HALL J D, KNIGHT M R, et al. Heat sress phenotypes of Arabidopsis mutants implicate multipe signaling pathways in the acquisition of thermotolerance[J]. Plant Physiol, 2005, 138(3): 882-897.
[12] DAVISION I R, PEARSON G A. Stress tolerance in intertidal seaweeds[J]. J Phycol, 1996, 32(2): 197-211. doi: 10.1111/j.0022-3646.1996.00197.x
[13] MORGAN-KISS R, IVANOV A G, WILLIANS J, et al. Differential thermal effects on the energy distribution between photosystem II and photosystem I in thylakiod membranes of psychrophilic and mesophilic alga[J]. Biochimica et Bio physica Acta, 2002, 1561(2): 251-265. doi: 10.1016/S0005-2736(02)00352-8
[14] WEN X, GONG H, LU C. Heat stress induces an inhibition of excitation energy transfer from phycobilisomes to photosystem II but not to photosystem I in a cyanobacterium Spirulina platensis[J]. Plant Physiol Biochem, 2005, 43(4): 389-395. doi: 10.1016/j.plaphy.2005.03.001
[15] 梁英, 冯力霞, 田传远, 等. 高温胁迫对盐藻和塔胞藻叶绿素荧光动力学的影响[J]. 中国水产科学, 2007, 4(6): 961-968. doi: 10.3321/j.issn:1005-8737.2007.06.011 [16] HANELT D. Photoinhibition of photosynthesis in marine macroalgae[J]. Sci Mar, 1997, 60(Suppl. 1): 243-248. https://www.semanticscholar.org/paper/Photoinhibition-of-photosynthesis-in-marine-Hanelt/97ab240e54729b7080e05b4134ee2552aa093a9c




 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
