Isolation, identification and drug sensitivity of Edwardsiella tarda from Pelteobagrus fulvidraco
-
摘要:
为确定重庆市荣昌区某养殖场黄颡鱼 (Pelteobagrus fulvidraco) 疾病爆发的原因,从患病黄颡鱼肝脏中分离到一株优势菌,命名为ET230818。通过形态学观察、生理生化鉴定和16S rRNA、gyrB、rpoB、cpn60基因序列分析确定ET230818为迟缓爱德华氏菌 (Edwardsiella tarda)。通过人工感染试验计算出菌株ET230818对黄颡鱼 [平均体质量 (17.5±2.5) g、平均体长 (15.0±1.2) cm] 的半数致死量 (LD50) 为2.51×106 CFU·mL−1。毒力基因检测结果显示,该菌株携带sodB、katB、esrB、gadB、fimA、citC和mukF毒力基因。组织病理学观察发现,患病黄颡鱼肝细胞排列杂乱、肿胀,脾组织中含血铁黄素聚集,肾小管收缩变窄且结构松散、萎缩;肠道黏膜细胞排列杂乱、坏死脱落,肠绒毛崩解,鳃小片明显变性弯折。抗菌药物敏感性试验与中草药抑菌试验发现,菌株ET230818对多西环素、恩诺沙星等11种抗菌药物高度敏感,丁香、五倍子等中草药对其具有较强的抑菌效果,研究可为黄颡鱼源迟缓爱德华氏菌的诊断和药物防治提供参考依据。
Abstract:To determine the cause of Pelteobagrus fulvidraco's disease outbreak on a breeding farm in Rongchang, Chongqing, we isolated a dominant bacterium from the liver of diseased fish and named it as ET230818. Based on morphological observation, physiological and biochemical identification and through the analysis of 16S rRNA, gyrB, rpoB and cpn60 gene sequences, we confirmed ET230818 as Edwardsiella tarda. The artificial infection experiment finds out the median lethal dose (LD50) of strain ET230818 to P. fulvidraco [Average body mass of (17.5±2.5) g, average body length of (15.0±1.2) cm] was 2.51×106 CFU·mL−1. Virulence gene test results show that the strain carried sodB, katB, esrB, gadB, fimA, citC and mukF virulence genes. Histopathological observation reveals that the infected P. fulvidraco had disordered and swollen hepatocytes, with hemosiderin concentration in spleen tissue; the renal tubules contracted and narrowed, and the structure of the renal tubules became loose and atrophied; the arrangement of intestinal mucosal cells was disorderly, necrotic and shedding; the intestinal villi disintegrated; and the branchial lamella was obviously deformed and bent. The antimicrobial susceptibility test and Chinese herbal antibacterial experiment show that strain ET230818 was highly sensitive to 11 western medicines such as Doxycycline and Enrofloxacin, and Chinese herbs like Syzygium aromaticum and Galla chinensis had strong bacteriostatic effects on E. tarda. This study can provide references for the diagnosis and drug control of E. tarda from P. fulvidraco.
-
Keywords:
- Pelteobagrus fulvidraco /
- Edwardsiella tarda /
- Identification /
- Virulence gene /
- Drug sensitivity
-
黄颡鱼 (Pelteobagrus fulvidraco),俗称黄蜡丁,隶属鲶形目、鲿科、黄颡鱼属,是一种广泛分布于我国江河湖泊中的杂食性鱼类,营底栖生活,对环境适应力较强[1-2]。黄颡鱼因具有肉质鲜嫩、肌间刺少、蛋白质含量高等优点,深受消费者喜爱,已成为我国重要的经济淡水养殖鱼类[3]。据统计,2022年我国黄颡鱼产量为59.98万吨,位居特种淡水养殖品种前列[4]。近年来,随着黄颡鱼养殖规模、密度不断增大,养殖过程中病害问题也日益突出,其中细菌性疾病尤为严重。病原菌常导致黄颡鱼大规模死亡,对其养殖产业造成巨大经济损失。常见的病原菌有迟缓爱德华氏菌 (Edwardsiella tarda)、维氏气单胞菌 (Aeromonas veronii) 和鲁氏耶尔森氏菌 (Yersinia enterocolitica) 等[5-6]。迟缓爱德华氏菌属于肠杆菌科、爱德华菌属,为无芽孢、无荚膜、有短鞭毛的革兰氏阴性细菌,适应能力极强,最适温度为25~37 ℃,最适pH为5.5~9.0[7];是一种人畜共患病原菌,感染种类广泛,目前已成为引起水产养殖动物发病的主要病原菌之一,常感染黄颡鱼、大口黑鲈 (Micropterus salmoides) 和罗非鱼 (Oreochromis mossambicus) 等多种水产养殖动物[6]。目前我国对水产养殖鱼类细菌疾病的治疗仍以抗生素为首选,但长期使用此类药物容易导致耐药性和药物残留问题[8-9]。
中草药是天然药物,毒副作用少,可有效避免药物残留,不易产生耐药性;中草药还含有多种有益成分,可以促进生长、调节免疫力和提高机体抗病力等[10-11]。中草药中的黄连 (Coptis chinensis Franch.)、黄芪 [Astragalus membranaceus (Fisch.) Bunge]、蒌叶 (Piper betle L.)、番石榴 (Psidium guajava L.)、肿柄菊 [Tithonia diversifolia (Hemsl.) A. Gray]等对嗜水气单胞菌 (A. hydrophila)、无乳链球菌 (Streptococcus agalactiae)、哈维氏弧菌 (Vibrio harveyi)和金黄色葡萄球菌 (S. aureus)等多种水产病原菌均有较好的抑制效果[12-13]。
2023年8月,重庆市荣昌区某养殖场黄颡鱼出现大规模死亡,发病黄颡鱼主要表现为食欲减退,对环境应激减弱,部分病鱼出现鳍条基部充血、眼球突出、腹部膨大、肛门红肿等症状,解剖后发现腹腔内有大量淡黄色腹水。为确定此次黄颡鱼的发病原因,本研究从明显患病鱼的肝脏中分离到一株优势菌株,通过形态学观察、人工感染、生理生化特性和分子生物学等方法对该病原菌进行鉴定,经过人工感染试验、毒力基因检测和组织病理学观察明确菌株毒性,而后开展抗菌药物敏感性试验和中草药抑菌效果试验来筛选抗菌药物,以期为该病的诊断、防治和研究提供科学、全面的参考依据。
1. 材料与方法
1.1 试验材料
自然患病黄颡鱼来自重庆市荣昌区某养殖场,平均体质量为(17.2±3.2) g,体长为(14.7±0.6) cm。健康黄颡鱼购自重庆市永川区某养殖场,平均体质量为(17.5±2.5) g,体长为(15.0±1.2) cm,于水族箱中暂养7 d,持续充氧,水温(26±2) ℃,暂养期间不投饵料,用于人工感染试验。
1.2 主要试剂和仪器
中草药:丁香 (Syzygium aromaticum)、山楂 (Fructuscrataegi)、诃子 (Terminalia chebula)、石榴皮 (Punica granatum)、玫瑰花 (Rosa rugosa)、五倍子 (Galla chinensis)、乌梅 (Prunnus mume)、五味子 (Schisandra chinensis)、夏枯草 (Prunella vulgaris)、虎杖 (Polygonum cuspidatum)、香加皮 (Periploca sepium)、牡丹皮 (Paeonia suffruticosa)、白头翁 (Pulsatilla chinensis)、鸡血藤 (Polygala tenuifolia)、大黄 (Rheum palmatum)、鹿衔草 (Pyrola calliantha)、柴胡 (Bupleurum chinense)、防风 (Saposhnikovia divaricata)、决明子 (Cassia obtusifolia)、黄芩(Sastellaria baicalensis)、女贞子 (Ligustrum lucidum)、白芍 (Angelica dahurica)、当归 (A. sinensis)、独活 (Heracleum hemsleyanum Diels)、龙胆草 (Gentiana scabra)、白芷 (Angelica dahurica)、桑叶 (Folium mori)、何首乌 (Fallopia multiflora)、石斛 (Dendrobium sp.)、陈皮 (Citrus reticulata Blanco)、厚朴 (Magnolia officinalis)、栀子 (Gardenia jasminoides)、肉桂 (Cinnamomum cassia Presl)、苦参 (Sophora flavescens)、艾叶 (Artemisia argyi Levl)、川楝子 (Toosendan fructus)、青蒿 (Artemisia annua)、干姜 (Zingiberis rhizoma)、蒲公英 (Taraxacum mongolicum)、合欢皮 (Albizia julibrissin Durazz)、党参 (Codonopsis pilosula)、茯苓 (Wolfiporia cocos)、重楼 (Paris polyphylla)、板蓝根 (Isatis tinctoria)、地榆 (Sanguisorba officinalis)、葛根 (Radix puerariae)、黄柏 (Cortex phellodendri)、草果 (Amomum tsaoko)、菊花 (Chrysanthemum morifolium)、蛇床子 (Cnidium monnier)、姜黄 (Curcuma longa)、射干 (Belamcanda chinensis)、地肤子 (Kochiae fructus)、紫荆 (Cercis chinensis)、羌活 (Notopterygium incisum)、金银花 (Lonicera japonica)、三七 (Radix notoginseng)、青皮 (Vatica mangachapoi)、玉竹 (Polygonatum odoratum)、鱼腥草 (Houttuynia cordata) 共计60味中草药,均购于重庆市荣昌区某中药店。
试剂:PCR反应试剂、pMD19-T和大肠埃希氏菌DH5α (日本TaKaRa),细菌基因组提取试剂盒 (北京索莱宝科技有限公司),BHI固体培养基 (杭州微生物试剂有限公司),琼脂糖凝胶电泳回收试剂盒 (北京全氏金生物技术有限公司);药敏纸片 (杭州微生物试剂有限公司),抗菌药物 (北京世纪奥科生物技术有限公司)。
仪器:离心机5810R (Eppendorf,德国), PCR仪、凝胶成像系统 (Bio-Rad,美国),微量核酸蛋白测量仪、组织切片机 (Thermo Scientific,美国),电泳仪 (北京六一仪器厂),光学显微镜 (Olympus,日本)。
1.3 病原菌的分离纯化及生化鉴定
选择患病症状典型的黄颡鱼置于超净工作台,酒精棉球擦拭病鱼体表消毒,用接种环从病鱼肝脏、脾脏和肾脏分别取样于BHI固体培养基上进行划线培养,28 ℃培养箱中静置培养48 h,经多次纯化培养后观察菌落形态特征,挑取单个菌落进行革兰氏染色,另挑取单个菌落接种于微量生化管中,28 ℃培养24 h。细菌形态及生化鉴定结果参考《伯杰氏细菌鉴定手册》[14]进行判定。
1.4 16S rRNA、gyrB、cpn60和rpoB基因扩增和测序
用细菌基因组提取试剂盒提取细菌总DNA。PCR反应体系设为50 μL,DNA模板1 μL,10 ×EasyTaq Buffer 5 μL,上、下游引物各1 μL (引物见表1),dNTPs 4 μL,rTaq 0.5 μL,ddH2O补足余量。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,退火30 s,72 ℃延伸1 min,32个循环;72 ℃终延伸10 min;16 ℃保存。PCR产物用1% (w) 琼脂糖凝胶电泳进行检测。将目的片段切胶纯化,连入pMD19-T载体,转化到DH5α,挑选阳性克隆送华大基因进行测序,将测序得到的序列进行Blast比对,用MEGA 11软件构建系统进化树。
表 1 各目的基因的退火温度及片段大小Table 1 Annealing temperature and fragment size of each target gene目的基因
Target DNA引物
Primer退火温度
Annealing temperature/℃片段大小
Fragment size/bp参考文献
Reference16S rRNA 27F: AGAGTTTGATCCTGGCTCAG
1492R: GGTTACCTTGTTACGACTT55.0 1407 [17] gyrB gyrB-F: GAAGTCATCATGACCGTTCTGCA
gyrB-R: AGCAGGGTACGGATGTGCGAGCC61.3 1042 [18] rpoB rpoB-F: GAAAGACCAGGAACGGATCA
rpoB-R: AGGTCGTCACGGTAACAAGG54.1 1003 [19] cpn60 cpn60-R: GAAATTGAACTGGAAGACAA
cpn60-F: GTTGCTTTTTCCAGCTCCA56.0 740 [20] sodB sodB-F: ATGTCATTCGAATTACCTGC
sodB-R: TCGATGTAATAAGCGTGTTCCCA53.0 490 [21] katB katB-F: GATGCGATCAAGTTCCCGGA
katB-R: ACCTGGATGTACAGATCCCAT54.7 377 [15] esrB esrB-F: GATCATGCCTTGCTAGCC
esrB-R: TCGGCGACCAGCTTGAGA53.3 454 [22] gadB gadB-F: ATTCCCGCTTTGGTTCAGA
gadB-R: GGAGGAGCCGATAGTATTGGTA53.5 308 GenBank AY078505 fimA fimA-F: ACAGCCTGGAAGAGTCCTAC
fimA-R: TTGAGAGTCGCTGCTTAC51.8 839 [23] citC citC-F: TTTCCGTTTGTGAATCAGGTC
citC-R: AATGTTTCGGCATAGCGTTG53.0 553 [24] mukF mukF-F: TTTGGACGGTGAAATGAGC
mukF-R: CGTTGCGGTGCCAGTGAA54.0 303 GenBank AY078510 1.5 毒力基因检测
确定病原菌后,根据文献[15-16]获得其毒力基因 (表1),进行PCR检测。PCR反应扩增条件:94 ℃预变性5 min,之后进行32个循环 (94 ℃变性30 s,退火温度见表1,退火30 s,72 ℃ 1 min 20 s),最后72 ℃延伸10 min。
1.6 人工感染试验
将分离出的菌株制成菌悬液,用0.65% (w) 无菌生理盐水将菌悬液的浓度调整为1.0×109、1.0×108、1.0×107、1.0×106、1.0×105 CFU·mL−1备用。健康黄颡鱼于水族箱暂养后,捞取 180 尾随机分成5个试验组和1个对照组,每组30尾。试验组按上述浓度梯度每条鱼腹腔注射0.2 mL菌液,对照组注射等量的0.65% (w) 无菌生理盐水。注射后将各试验组和对照组分别放入同等规格的水族箱内,试验期间平均水温 (25.0±1.5) ℃,每6 h观察1次,连续观察7 d,记录受试鱼的发病和死亡情况,对症状明显的濒死鱼进行细菌的分离、纯化和鉴定。试验结束后参考改良寇氏法[25]计算分离菌株对试验鱼的半数致死量 (LD50)。
1.7 病理组织切片
取自然条件下发病的黄颡鱼肝脏、脾脏、肾脏、肠、胃和鳃组织,用4% (φ) 甲醛溶液固定,按照常规组织切片方法[26],将患病鱼组织进行乙醇梯度脱水、二甲苯透明、石蜡包埋、切片、染色、封片等处理,在显微镜下采集病理图片并观察分析,重复3次。
1.8 抗菌药物敏感性试验及最小抑菌浓度与最小杀菌浓度测定
采用K-B纸片法[27]对分离菌株进行32种抗菌药物敏感性试验。用0.65% (w) 无菌生理盐水调整菌株浓度至1.0×108 CFU·mL−1,吸取100 μL菌液于BHI固体培养基表面并用涂布棒均匀涂布,夹取药敏纸片轻贴于培养基表面。将贴好药敏纸片的培养基放入恒温培养箱中28 ℃培养24 h,用游标卡尺测量并记录抑菌圈直径,根据美国临床试验室标准化协会(CLSI)提供的抗菌药物敏感性试验标准 (CLSI-M100-S19)[28]和杭州微生物试剂有限公司药敏纸片的抑菌圈标准,对分离菌株进行抗耐药性分析。
采用二倍稀释法测定各抗菌药物的最小抑菌浓度 (Minimum inhibitory concentration, MIC)与最小杀菌浓度 (Minimum bactericidal concentration, MBC)[29]。在 2 mL EP管中用LB液体培养基将抗菌药物分别稀释为:128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.063、0.031 μg·mL−1,每个EP管中加入20 μL菌量为1.0×108 CFU·mL−1的菌液设为试验组,不加菌液的EP管为阴性对照。将EP管放在28 ℃、150 r·min−1摇床中,培养24 h后观察是否清澈,若清澈,则无菌生长。在所有无菌生长的试管中,最低药物浓度即为MIC。取50 μL加入抗菌药物后的分离菌培养物接种于BHI固体培养基,于恒温培养箱中28 ℃静置培养24 h,无菌落生长的最小菌浓度即为MBC,同上设阴性和阳性对照组,试验重复3次。
1.9 中草药体外抑菌试验及MIC与MBC测定
中草药体外抑菌试验:用0.65% (w) 无菌生理盐水调整菌量为1.0×108 CFU·mL−1,吸取100 μL菌液于在BHI固体培养基表面并用涂布棒均匀涂布,用打孔器在培养基上打4个孔,每孔直径6 mm,呈正方形排列,其中3个孔加入50 μL同种药液做平行试验,另一孔加入灭菌蒸馏水做对照试验。28 ℃培养24 h后,用游标卡尺测量抑菌圈直径。判断标准参考姚火春[30]的方法:抑菌圈直径在20 mm以上为抑菌效果极强 (++++),15~20 mm为抑菌效果强 (+++),10~15 mm为抑菌效果中等 (++),10 mm以下为抑菌效果弱 (+),无抑菌圈则为无抑菌作用 (−)。
用二倍稀释法测定各药物的MIC和MBC[31]。在2 mL EP管中用LB液体培养基将中草药提取液的质量浓度分别稀释为:1 000、500、250、125、62.5、31.25、15.63、7.81、3.91、1.95、0.98、0.49 mg·mL−1,每个EP管中加入20 μL菌量为1.0×108 CFU·mL−1的菌液设为试验组,不加菌液的EP管为阴性对照。将EP管放在28 ℃、150 r·min−1摇床中,培养24 h后观察是否清澈,若清澈,则无菌生长。在所有无菌生长的试管中,最低药物浓度即为MIC。取50 μL加入中草药液后的分离菌培养物接种于BHI固体培养基,放于恒温培养箱中28 ℃静置培养24 h,无菌落生长的最小菌浓度即为MBC,同上设阴性和阳性对照组,试验重复3次。
2. 结果
2.1 发病症状
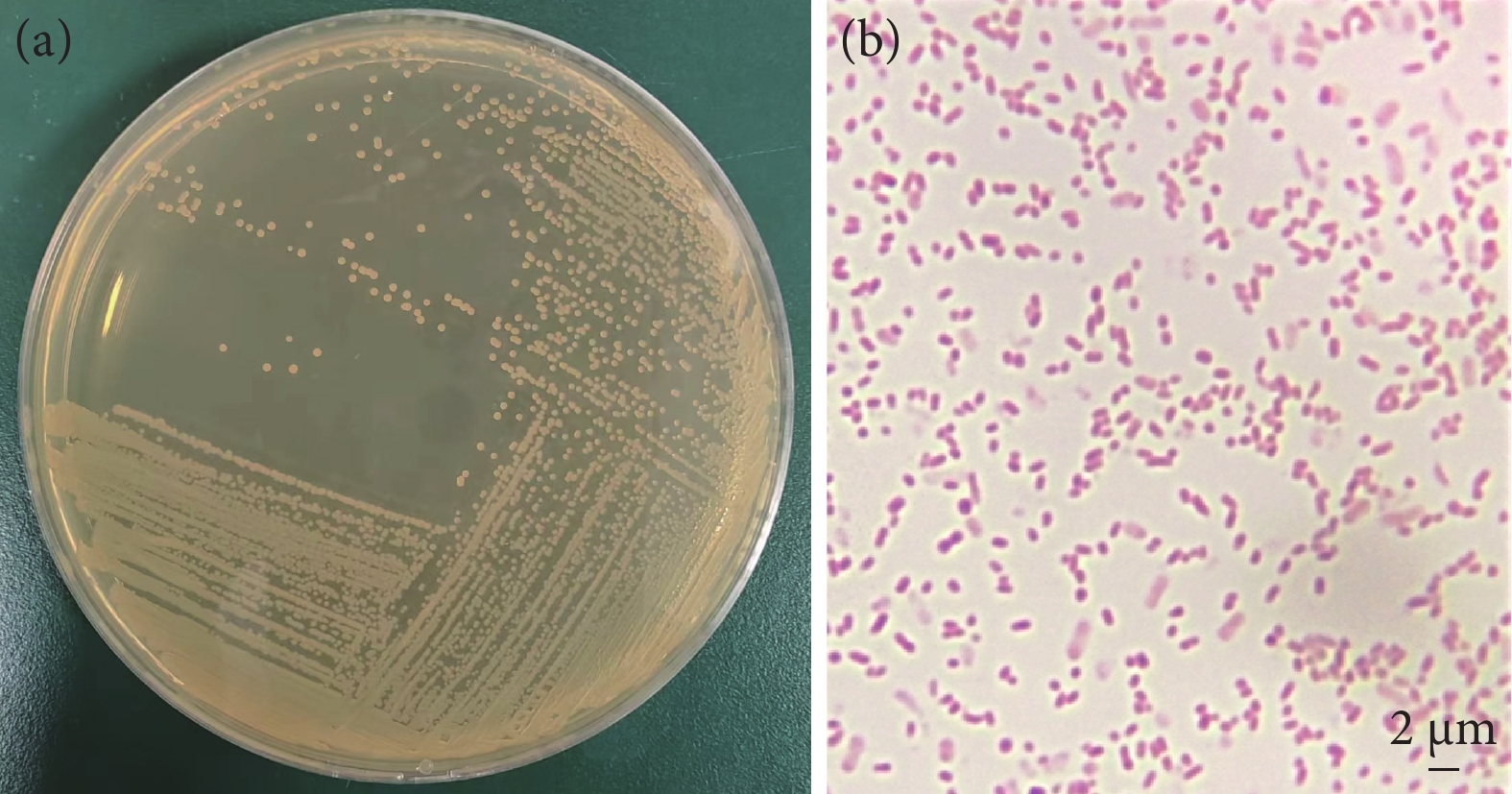
病鱼表现为食欲减退,在塘边离群游动,行动迟缓且对环境应激减弱,在发病后很快出现大面积死亡,死亡率高达20%以上。部分病鱼出现鳍条基部充血、鳍条边缘溃烂,眼球突出,腹部膨大,肛门红肿等症状,解剖后发现腹腔内有大量淡黄色腹水,肝脏、胃均有不同程度的出血,胃、肠内无食物,肝脏周围呈现果冻状 (图1)。
2.2 病原菌形态特征
从患病黄颡鱼肝脏中分离到的一株优势菌株,命名为ET230818。在BHI固体培养基上28 ℃培养48 h,菌落大小为0.4~0.6 mm,呈圆形、半透明、灰白色、表面光滑、扁平。经革兰氏染色镜检表明,菌株为长0.8~2.2 μm、宽0.4~0.7 μm的短杆状菌,不形成芽孢,革兰氏染色呈阴性(图2)。
2.3 病原菌的生化鉴定
生化鉴定结果如表2所示,菌株ET230818生化鉴定结果与《伯杰氏细菌鉴定手册》[13]中迟缓爱德华氏菌的标准菌株基本一致,接触酶反应阳性,可进行硝酸盐还原反应,37 ℃时能利用葡萄糖产气。碳水化合物产酸反应显示,该菌发酵麦芽糖和柠檬酸盐,甲基红反应实验为阳性。蛋白质反应实验显示,该菌能产生硫化氢 (H2S) 和吲哚;有赖氨酸和鸟氨酸脱羧酶存在。结合形态特征与生化鉴定结果可初步判断菌株ET230818为迟缓爱德华氏菌。
表 2 菌株ET230818的生化鉴定Table 2 Biochemical identification of strain ET230818生化项目
Biochemical itemET230818 标准菌株
Standard strain生化项目
Biochemical itemET230818 标准菌株
Standard strain接触酶Contact enzyme + + 蔗糖Sucrose − − 氧化酶Oxidase − − 海藻糖Trehalose − − β-半乳糖苷酶 β-Galactosidase − − 柠檬酸盐Citrate + − 葡萄糖产气 Glucose production + + 葡萄酸盐Gluconate − − KCN试验KCN test − − 丙二酸盐Maltose − − 粘酸盐Clay acid salt − − d-酒石酸盐D-tartrate − − 硝酸盐还原 Nitrate reduction + + M.R (Methyl-Red test) + + 阿东醇Ribitol − − V.P (Voges-Proskauer test) − − 阿拉伯糖Arabinose − − 精氨酸Arginine − − 卫矛醇Galactitol − − 明胶水解Gelatin hydrolysis − − 七叶灵Esculin − − H2S试验 Hydrogen sulfide test + + 木糖Xylose − − 吲哚Indole + + 肌醇Inositol − − 赖氨酸脱羧 Lysine decarboxylation + + 麦芽糖Maltose + + 鸟氨酸脱羧Ornithine decarboxylation + + 甘露醇Mannitol − − 尿素水解Urea hydrolysis − − 柳醇Saligenin − − 谷氨酸Glutamic acid − − 山梨醇Sorbitol − − 苯丙氨酸Phenylalanine − − 2.4 分子鉴定实验结果
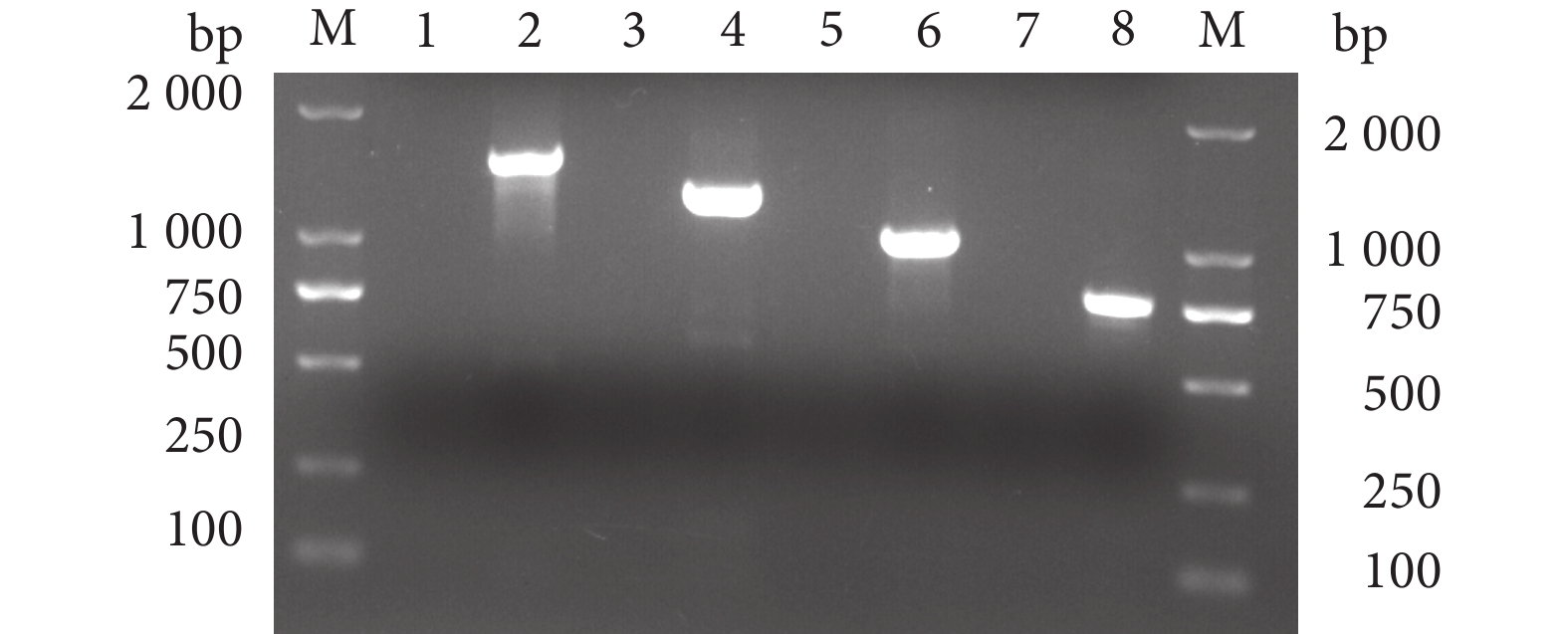
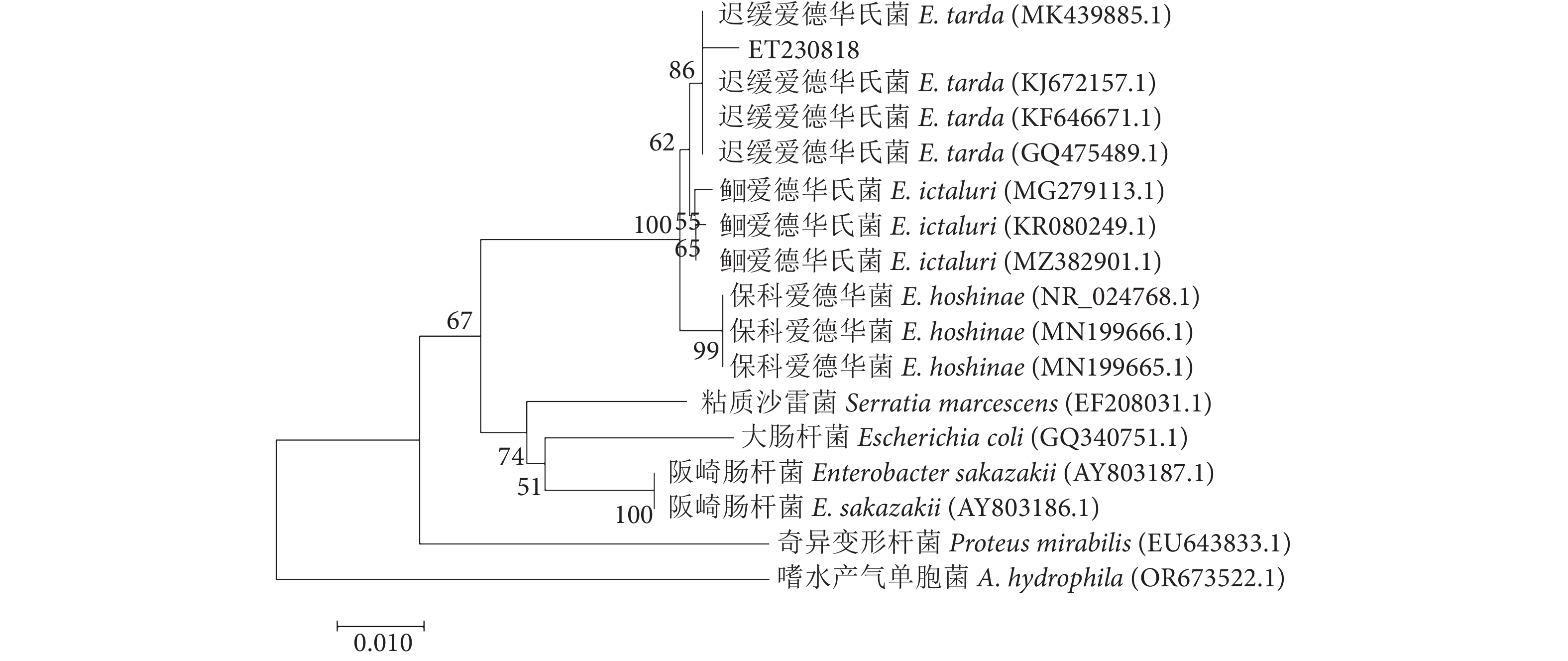
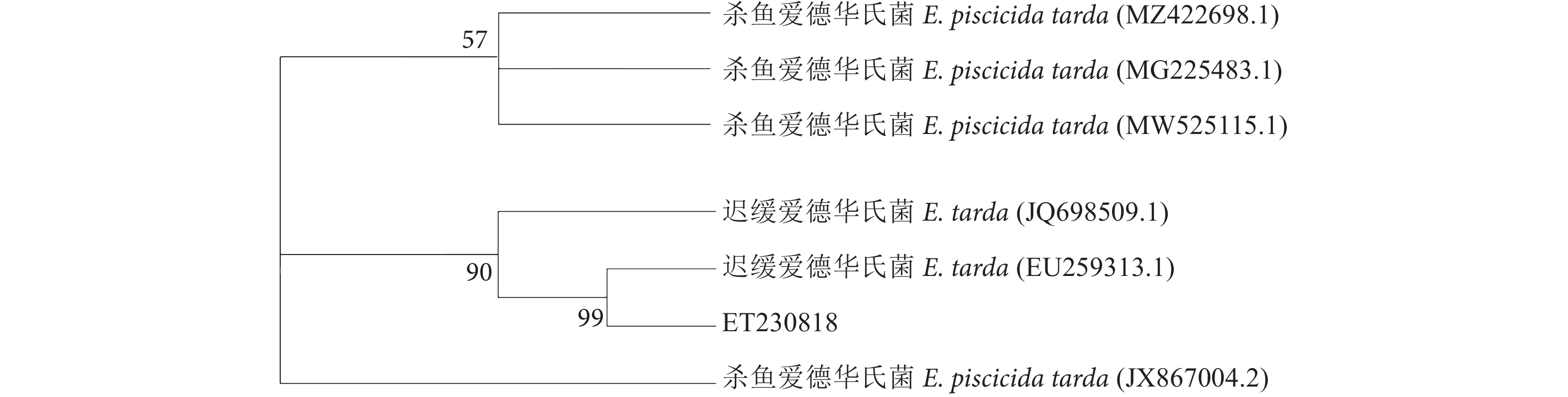
以菌株ET230818的DNA为模板,分别使用16S rRNA、gyrB、rpoB、cpn60基因的通用引物进行PCR扩增。测序分别得到1 407、1 042、1 003、740 bp左右特异性条带 (图3)。将16S rRNA、gyrB、rpoB、cpn60基因序列通过NCBI-Blast进行同源性检索,发现与其同列同源性较高的菌株为迟缓爱德华氏菌,同源性在98%以上,且分离菌株ET230818与已报道的迟缓爱德华氏菌菌株KF64667.1的亲缘关系最近,同源性为99.40%。扩增序列与同源性较高相关菌株16S rRNA、gyrB、rpoB、cpn60基因序列构建系统发育树 (图4、图5),菌株ET230818与迟缓爱德华氏菌聚为一簇。结合形态学特征和生理生化鉴定结果,进一步确定菌株ET230818在分类上属于迟缓爱德华氏菌。
2.5 毒力基因检测结果
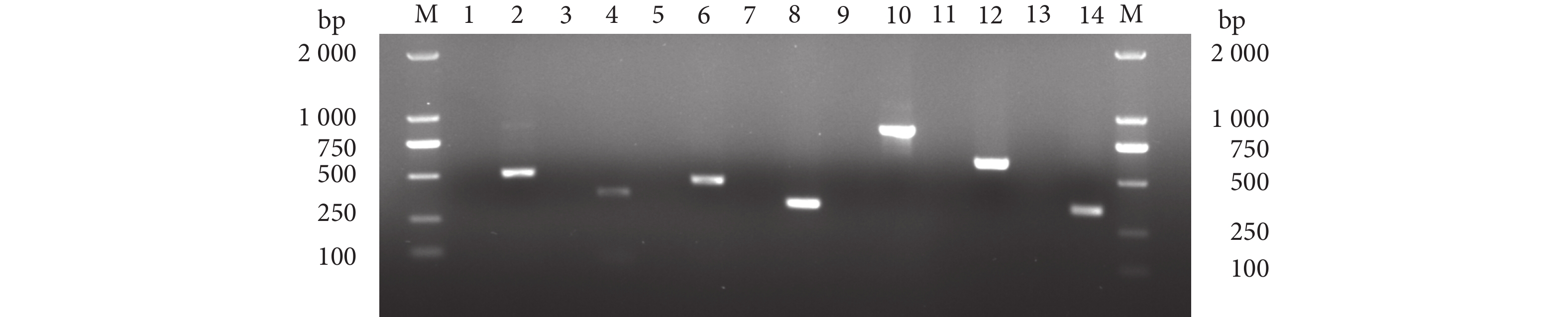
以菌株ET230818的DNA为模板,分别使用sodB、katB、esrB、gadB、fimA、citC和mukF毒力基因的上、下游引物,根据表1中每个毒力基因的退火温度,进行PCR扩增。分别得到大小约500、350、480、300、850、550和300 bp的特异性条带 (图6),与目的片段大小基本一致。扩增的片段经纯化、克隆并测序后,Blast比对发现与迟缓爱德华氏菌的sodB、katB、esrB、gadB、fimA、citC和mukF基因同源性最高,因此判断该菌株携带有上述毒力基因。
![]() 图 6 迟缓爱德华细菌ET230818菌株的毒力基因检测注:M. DL2000 DNA marker;1、3、5、7、9、11和13为对照组;2、4、6、8、10、12、14分别为sodB、katB、esrB、gadB、fimA、citC、mukF。Fig. 6 Virulence gene detection of ET230818 strain of E. tardaNote: M. DL2000 DNA marker; 1, 3, 5, 7, 9, 11 and 13 were control group; 2. sodB; 4. katB; 6. esrB; 8. gadB; 10. fimA; 12. citC; 14. mukF.
图 6 迟缓爱德华细菌ET230818菌株的毒力基因检测注:M. DL2000 DNA marker;1、3、5、7、9、11和13为对照组;2、4、6、8、10、12、14分别为sodB、katB、esrB、gadB、fimA、citC、mukF。Fig. 6 Virulence gene detection of ET230818 strain of E. tardaNote: M. DL2000 DNA marker; 1, 3, 5, 7, 9, 11 and 13 were control group; 2. sodB; 4. katB; 6. esrB; 8. gadB; 10. fimA; 12. citC; 14. mukF.2.6 人工感染试验
人工感染试验结果见表3,1.0×109 CFU·mL−1浓度组的黄颡鱼在2 d内全部死亡;1.0×108、1.0×107、1.0×106 和1.0×105 CFU·mL−1浓度组的黄颡鱼7 d内的死亡率分别为83.3%、66.7%、43.3%和16.7%,试验表明菌株ET230818对黄颡鱼有较强的致病性。人工感染后黄颡鱼表现为游动缓慢,胸鳍基部出现充血症状,体色变暗,肛门红肿,腹部膨大解剖后有淡黄色腹水,与自然发病症状基本一致;注射无菌生理盐水的对照组无死亡现象,外观特征无明显变化,解剖未见病理变化。从感染死亡的黄颡鱼肝脏中再次分离纯化到1株优势菌,经PCR扩增测序鉴定为迟缓爱德华氏菌。根据改良寇氏法[14] 计算得出菌株ET230818对黄颡鱼的半致死浓度为2.51×106 CFU·mL−1。
表 3 菌株ET230818的人工感染试验结果Table 3 Artificial infection test results of strain ET230818菌量
Concentration/
(CFU·mL−1)注射剂量
Injection dose/mL试验数
Number of tests观察时间及死亡数量
Observation time and number of deaths死亡总数
Total deaths/尾累积死亡率
Cumulative
mortality/%1 d 2 d 3 d 4 d 5 d 6 d 7 d 1.0×109 0.2 30 23 7 0 0 0 0 0 30 100 1.0×108 0.2 30 9 11 4 1 0 0 0 25 83.3 1.0×107 0.2 30 0 9 6 3 1 1 0 20 66.7 1.0×106 0.2 30 0 6 3 2 1 1 0 13 43.3 1.0×105 0.2 30 0 0 2 1 1 1 0 5 16.7 0.65% (w) NaCl 0.2 30 0 0 0 0 0 0 0 0 0.0 2.7 组织切片
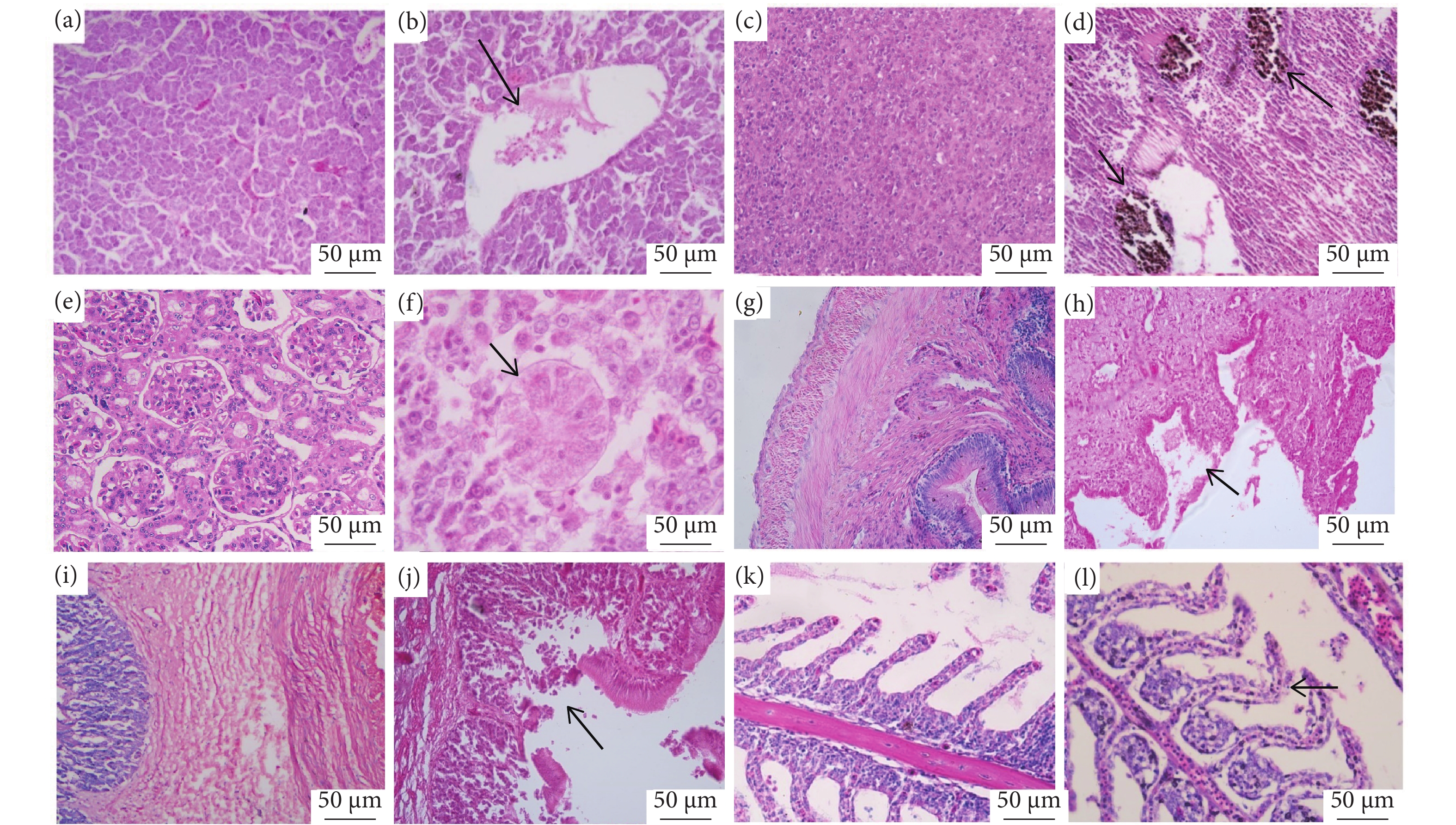
组织病理学观察可见患病黄颡鱼的肝脏、脾脏、肾脏、肠道、胃和鳃均出现了不同程度的病变,其中肝组织中央静脉出现轻微血管管道变形,肝细胞排列杂乱、肿胀,小范围可见肝细胞坏死、破碎解体 (图7-a);脾组织中有大范围的含血铁黄素聚集,部分组织有少量黑色颗粒,实为黑色素巨噬细胞沉积,红髓、白髓出现明显的萎缩变性 (图7-d);肾小管管口收缩变窄,管腔上皮细胞破碎、解散,胞膜界限不清楚,部分肾小管结构松散、萎缩并与间质细胞分离 (图7-f);肠道黏膜细胞排列杂乱、部分细胞坏死脱落 (图7-h);清楚可见胃黏膜破碎,上皮细胞排列紊乱、坏死,并脱落于胃腔当中;肌层细胞坏死、破碎,肌层纤维扭曲呈现空泡状,肌纤维排列紊乱、破碎、坏死 (图7-j);鳃小片明显变性弯折、部分上皮细胞与毛细血管分离,毛细血管中充满血细胞,部分区域鳃小片肿大、细胞脱落坏死;可见鳃小片呼吸上皮细胞增生、细胞水泡肿胀,局部上皮细胞排列紊乱、细胞脱落 (图7-l)。
![]() 图 7 健康黄颡鱼和患病黄颡鱼组织病理学观察注:a. 健康鱼肝脏 (40×);b. 箭头位置患病鱼肝脏中央静脉扩张 (100×);c. 健康鱼脾脏 (40×);d. 箭头位置患病鱼脾脏出现大范围含铁血黄素聚集 (40×);e. 健康鱼肾脏 (100×);f. 箭头位置患病鱼肾小管管腔阻塞 (100×);g. 健康鱼肠 (40×);h. 箭头位置患病鱼肠上皮细胞排列紊乱、坏死、破碎、脱落 (40×);i. 健康鱼胃 (40×);j. 箭头位置患病鱼胃黏膜坏死、破碎、脱落于胃腔中,肌层纤维呈空泡状排列紊乱 (40×);k. 健康鱼鳃 (40×);l. 箭头位置患病鱼鳃小片弯曲,上皮细胞杂乱无序、少量细胞脱落 (40×)。Fig. 7 Histopathological observation of healthy and diseased P. fulvidracoNote : a. Healthy P. fulvidraco liver (40×); b. Dilatation of central liver vein in diseased P. fulvidraco (Arrow) (100×); c. Healthy P. fulvidraco spleen (40×); d. Extensive accumulation of hemosiderin in the spleen of diseased P. fulvidraco (Arrow) (40×); e. Healthy P. fulvidraco kidney(100×); f. Obstruction of renal tubule in diseased P. fulvidraco (Arrow) (100×); g. Healthy P. fulvidraco intestine (40×); h. Intestinal epithelial cells of diseased P. fulvidraco were disordered, necrotic, broken and shed (Arrow) (40×); i. Healthy P. fulvidraco stomach (40×); j. The gastric mucosa of diseased P. fulvidraco was necrotic, broken and detached in the stomach cavity, and the muscular fibers were arranged in a vacuolar pattern (Arrow) (40×); k. Healthy P. fulvidraco gills (40×); l. The gill plates of diseased P. fulvidraco were curved, the epithelial cells were disordered and a few cells fell off (Arrow) (40×).
图 7 健康黄颡鱼和患病黄颡鱼组织病理学观察注:a. 健康鱼肝脏 (40×);b. 箭头位置患病鱼肝脏中央静脉扩张 (100×);c. 健康鱼脾脏 (40×);d. 箭头位置患病鱼脾脏出现大范围含铁血黄素聚集 (40×);e. 健康鱼肾脏 (100×);f. 箭头位置患病鱼肾小管管腔阻塞 (100×);g. 健康鱼肠 (40×);h. 箭头位置患病鱼肠上皮细胞排列紊乱、坏死、破碎、脱落 (40×);i. 健康鱼胃 (40×);j. 箭头位置患病鱼胃黏膜坏死、破碎、脱落于胃腔中,肌层纤维呈空泡状排列紊乱 (40×);k. 健康鱼鳃 (40×);l. 箭头位置患病鱼鳃小片弯曲,上皮细胞杂乱无序、少量细胞脱落 (40×)。Fig. 7 Histopathological observation of healthy and diseased P. fulvidracoNote : a. Healthy P. fulvidraco liver (40×); b. Dilatation of central liver vein in diseased P. fulvidraco (Arrow) (100×); c. Healthy P. fulvidraco spleen (40×); d. Extensive accumulation of hemosiderin in the spleen of diseased P. fulvidraco (Arrow) (40×); e. Healthy P. fulvidraco kidney(100×); f. Obstruction of renal tubule in diseased P. fulvidraco (Arrow) (100×); g. Healthy P. fulvidraco intestine (40×); h. Intestinal epithelial cells of diseased P. fulvidraco were disordered, necrotic, broken and shed (Arrow) (40×); i. Healthy P. fulvidraco stomach (40×); j. The gastric mucosa of diseased P. fulvidraco was necrotic, broken and detached in the stomach cavity, and the muscular fibers were arranged in a vacuolar pattern (Arrow) (40×); k. Healthy P. fulvidraco gills (40×); l. The gill plates of diseased P. fulvidraco were curved, the epithelial cells were disordered and a few cells fell off (Arrow) (40×).2.8 抗菌药物敏感性试验
通过研究菌株 ET230818对32种抗菌药物的耐药性试验结果显示, ET230818对恩诺沙星、多西环素等13种药物高度敏感,对头孢哌酮、头孢氨苄、四环素等8种药物中度敏感,对红霉素、麦迪霉素、头孢他啶等11种药物耐药。根据抗菌药物敏感性试验结果,选取4种抑菌效果较好的抗菌药物进行MIC和 MBC测定。多西环素和恩诺沙星的抑菌和杀菌作用最强,MIC和MBC分别为1 和16 μg·mL−1;利福平次之,MIC和MBC分别为2和32 μg·mL−1 (表4、表5)。
表 4 菌株ET230818的抗菌药物敏感性试验Table 4 Antimicrobial susceptibility test for strain ET230818抗菌药物
Antibacterial drug药物名称
Drug判断标准
Assessment criteria/mm抑菌圈直径
Diameter of inhibition/mm敏感性
SensitivityR M S 大环内酯类
Macrolides group红霉素 ≤13 14~16 ≥23 10.4 R 麦迪霉素 ≤13 14~17 ≥18 0.0 R 利福平 ≤16 17~19 ≥20 22.4 S β-内酰胺类
β-lactam group头孢他啶 ≤14 15~17 ≥18 0.0 R 头孢哌酮 ≤15 16~20 ≥21 17.4 M 氨曲南 ≤15 16~21 ≥22 0.0 R 青霉素 ≤19 20~27 ≥28 8.7 R 头孢氨苄 ≤14 15~17 ≥18 15.0 M 头孢曲松 ≤25 25~26 ≥27 14.5 R 羧苄西林 ≤19 20~22 ≥23 8.1 R 哌拉西林 ≤17 18~20 ≥21 27.8 S 四环素类
Tetracyclines group四环素 ≤14 15~20 ≥21 15.9 M 多西环素 ≤12 13~15 ≥16 28.9 S 米诺环素 ≤14 15~17 ≥18 27.6 S 硝基呋喃类
Nitrofurans group呋喃唑酮 ≤14 15~16 ≥17 16.3 M 呋喃妥因 ≤14 15~16 ≥17 15.9 M 磺胺类
Sulfonamides group复方新诺明 ≤23 24~32 ≥33 0.0 R 磺胺异恶唑 ≤14 15~23 ≥24 8.4 R 氨基糖苷类
Aminoglycosides group庆大霉素 ≤12 13~14 ≥15 24.6 S 妥布霉素 ≤12 13~14 ≥15 22.0 S 新霉素 ≤12 13~16 ≥17 19.1 S 丁胺卡那 ≤14 15~16 ≥17 22.3 S 卡那霉素 ≤13 14~17 ≥18 17.8 S 喹诺酮类
Quinolones group恩诺沙星 ≤12 13~15 ≥16 24.6 S 培氟沙星 ≤23 24~25 ≥26 19.0 M 氧氟沙星 ≤12 13~16 ≥17 21.4 S 环丙沙星 ≤15 16~20 ≥21 16.9 M 吡哌酸 ≤21 22~28 ≥29 13.2 R 左氧氟沙星 ≤13 14~16 ≥17 23.1 S 氯霉素类
Chloromycetins group氯霉素 ≤12 13~17 ≥18 32.1 S 氟苯尼考 ≤12 13~17 ≥18 26.6 S 其他抗菌药物
Other antibacterial drugs杆菌肽 ≤8 9~12 ≥13 0 R 多粘菌素B ≤8 9~11 ≥12 9.4 M 注:R. 耐药;M. 中度敏感;S. 高度敏感。 Note: R. Resistant; M. Moderate sensitive; S. Highly sensitive. 表 5 各抗菌药物对菌株ET230818的最小抑菌浓度和最小杀菌浓度Table 5 MIC and MBC of antibacterial drugs on strain ET230818药物名称
Drug最小抑菌浓度
MIC/(μg·mL−1)最小杀菌浓度
MBC/(μg·mL−1)多西环素Doxycycline 1 16 恩诺沙星Enrofloxacin 1 16 氟苯尼考 Florfenicol 2 32 新霉素Neomycin 32 128 2.9 中草药提取物体外抑菌试验
通过研究60种中草药对菌株ET230818的体外抑菌试验结果显示 (表6),丁香、山楂、诃子、石榴皮、玫瑰花、五倍子具有极强的抑菌效果,抑菌圈直径在20 cm以上;乌梅抑菌效果较强,抑菌圈直径为15~20 cm;五味子、夏枯草、虎杖等10种中草药抑菌效果中等,抑菌圈直径为10~15 cm;防风、决明子、黄芩等10种中草药抑菌效果较弱,抑菌圈直径在10 cm以下;何首乌、石斛、陈皮等34种中草药无抑菌作用。根据中草药药物敏感性结果,选取17种抑菌效果较好的中草药进行MIC和MBC测定;其中,诃子和玫瑰花的抑菌和杀菌作用最强,MIC和MBC均分别为0.98 和1.95 mg·mL−1;丁香次之,MIC和MBC分别为1.95和3.91 mg·mL−1。
表 6 中草药提取液对菌株ET230818的抑菌效果Table 6 Antibacterial effect of Chinese herbal medicines on strain ET230818中草药名称
Chinese herbal medicine抑菌圈直径
Diameter of inhibition/mm抑菌等级
Sensitivity最小抑菌浓度
MIC/(mg·mL−1)最小杀菌浓度
MBC/(mg·mL−1)丁香 Syzygium aromaticum 25.66±0.46 ++++ 1.95 3.91 山楂 Fructuscrataegi 24.35±0.15 ++++ 3.91 3.91 诃子 Terminalia chebula 22.48±0.48 ++++ 0.98 1.95 石榴皮 Punica granatum 22.14±0.30 ++++ 3.91 3.91 玫瑰花 Rosa rugosa 21.78±0.44 ++++ 0.98 1.95 五倍子 Galla chinensis 20.84±0.34 ++++ 7.81 15.63 乌梅 Prunnus mume 18.41±0.11 +++ 15.63 31.25 五味子 Schisandra chinensis 14.68±0.44 ++ 125.00 125.00 夏枯草 Prunella vulgaris 14.58±0.48 ++ >250.00 >250.00 虎杖 Polygonum cuspidatum 13.88±0.26 ++ 250.00 250.00 香加皮 Periploca sepium 13.62±0.44 ++ 125.00 250.00 牡丹皮 Paeonia suffruticosa 13.14±0.08 ++ 125.00 250.00 白头翁 Pulsatilla chinensis 12.79±0.21 ++ 250.00 250.00 鸡血藤 Polygala tenuifolia 12.36±0.24 ++ 125.00 125.00 大黄 Rheum palmatum 12.02±0.38 ++ 62.50 62.50 鹿衔草 Pyrola calliantha 12.01±0.51 ++ 62.50 125.00 柴胡 Bupleurum chinense 11.75±0.23 ++ 125.00 125.00 防风 Saposhnikovia divaricata 9.74±0.24 + 决明子 Cassia obtusifolia 9.57±0.35 + 黄芩 Sastellaria baicalensis 9.53±0.32 + 女贞子 Ligustrum lucidum 9.44±0.18 + 白芍 Angelica dahurica 9.37±0.26 + 当归 Angelica sinensis 9.03±0.21 + 独活 Heracleum hemsleyanum Diels 8.54±0.52 + 龙胆草 Gentiana scabra 8.32±0.64 + 白芷 Angelica dahurica 8.28±0.26 + 桑树叶 Morus alba Linn 7.89±0.10 + 何首乌 Fallopia multiflora 0.00 − 石斛 Dendrobium sp. 0.00 − 陈皮 Citrus reticulata Blanco 0.00 − 厚朴 Magnolia officinalis 0.00 − 栀子 Gardenia jasminoides 0.00 − 肉桂 Cinnamomum cassia Presl 0.00 − 苦参 Sophora flavescens 0.00 − 艾叶 Artemisia argyi Levl 0.00 − 川楝子 Toosendan fructus 0.00 − 青蒿 Artemisia annua 0.00 − 干姜 Zingiberis rhizoma 0.00 − 蒲公英 Taraxacum mongolicum 0.00 − 合欢皮 Albizia julibrissin Durazz. 0.00 − 党参 Codonopsis pilosula 0.00 − 茯苓 Wolfiporia cocos 0.00 − 重楼 Paris polyphylla 0.00 − 板蓝根 Isatis tinctoria 0.00 − 地榆 Sanguisorba officinalis 0.00 − 葛根 Radix Puerariae 0.00 − 黄柏 Cortex Phellodendri 0.00 − 草果 Amomum tsaoko 0.00 − 菊花 Chrysanthemum morifolium 0.00 − 蛇床子 Cnidium Monnier 0.00 − 姜黄 Curcuma longa 0.00 − 射干 Belamcanda chinensis 0.00 − 地肤子 Kochiae fructus 0.00 − 紫荆 Cercis chinensis 0.00 − 羌活 Notopterygium incisum 0.00 − 金银花 Lonicera japonica 0.00 − 三七 Radix Notoginseng 0.00 − 青皮 Vatica mangachapoi 0.00 − 玉竹 Polygonatum odoratum 0.00 − 鱼腥草 Houttuynia cordata 0.00 − 注:++++. 抑菌作用极强;+++. 抑菌作用强;++. 抑菌作用中等;+. 抑菌作用弱;−. 无抑菌作用。 Note: ++++. Very strong antibacterial effect; +++. Strong antibacterial effect; ++. Moderate antibacterial effect; +. Weak antibacterial effect; −. No antibacterial effect. 3. 讨论
3.1 黄颡鱼病原菌分离与鉴定
迟缓爱德华氏菌具有流行范围广、发病率和死亡率高等特点,可引起人的肠胃炎、腹泻、脑膜炎和败血症等疾病[32],该菌在水环境中广泛分布,可导致鱼类、贝类、两栖类、爬行类等多种水生动物发病和死亡,因此由迟缓爱德华氏菌感染引发的水产动物病害在不同国家和地区均有报道[33],给水产养殖行业造成了巨大损失。其中大菱鲆 (Scophthalmus maximus) 和牙鲆 (Paralichthys olivaceus) 感染迟缓爱德华氏菌可表现为体表出血,肝肾溃疡,门直肠脱出体外,腹部鼓胀且有腹水等症状[34-35];中华鳖 (Trionyx sinensis) 感染后会出现底板苍白,肝脏肿胀质脆,胃积水,肠套叠、梗死等[36]。本研究中黄颡鱼感染迟缓爱德华氏菌后肛门红肿,腹部膨大,按压有柔软浮肿感,解剖后发现腹腔内有大量淡黄色腹水,与牙鲆和大菱鲆的感染症状类似。
本研究从自然发病黄颡鱼体内分离、培养并纯化得到一株优势菌株ET230818,通过人工感染试验发现该分离菌株对健康黄颡鱼表现出较强的致病力,且试验组病鱼症状与自然发病鱼的症状相似,对照组无发病现象,表明分离菌株ET230818为该病的病原菌。该菌形态特征和革兰氏染色结果均与迟缓爱德华氏菌基本一致,生化鉴定结果显示菌株可以产生H2S,不能利用某些糖类 (如蔗糖、甘露醇等) 作为能源,但可以发酵麦芽糖和柠檬酸盐,与迟缓爱德华氏菌标准菌株略有不同,这可能与地域分布、宿主来源和气候差异等因素相关,并非种间特异性差异,因此初步判定菌株ET230818为一株迟缓爱德华氏菌。由于16S rRNA基因在细菌进化过程中高度保守,常作为判别细菌的指标,但其对近缘种的分辨率不够,该技术的特异性和灵敏性一直存在争议;而gyrB、rpoB和cpn60管家基因具有更高的多态性,并且对多个管家基因扩增、测序并对扩增序列进行比对分析,具有很高的分辨率,可以准确反映细菌群体的变异进化,使得鉴定结果更具可靠性和准确性[37]。故本研究在16S rRNA序列鉴定的基础上,通过增加gyrB、rpoB和cpn60管家基因对菌株进化地位进行了验证。综合病原菌的形态学特征、生理生化特性以及16S rRNA、gyrB、rpoB和cpn60基因序列分析,判定该分离菌株为迟缓爱德华氏菌。
3.2 迟缓爱德华氏菌的致病性
迟缓爱德华氏菌有致病株与非致病株之分,其中致病株能侵入宿主体内,繁殖、扩散到各器官中,最终导致宿主死亡[38]。在致病株与非致病株中共有14种毒力基因,其中7种毒力基因,即orfA、citC、fimA、gadB、katB、mukF和esrB仅存在于致病株中[39],由于orfA基因的序列未提交,无法设计引物检测外,其他毒力基因均在菌株ET230818中检测出。esrB作为III型分泌系统中的一种重要调节蛋白,担当必需由毒力基因开启的作用,缺失会导致III型分泌系统中EseB、EseC、EseD的分泌量减少,细菌毒力显著下降[22];gadB、katB、esrB基因使迟缓爱德华氏菌能在宿主细胞内存活并超越宿主的防御屏障;fimA基因编码编码蛋白,起到黏附、入侵宿主细胞的功能[40];citC基因具有分解柠檬酸的功能[37];mukF基因则直接起杀伤作用,产生一种铁螯合子的皮下坏死毒素,可直接对细胞起杀伤作用,引起鱼体产生红斑[41]。有学者发现sodB基因参与抵抗宿主补体的作用,也是迟缓爱德华氏菌的毒力基因之一[21]。根据迟缓爱德华氏菌毒力基因功能发现,其毒力基因大多不直接对宿主的某个部位产生伤害,而是通过大量增殖侵蚀宿主,因此通过病理切片显示,患病黄颡鱼肝脏、脾脏、肾脏、肠道、胃和鳃均出现了不同程度的损伤。据韩先朴等[42]报道,爱德华氏菌感染日本鳗鲡 (Anguilla japonica) 患病的症状分为肝脏型和肾脏型,本研究中患病黄颡鱼肝脏损伤最为严重,肝组织中央静脉出现轻微血管管道变形,肝细胞排列杂乱、肿胀,局部可见肝细胞坏死、破碎解体,因此本试验中黄颡鱼属于肝脏型症状。研究显示,水生生物肝脏损伤后,血蛋白的合成功能降低,从而导致血浆胶体渗透压降低,形成腹水[43],这可能是黄颡鱼感染迟缓爱德华氏菌后产生腹水的主要原因。
3.3 迟缓爱德华氏菌的药物敏感性
抗菌药物的敏感性试验中,采用K-B纸片扩散法测定了32种抗菌药物对于菌株ET230818的抑制作用,探究其耐药性。结果表明,分离得到的迟缓爱德华氏菌ET230818菌株对恩诺沙星、多西环素等11种抗菌药物高度敏感,对于红霉素、麦迪霉素、头孢他啶等11种抗菌药物耐药。其中对ET230818有明显抑菌效果的药物中,多西环素、新霉素和恩诺沙星为已批准的水产养殖用兽药,此结果可为黄颡鱼养殖过程中疾病的预防和治疗提供科学依据。本研究结果与其他研究对迟缓爱德华氏菌的药物敏感性结果存在差异[32,36],原因可能是鱼的种类和地理环境不同,导致同种菌的药物敏感性之间存在一定的差异,也可能是由于在治疗鱼病的过程中病原菌对部分抗菌药物产生耐药性导致。虽然抗菌药物的MIC和MBC均低于中草药,但在实际生产过程中,长期或超剂量使用抗菌药物,会存在药物残留、产生耐药性等风险[44]。因此,在选用抗菌药物进行治疗时,首先应参照病原菌的药敏试验结果,再结合《无公害食品渔用药物使用准则》和农业农村部渔业渔政管理局印发的《水产养殖用药明白纸2022年1、2号》等相关规定,选用国家允许、效果佳的抗菌药物进行治疗。
中草药具有抗菌效果好、不易产生耐药性、毒性作用小等优势,为解决细菌耐药性问题提供了新的解决思路[45]。中草药中的抑菌成分较为复杂,其结构类型涉及萜类、生物碱类、黄酮类、有机酸、醌类、多糖类和鞣质等化合物,其有效成分的抗菌作用机理主要通过作用于细胞壁或细胞膜系统,进一步作用于细菌细胞内的酶系统或功能蛋白及遗传物质、遗传微粒结构而起作用[46]。本研究中草药药物体外抑菌效果试验中,丁香、山楂、诃子、石榴皮、玫瑰花、五倍子的抑菌效果最佳,其中,诃子和玫瑰花的抑菌和杀菌作用最强,丁香次之,再次是石榴皮和山楂,但对菌株均具有较强的抑菌效果。现代药理研究显示,诃子属于鞣质类中草药,具有收敛、止血和抗菌等作用[47]。Sato等[48]研究发现,诃子提取物中纯化得到的没食子酸及乙酸乙酯具有很强的抑菌效果。玫瑰花中含有丰富的黄酮类成分,黄酮类成分具有抗菌杀菌、抗病毒、调节免疫等药理作用[49]。Fu等[50]研究发现玫瑰花水煎剂对金黄色葡萄球菌 (Staphylococcus aureus)、伤寒杆菌 (Salmonella typhi)及结核杆菌 (Mycobacterium tuberculosis)均有抑制作用。相关研究[51-53]发现,石榴皮和五倍子对迟缓爱德华氏菌的体外抑杀效果较好,丁香的抑杀效果较差,本研究发现丁香、石榴皮和五倍子对分离得到的迟缓爱德华氏菌ET230818菌株均有较好的抑菌效果,且丁香对ET230818抑杀效果明显优于石榴皮和五倍子,这可能与菌株品种和环境差异有关,也可能是中草药的有效成分含量不同所致。此外,其他研究中未提到的诃子和玫瑰花对迟缓爱德华氏菌的体外抑菌效果更佳,其抑菌效果及机制有待进一步研究。
-
图 6 迟缓爱德华细菌ET230818菌株的毒力基因检测
注:M. DL2000 DNA marker;1、3、5、7、9、11和13为对照组;2、4、6、8、10、12、14分别为sodB、katB、esrB、gadB、fimA、citC、mukF。
Figure 6. Virulence gene detection of ET230818 strain of E. tarda
Note: M. DL2000 DNA marker; 1, 3, 5, 7, 9, 11 and 13 were control group; 2. sodB; 4. katB; 6. esrB; 8. gadB; 10. fimA; 12. citC; 14. mukF.
图 7 健康黄颡鱼和患病黄颡鱼组织病理学观察
注:a. 健康鱼肝脏 (40×);b. 箭头位置患病鱼肝脏中央静脉扩张 (100×);c. 健康鱼脾脏 (40×);d. 箭头位置患病鱼脾脏出现大范围含铁血黄素聚集 (40×);e. 健康鱼肾脏 (100×);f. 箭头位置患病鱼肾小管管腔阻塞 (100×);g. 健康鱼肠 (40×);h. 箭头位置患病鱼肠上皮细胞排列紊乱、坏死、破碎、脱落 (40×);i. 健康鱼胃 (40×);j. 箭头位置患病鱼胃黏膜坏死、破碎、脱落于胃腔中,肌层纤维呈空泡状排列紊乱 (40×);k. 健康鱼鳃 (40×);l. 箭头位置患病鱼鳃小片弯曲,上皮细胞杂乱无序、少量细胞脱落 (40×)。
Figure 7. Histopathological observation of healthy and diseased P. fulvidraco
Note : a. Healthy P. fulvidraco liver (40×); b. Dilatation of central liver vein in diseased P. fulvidraco (Arrow) (100×); c. Healthy P. fulvidraco spleen (40×); d. Extensive accumulation of hemosiderin in the spleen of diseased P. fulvidraco (Arrow) (40×); e. Healthy P. fulvidraco kidney(100×); f. Obstruction of renal tubule in diseased P. fulvidraco (Arrow) (100×); g. Healthy P. fulvidraco intestine (40×); h. Intestinal epithelial cells of diseased P. fulvidraco were disordered, necrotic, broken and shed (Arrow) (40×); i. Healthy P. fulvidraco stomach (40×); j. The gastric mucosa of diseased P. fulvidraco was necrotic, broken and detached in the stomach cavity, and the muscular fibers were arranged in a vacuolar pattern (Arrow) (40×); k. Healthy P. fulvidraco gills (40×); l. The gill plates of diseased P. fulvidraco were curved, the epithelial cells were disordered and a few cells fell off (Arrow) (40×).
表 1 各目的基因的退火温度及片段大小
Table 1 Annealing temperature and fragment size of each target gene
目的基因
Target DNA引物
Primer退火温度
Annealing temperature/℃片段大小
Fragment size/bp参考文献
Reference16S rRNA 27F: AGAGTTTGATCCTGGCTCAG
1492R: GGTTACCTTGTTACGACTT55.0 1407 [17] gyrB gyrB-F: GAAGTCATCATGACCGTTCTGCA
gyrB-R: AGCAGGGTACGGATGTGCGAGCC61.3 1042 [18] rpoB rpoB-F: GAAAGACCAGGAACGGATCA
rpoB-R: AGGTCGTCACGGTAACAAGG54.1 1003 [19] cpn60 cpn60-R: GAAATTGAACTGGAAGACAA
cpn60-F: GTTGCTTTTTCCAGCTCCA56.0 740 [20] sodB sodB-F: ATGTCATTCGAATTACCTGC
sodB-R: TCGATGTAATAAGCGTGTTCCCA53.0 490 [21] katB katB-F: GATGCGATCAAGTTCCCGGA
katB-R: ACCTGGATGTACAGATCCCAT54.7 377 [15] esrB esrB-F: GATCATGCCTTGCTAGCC
esrB-R: TCGGCGACCAGCTTGAGA53.3 454 [22] gadB gadB-F: ATTCCCGCTTTGGTTCAGA
gadB-R: GGAGGAGCCGATAGTATTGGTA53.5 308 GenBank AY078505 fimA fimA-F: ACAGCCTGGAAGAGTCCTAC
fimA-R: TTGAGAGTCGCTGCTTAC51.8 839 [23] citC citC-F: TTTCCGTTTGTGAATCAGGTC
citC-R: AATGTTTCGGCATAGCGTTG53.0 553 [24] mukF mukF-F: TTTGGACGGTGAAATGAGC
mukF-R: CGTTGCGGTGCCAGTGAA54.0 303 GenBank AY078510 表 2 菌株ET230818的生化鉴定
Table 2 Biochemical identification of strain ET230818
生化项目
Biochemical itemET230818 标准菌株
Standard strain生化项目
Biochemical itemET230818 标准菌株
Standard strain接触酶Contact enzyme + + 蔗糖Sucrose − − 氧化酶Oxidase − − 海藻糖Trehalose − − β-半乳糖苷酶 β-Galactosidase − − 柠檬酸盐Citrate + − 葡萄糖产气 Glucose production + + 葡萄酸盐Gluconate − − KCN试验KCN test − − 丙二酸盐Maltose − − 粘酸盐Clay acid salt − − d-酒石酸盐D-tartrate − − 硝酸盐还原 Nitrate reduction + + M.R (Methyl-Red test) + + 阿东醇Ribitol − − V.P (Voges-Proskauer test) − − 阿拉伯糖Arabinose − − 精氨酸Arginine − − 卫矛醇Galactitol − − 明胶水解Gelatin hydrolysis − − 七叶灵Esculin − − H2S试验 Hydrogen sulfide test + + 木糖Xylose − − 吲哚Indole + + 肌醇Inositol − − 赖氨酸脱羧 Lysine decarboxylation + + 麦芽糖Maltose + + 鸟氨酸脱羧Ornithine decarboxylation + + 甘露醇Mannitol − − 尿素水解Urea hydrolysis − − 柳醇Saligenin − − 谷氨酸Glutamic acid − − 山梨醇Sorbitol − − 苯丙氨酸Phenylalanine − − 表 3 菌株ET230818的人工感染试验结果
Table 3 Artificial infection test results of strain ET230818
菌量
Concentration/
(CFU·mL−1)注射剂量
Injection dose/mL试验数
Number of tests观察时间及死亡数量
Observation time and number of deaths死亡总数
Total deaths/尾累积死亡率
Cumulative
mortality/%1 d 2 d 3 d 4 d 5 d 6 d 7 d 1.0×109 0.2 30 23 7 0 0 0 0 0 30 100 1.0×108 0.2 30 9 11 4 1 0 0 0 25 83.3 1.0×107 0.2 30 0 9 6 3 1 1 0 20 66.7 1.0×106 0.2 30 0 6 3 2 1 1 0 13 43.3 1.0×105 0.2 30 0 0 2 1 1 1 0 5 16.7 0.65% (w) NaCl 0.2 30 0 0 0 0 0 0 0 0 0.0 表 4 菌株ET230818的抗菌药物敏感性试验
Table 4 Antimicrobial susceptibility test for strain ET230818
抗菌药物
Antibacterial drug药物名称
Drug判断标准
Assessment criteria/mm抑菌圈直径
Diameter of inhibition/mm敏感性
SensitivityR M S 大环内酯类
Macrolides group红霉素 ≤13 14~16 ≥23 10.4 R 麦迪霉素 ≤13 14~17 ≥18 0.0 R 利福平 ≤16 17~19 ≥20 22.4 S β-内酰胺类
β-lactam group头孢他啶 ≤14 15~17 ≥18 0.0 R 头孢哌酮 ≤15 16~20 ≥21 17.4 M 氨曲南 ≤15 16~21 ≥22 0.0 R 青霉素 ≤19 20~27 ≥28 8.7 R 头孢氨苄 ≤14 15~17 ≥18 15.0 M 头孢曲松 ≤25 25~26 ≥27 14.5 R 羧苄西林 ≤19 20~22 ≥23 8.1 R 哌拉西林 ≤17 18~20 ≥21 27.8 S 四环素类
Tetracyclines group四环素 ≤14 15~20 ≥21 15.9 M 多西环素 ≤12 13~15 ≥16 28.9 S 米诺环素 ≤14 15~17 ≥18 27.6 S 硝基呋喃类
Nitrofurans group呋喃唑酮 ≤14 15~16 ≥17 16.3 M 呋喃妥因 ≤14 15~16 ≥17 15.9 M 磺胺类
Sulfonamides group复方新诺明 ≤23 24~32 ≥33 0.0 R 磺胺异恶唑 ≤14 15~23 ≥24 8.4 R 氨基糖苷类
Aminoglycosides group庆大霉素 ≤12 13~14 ≥15 24.6 S 妥布霉素 ≤12 13~14 ≥15 22.0 S 新霉素 ≤12 13~16 ≥17 19.1 S 丁胺卡那 ≤14 15~16 ≥17 22.3 S 卡那霉素 ≤13 14~17 ≥18 17.8 S 喹诺酮类
Quinolones group恩诺沙星 ≤12 13~15 ≥16 24.6 S 培氟沙星 ≤23 24~25 ≥26 19.0 M 氧氟沙星 ≤12 13~16 ≥17 21.4 S 环丙沙星 ≤15 16~20 ≥21 16.9 M 吡哌酸 ≤21 22~28 ≥29 13.2 R 左氧氟沙星 ≤13 14~16 ≥17 23.1 S 氯霉素类
Chloromycetins group氯霉素 ≤12 13~17 ≥18 32.1 S 氟苯尼考 ≤12 13~17 ≥18 26.6 S 其他抗菌药物
Other antibacterial drugs杆菌肽 ≤8 9~12 ≥13 0 R 多粘菌素B ≤8 9~11 ≥12 9.4 M 注:R. 耐药;M. 中度敏感;S. 高度敏感。 Note: R. Resistant; M. Moderate sensitive; S. Highly sensitive. 表 5 各抗菌药物对菌株ET230818的最小抑菌浓度和最小杀菌浓度
Table 5 MIC and MBC of antibacterial drugs on strain ET230818
药物名称
Drug最小抑菌浓度
MIC/(μg·mL−1)最小杀菌浓度
MBC/(μg·mL−1)多西环素Doxycycline 1 16 恩诺沙星Enrofloxacin 1 16 氟苯尼考 Florfenicol 2 32 新霉素Neomycin 32 128 表 6 中草药提取液对菌株ET230818的抑菌效果
Table 6 Antibacterial effect of Chinese herbal medicines on strain ET230818
中草药名称
Chinese herbal medicine抑菌圈直径
Diameter of inhibition/mm抑菌等级
Sensitivity最小抑菌浓度
MIC/(mg·mL−1)最小杀菌浓度
MBC/(mg·mL−1)丁香 Syzygium aromaticum 25.66±0.46 ++++ 1.95 3.91 山楂 Fructuscrataegi 24.35±0.15 ++++ 3.91 3.91 诃子 Terminalia chebula 22.48±0.48 ++++ 0.98 1.95 石榴皮 Punica granatum 22.14±0.30 ++++ 3.91 3.91 玫瑰花 Rosa rugosa 21.78±0.44 ++++ 0.98 1.95 五倍子 Galla chinensis 20.84±0.34 ++++ 7.81 15.63 乌梅 Prunnus mume 18.41±0.11 +++ 15.63 31.25 五味子 Schisandra chinensis 14.68±0.44 ++ 125.00 125.00 夏枯草 Prunella vulgaris 14.58±0.48 ++ >250.00 >250.00 虎杖 Polygonum cuspidatum 13.88±0.26 ++ 250.00 250.00 香加皮 Periploca sepium 13.62±0.44 ++ 125.00 250.00 牡丹皮 Paeonia suffruticosa 13.14±0.08 ++ 125.00 250.00 白头翁 Pulsatilla chinensis 12.79±0.21 ++ 250.00 250.00 鸡血藤 Polygala tenuifolia 12.36±0.24 ++ 125.00 125.00 大黄 Rheum palmatum 12.02±0.38 ++ 62.50 62.50 鹿衔草 Pyrola calliantha 12.01±0.51 ++ 62.50 125.00 柴胡 Bupleurum chinense 11.75±0.23 ++ 125.00 125.00 防风 Saposhnikovia divaricata 9.74±0.24 + 决明子 Cassia obtusifolia 9.57±0.35 + 黄芩 Sastellaria baicalensis 9.53±0.32 + 女贞子 Ligustrum lucidum 9.44±0.18 + 白芍 Angelica dahurica 9.37±0.26 + 当归 Angelica sinensis 9.03±0.21 + 独活 Heracleum hemsleyanum Diels 8.54±0.52 + 龙胆草 Gentiana scabra 8.32±0.64 + 白芷 Angelica dahurica 8.28±0.26 + 桑树叶 Morus alba Linn 7.89±0.10 + 何首乌 Fallopia multiflora 0.00 − 石斛 Dendrobium sp. 0.00 − 陈皮 Citrus reticulata Blanco 0.00 − 厚朴 Magnolia officinalis 0.00 − 栀子 Gardenia jasminoides 0.00 − 肉桂 Cinnamomum cassia Presl 0.00 − 苦参 Sophora flavescens 0.00 − 艾叶 Artemisia argyi Levl 0.00 − 川楝子 Toosendan fructus 0.00 − 青蒿 Artemisia annua 0.00 − 干姜 Zingiberis rhizoma 0.00 − 蒲公英 Taraxacum mongolicum 0.00 − 合欢皮 Albizia julibrissin Durazz. 0.00 − 党参 Codonopsis pilosula 0.00 − 茯苓 Wolfiporia cocos 0.00 − 重楼 Paris polyphylla 0.00 − 板蓝根 Isatis tinctoria 0.00 − 地榆 Sanguisorba officinalis 0.00 − 葛根 Radix Puerariae 0.00 − 黄柏 Cortex Phellodendri 0.00 − 草果 Amomum tsaoko 0.00 − 菊花 Chrysanthemum morifolium 0.00 − 蛇床子 Cnidium Monnier 0.00 − 姜黄 Curcuma longa 0.00 − 射干 Belamcanda chinensis 0.00 − 地肤子 Kochiae fructus 0.00 − 紫荆 Cercis chinensis 0.00 − 羌活 Notopterygium incisum 0.00 − 金银花 Lonicera japonica 0.00 − 三七 Radix Notoginseng 0.00 − 青皮 Vatica mangachapoi 0.00 − 玉竹 Polygonatum odoratum 0.00 − 鱼腥草 Houttuynia cordata 0.00 − 注:++++. 抑菌作用极强;+++. 抑菌作用强;++. 抑菌作用中等;+. 抑菌作用弱;−. 无抑菌作用。 Note: ++++. Very strong antibacterial effect; +++. Strong antibacterial effect; ++. Moderate antibacterial effect; +. Weak antibacterial effect; −. No antibacterial effect. -
[1] 周勇, 江南, 曾佳, 等. 黄颡鱼腹水征病原菌的分离与鉴定[J]. 中国渔业质量与标准, 2019, 9(1): 18-26. doi: 10.3969/j.issn.2095-1833.2019.01.003 [2] 梁正生, 黄钧, 施金谷, 等. 黄颡鱼腹水病病原菌的分离鉴定及药敏试验[J]. 南方农业学报, 2012, 43(9): 1400-1404. doi: 10.3969/j:issn.2095-1191.2012.09.1400 [3] 韩庆, 马欣欣, 黄春红. 洞庭湖黄颡鱼肌肉营养成分及品质特性分析[J]. 食品安全质量检测学报, 2021, 12(23): 9102-9108. doi: 10.3969/j.issn.2095-0381.2021.23.spaqzljcjs202123018 [4] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 25. [5] 曾佳. 黄颡鱼主要细菌性疾病免疫预防技术的研究[D]. 武汉: 华中农业大学, 2022: 1. [6] 靳洪振, 王玲玲, 吴亚鑫, 等. 一株黄颡鱼源迟缓爱德华氏菌弱毒株的分离鉴定及特性分析[J]. 淡水渔业, 2023, 53(5): 22-31. doi: 10.3969/j.issn.1000-6907.2023.05.003 [7] 邹文政, 余建明, 蔡鸿娇, 等. 迟缓爱德华氏菌感染斑马鱼的模型构建及病理分析[J]. 微生物学报, 2023, 63(12): 4686-4697. [8] SU H, YAKOVLEV I A, van EERDE A, et al. Plant-produced vaccines: future applications in aquaculture[J]. Front Plant Sci, 2021, 12: 718775. doi: 10.3389/fpls.2021.718775
[9] 彭兰丽. 动物源性细菌对四环素类抗生素的耐药性现状[J]. 湖南畜牧兽医, 2021, 43(1): 49-50. doi: 10.3969/j.issn.1006-4907.2021.01.019 [10] HAI N V. The use of medicinal plants as immunostimulants in aquaculture: a review[J]. Aquaculture, 2015, 446: 88-96. doi: 10.1016/j.aquaculture.2015.03.014
[11] WANG E L, CHEN X, WANG K Y, et al. Plant polysaccharides used as immunostimulants enhance innate immune response and disease resistance against Aeromonas hydrophila infection in fish[J]. Fish Shellfish Immun, 2016, 59: 196-202. doi: 10.1016/j.fsi.2016.10.039
[12] HARIKRISHNAN R, BALASUNDARAM C, HEO M S. Impact of plant products on innate and adaptive immune system of cultured finfish and shellfish[J]. Aquaculture, 2011, 317(1): 1-15.
[13] NAFIQOH N, SUKENDA, ZAIRIN M, et al. Antimicrobial properties against Aeromonas hydrophila and immunostimulant effect on Clarias gariepinus of Piper betle, Psidium guajava, and Tithonia diversifolia plants[J]. Aquac Int, 2020, 28(1): 1-13. doi: 10.1007/s10499-019-00439-6
[14] HOLT J G, KRIEG N R, SNEATH P H A. Bergey's manual of determinative bacteriology[M]. 9th ed. Baltimore: Lippincott Williams & Wilkins, 1993: 175-225.
[15] HAN H J, KIM D H, LEE D C, et al. Pathogenicity of Edwardsiella tarda to olive flounder, Paralichthys olivaceus (Temminck & Schlegel)[J]. J Fish Dis, 2006, 29(10): 601-609. doi: 10.1111/j.1365-2761.2006.00754.x
[16] LEUNG K Y, SIAME B A, TENKINK B J, et al. Edwardsiella tarda-virulence mechanisms of an emerging gastroenteritis pathogen[J]. Microbes Infect, 2012, 14(1): 26-34. doi: 10.1016/j.micinf.2011.08.005
[17] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. J Bacteriol, 1991, 173(2): 697-703. doi: 10.1128/jb.173.2.697-703.1991
[18] YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J]. Appl Environ Microbiol, 1995, 61(3): 1104-1109. doi: 10.1128/aem.61.3.1104-1109.1995
[19] PRIDGEON J W, KLESIUS P H, YILDIRIM-AKSOY M. Attempt to develop live attenuated bacterial vaccines by selecting resistance to gossypol, proflavine hemisulfate, novobiocin, or ciprofloxacin[J]. Vaccine, 2013, 31(18): 2222-2230. doi: 10.1016/j.vaccine.2013.03.004
[20] 张超, 莫延敬. 斑点叉尾鮰出血性败血症的病原鉴定及药敏试验[J]. 南方农业学报, 2020, 51(9): 2287-2295. doi: 10.3969/j.issn.2095-1191.2020.09.030 [21] YAMADA Y, WAKABAYASHI H. Identification of fish-pathogenic strains belonging to the genus Edwardsiella by sequence analysis of sodB[J]. Fish Pathol, 1999, 34(3): 145-150. doi: 10.3147/jsfp.34.145
[22] TAN Y P, ZHENG J, TUNG S L, et al. Role of type III secretion in Edwardsiella tarda virulence[J]. Microbiology, 2005, 151(7): 2301-2313. doi: 10.1099/mic.0.28005-0
[23] SAKAI T, YUASA K, SANO M, et al. Identification of Edwardsiella ictaluri and E. tarda by species-specific polymerase chain reaction targeted to the upstream region of the fimbrial gene[J]. J Aquat Anim Health, 2009, 21(2): 124-132. doi: 10.1577/H08-061.1
[24] 江云, 李寿崧, 王寿昆, 等. 致病性迟钝爱德华氏菌毒力基因的PCR检测[J]. 中国食品学报, 2008(4): 123-129. doi: 10.3969/j.issn.1009-7848.2008.04.021 [25] 李翠萍, 吴民耀, 王宏元. 3种半数致死浓度计算方法之比较[J]. 动物医学进展, 2012, 33(9): 89-92. doi: 10.3969/j.issn.1007-5038.2012.09.023 [26] 胡骞, 胡瑞雪, 金玉立, 等. 克氏原螯虾源维氏气单胞菌的分离鉴定及组织病理学观察[J]. 水生生物学报, 2020, 44(4): 811-818. doi: 10.7541/2020.097 [27] RINGERTZ S, OLSSON-LILJEQUIST B, KRONVALL G. Antimicrobial susceptibility testing of Haemophilus influenzae improvement of accuracy of the disc diffusion test[J]. J Antimicrob Chemother, 1990, 26(4): 479-489. doi: 10.1093/jac/26.4.479
[28] MARTÍNEZ R, ROCHA J F, BEJARANO D, et al. Identification of SNPs in growth-related genes in Colombian creole cattle[J]. Genet Mol Res, 2016, 15(3): 1-16.
[29] 董亚萍. 中草药延缓嗜水气单胞菌对恩诺沙星的耐药性及其作用机制的研究[D]. 上海: 上海海洋大学, 2019: 14. [30] 姚火春. 兽医微生物学实验指导[M]. 北京: 中国农业出版社, 2002: 43-45. [31] 刘勃兴, 崔舒畅, 任海, 等. 致半滑舌鳎烂尾病的创伤弧菌的分离鉴定及中草药对其抑菌效果研究[J]. 中国预防兽医学报, 2021, 43(5): 489-494. [32] 吴勇亮, 苗鹏飞, 于辉, 等. 鳜鱼致病性迟缓爱德华氏菌的分离鉴定及药敏试验[J]. 南方农业学报, 2018, 49(4): 794-799. doi: 10.3969/j.issn.2095-1191.2018.04.27 [33] 刘春, 李凯彬, 王庆, 等. 斑马鱼迟缓爱德华氏菌的鉴定、致病性及药物敏感性[J]. 华中农业大学学报, 2013, 32(3): 105-111. doi: 10.3969/j.issn.1000-2421.2013.03.020 [34] 张晓君, 战文斌, 陈翠珍, 等. 牙鲆迟钝爱德华氏菌感染症及其病原的研究[J]. 水生生物学报, 2005, 51(1): 31-37. doi: 10.3321/j.issn:1000-3207.2005.01.006 [35] 于新然, 姚洪, 叶仕根, 等. 养殖大菱鲆感染迟缓爱德华氏菌的分离、毒力基因及ERIC-PCR分析[J]. 大连海洋大学学报, 2018, 33(2): 169-174. [36] 朱凝瑜, 曹飞飞, 郑晓叶, 等. 中华鳖 (Pelodiscus sinensis) 迟缓爱德华氏菌 (Edwardsiella tarda) 的分离鉴定与药物敏感性分析[J]. 中国渔业质量与标准, 2018, 8(4): 65-71. doi: 10.3969/j.issn.2095-1833.2018.04.008 [37] 程俊茗, 万明月, 周晋扬, 等. 鲫源迟缓爱德华氏菌的分离鉴定及其毒力基因的检测[J]. 微生物学通报, 2017, 44(10): 2380-2390. [38] 贾俊涛, 陈吉祥, 卢丽丽, 等. 1株迟钝爱德华氏菌的鉴定及毒力基因的研究[J]. 中国食品学报, 2012, 12(8): 186-190. doi: 10.3969/j.issn.1009-7848.2012.08.027 [39] SRINIVASA R P S, LIM T M, Leung K Y. Functional genomics approach to the identification of virulence genes involved in Edwardsiella tarda pathogenesis[J]. Infect Immun, 2003, 71(3): 1343-1351. doi: 10.1128/IAI.71.3.1343-1351.2003
[40] SAKAI T, KANAI K, OSATOMI K, et al. Identification of a 19.3-kDa protein in MRHA-positive Edwardsiella tarda: putative fimbrial major subunit[J]. FEMS Microbiol Lett, 2003, 226(1): 127-133. doi: 10.1016/S0378-1097(03)00608-6
[41] FENG J, YAMANAKA K, NIKI H, et al. New killing system controlled by two genes located immediately upstream of the mukB gene in Escherichia coil[J]. Mol Gen Genet, 1994, 243: 136-147. doi: 10.1007/BF00280310
[42] 韩先朴, 李伟, 潘金培. 爱德华氏菌人工经口感染及病理观察[J]. 水生生物学报, 1995, 41(3): 245-249. [43] 蔡完其, 孙佩芳, 刘至治. 中华鳖爱德华氏菌病病原和组织病理研究[J]. 水产学报, 1997, 34(4): 428-433. [44] 黄欣桐. 江苏沿海养殖生态环境中主要抗生素残留及耐药基因丰度调查[D]. 武汉: 华中农业大学, 2024: 4-5. [45] 曹雪, 孙佳, 杨质楠, 等. 中草药在水产动物养殖中的研究进展[J]. 饲料研究, 2023, 46(24): 133-137. [46] 陈佳佳, 廖森泰, 孙远明, 等. 中草药抑菌活性成分研究进展[J]. 中药材, 2011, 34(8): 1313-1317. [47] 张媛媛, 刘福雷, 乾康, 等. 正交试验优选诃子中总鞣质提取工艺研究[J]. 江西中医药, 2016, 47(4): 67-70. [48] SATO Y, OKETANI H, SINGYOUCHI K, et al. Extraction and purification of effective antimicrobial constituents of Terminalia chebula RETS against methicillin-resistant Staphylococcus aureus[J]. Biol Pharm Bull, 1997, 20(4): 401-404. doi: 10.1248/bpb.20.401
[49] 乌兰格日乐, 白海泉, 翁慧. 黄酮的抗氧化活性研究进展[J]. 内蒙古民族大学学报 (自然科学版), 2008, 30(3): 277-280. [50] FU M, NG T B, JIANG Y, et al. Compounds from rose (Rosa rugosa) flowers with human immunodeficiency virus type 1 reverse transcriptase inhibitory activity[J]. J Pharm Pharmacol, 2006, 58(9): 1275-1280.
[51] 李瑞, 白东清, 郭永军, 等. 9种中草药及17种组方对迟钝爱德华氏菌的体外抑菌试验[J]. 水利渔业, 2008, 28(4): 114-116. doi: 10.3969/j.issn.1003-1278.2008.04.046 [52] 陈言峰, 邹记兴. 20种中草药对迟缓爱德华氏菌的体外抑菌试验[J]. 水生态学杂志, 2011, 32(5): 110-113. [53] 朱壮春, 史相国, 张淑杰, 等. 中草药对牙鲆病原迟钝爱德华氏菌的体外抑制作用研究[J]. 水产科学, 2007, 27(5): 278-281. doi: 10.3969/j.issn.1003-1111.2007.05.008 -
期刊类型引用(1)
1. 李晓晨. 功能性饲料添加剂在水产养殖中的应用研究进展. 养殖与饲料. 2025(06): 16-20 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
