Effects of marine environment on fecundity characteristics of female argentine shortfin squids
-
摘要:
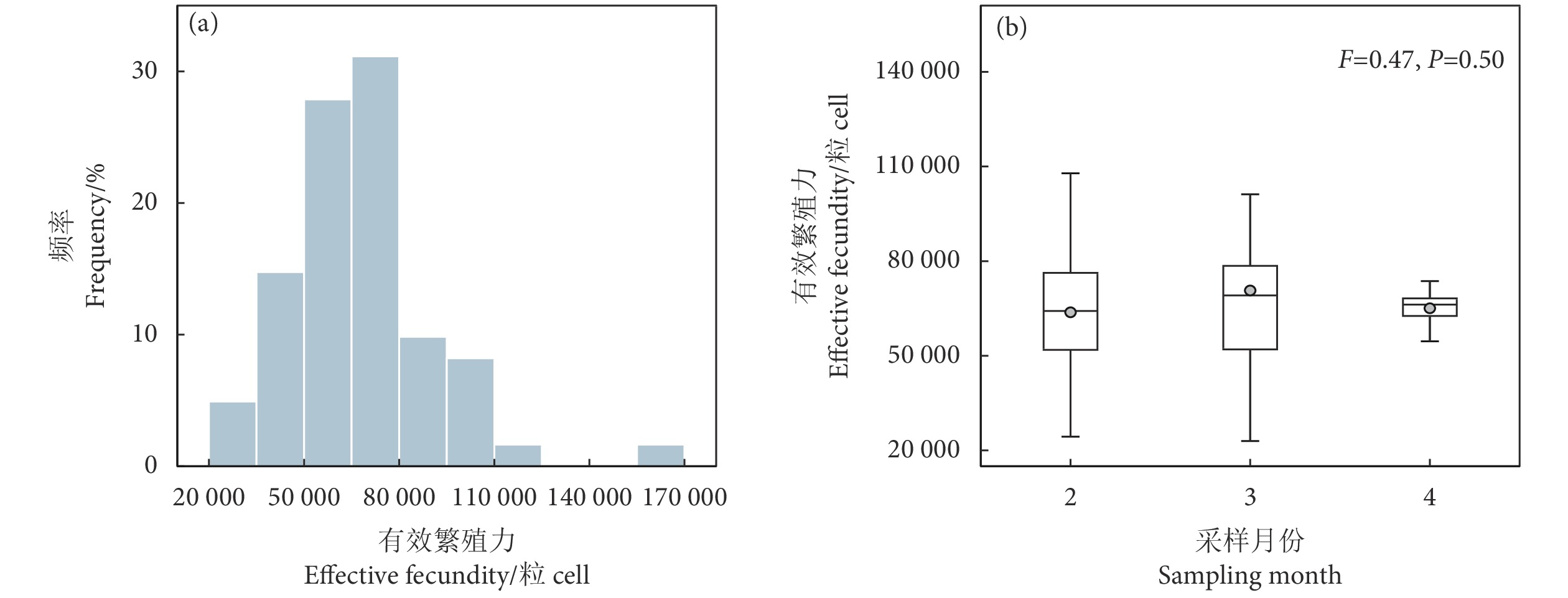
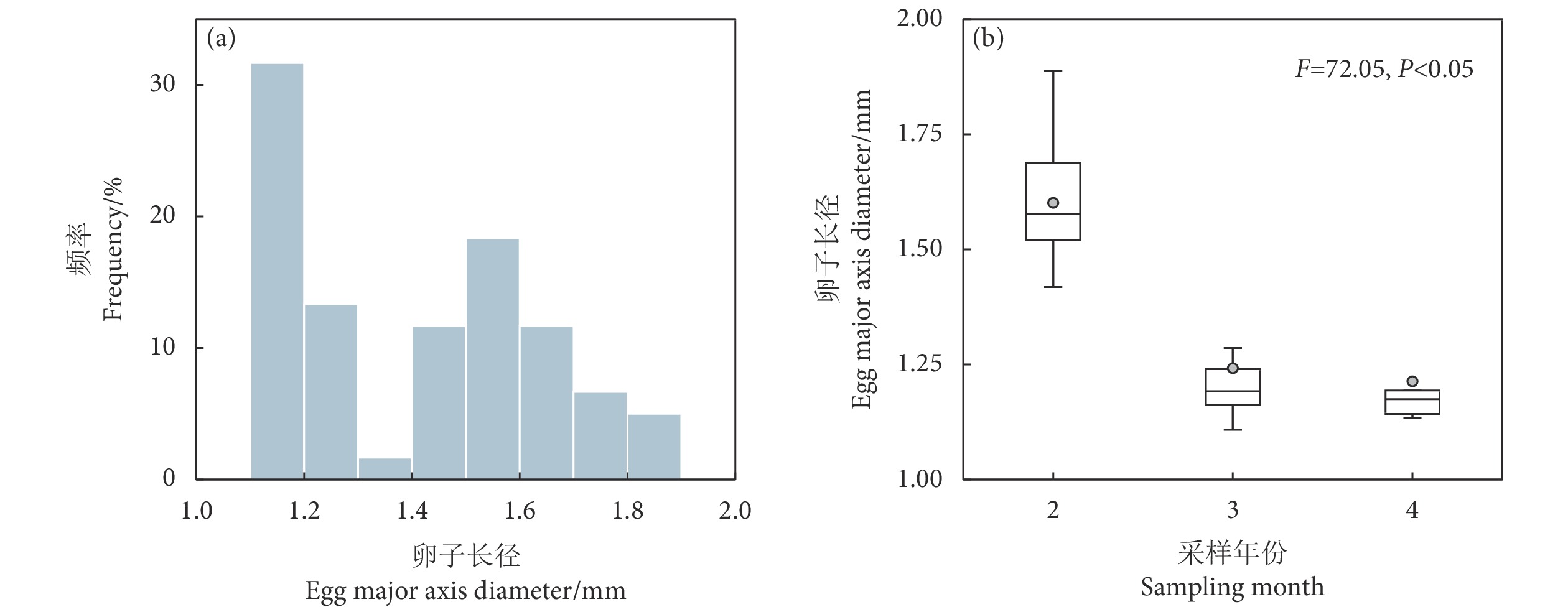
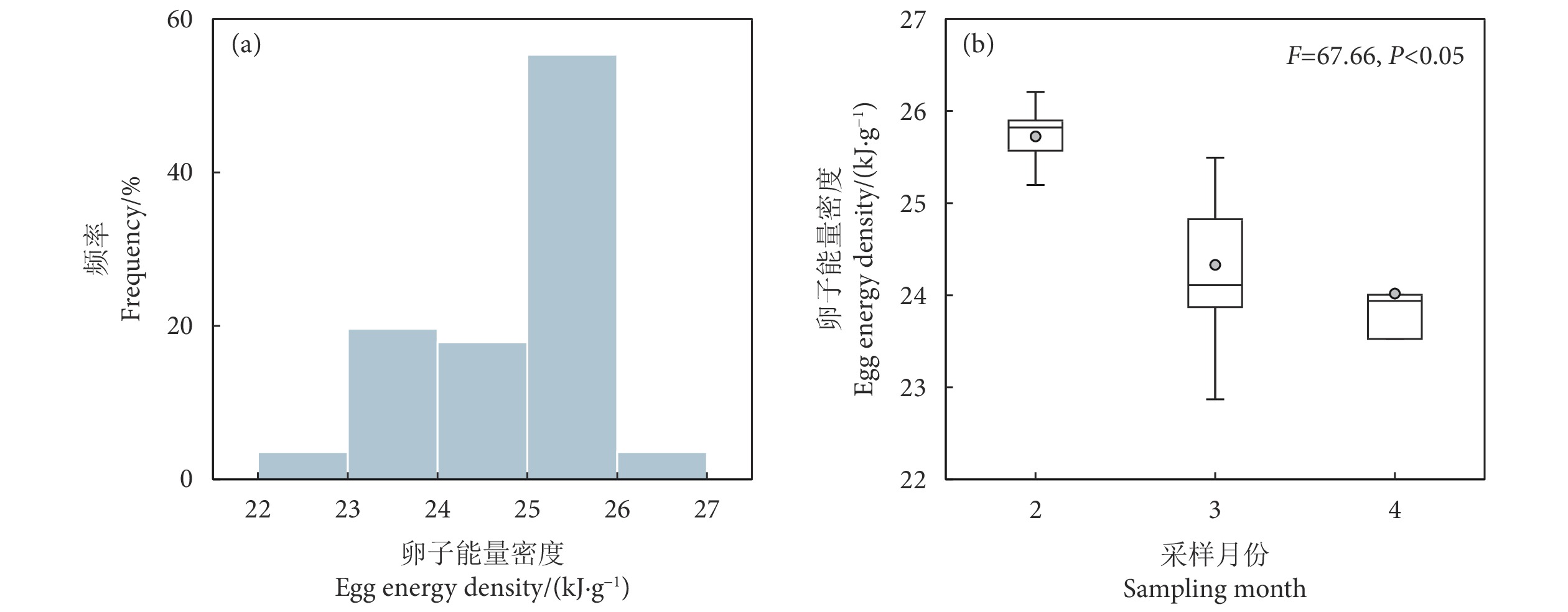
为深入认知阿根廷滑柔鱼 (Illex argentinus) 的繁殖力特性,选取2021年西南大西洋海域的阿根廷滑柔鱼雌性成熟个体样本,利用混合效应模型分析阿根廷滑柔鱼繁殖力特性与栖息海域环境因子之间的关系。结果显示:阿根廷滑柔鱼雌性成熟个体的平均有效繁殖力为 (67 061.72±24 147.00) 粒卵母细胞,成熟卵子最大卵径为1.89 mm、最大能量密度为26.21 kJ·g−1;在不同采样月份,阿根廷滑柔鱼雌性成熟个体的有效繁殖力无显著性差异,而成熟卵子大小及卵子能量密度存在显著的月间差异性;叶绿素a质量浓度是影响有效繁殖力大小的主要环境因子,在质量浓度0.40~0.45 mg·m−3时有效繁殖力达到较大值;海表温度、叶绿素a质量浓度和海平面高度3个环境因子均对输卵管卵子大小、卵子能量密度产生显著性影响。研究表明,栖息海域环境因子对阿根廷滑柔鱼个体的繁殖力、卵子大小及卵子能量密度等繁殖力特性具有显著的效应关系,雌性个体的生殖投入分配是对栖息海域环境选择适应的过程。
Abstract:To obtain a comprehensive understanding of the fecundity characteristics of Argentine shortfin squids (Illex argentinus), we took the mature female individuals of I. argentinus from the southwestern Atlantic Ocean in 2021 as samples, and used a mixed effects model to analyze the relationship between the fecundity characteristics and the environmental factors in their habitat. The results show that the average effective fecundity of mature females was (67 061.72±24 147.00) oocytes, with a maximum egg diameter of 1.89 mm and a peak energy density of 26.21 kJ·g−1. The effective fecundity demonstrated no significant variation across the sampling months, while notable disparities were observed in the oviduct egg size and energy density. The chlorophyll a concentration emerged as a key oceanic determinant influencing the effective fecundity, with the fecundity being comparatively substantial at concentration of 0.40~0.45 mg·m−3. Sea surface temperature, chlorophyll a concentration and sea surface height significantly influenced the oviduct egg size and energy density. The research suggests that environmental factors within the marine habitat have a significant influence on the effective fecundity, oviduct egg size and energy density of female I. argentinus. The allocation of reproductive energy by female squids is an adaptive process in response to environmental selection within their habitat.
-
Keywords:
- Illex argentinus /
- Effective fecundity /
- Egg size /
- Energy density /
- Marine environment
-
奥尼罗非鱼(Oreochromis niloticus♀×O.aureus♂)是一种中小形鱼,为世界水产业重点科研培养的淡水养殖鱼类,被誉为未来动物性蛋白质的主要来源之一,在日本被称为“不需要蛋白质的蛋白源”。罗非鱼肉质细嫩,味道鲜美,富含人体所需的8种必需氨基酸,其中甘氨酸和谷氨酸含量特别高[1-2]。
国内外关于罗非鱼营养方面的研究多集中在通过饲料试验研究营养对罗非鱼生长或生物学特征的影响等方面[3-5],但是对各种养殖模式罗非鱼肉品质的研究少见。笔者研究通过对池塘养殖和水库养殖罗非鱼的肌肉营养成分、感官特性、理化性质和游离氨基酸组成及含量进行分析与比较,探讨养殖模式对罗非鱼肉质的影响规律,为今后罗非鱼的健康、科学和高质养殖提供一定参考依据。
1. 材料与方法
1.1 材料
奥尼罗非鱼由佛山市某淡水养殖场提供,鱼体质量为(1 000±50)g。池塘养殖模式为罗非鱼与鲢(Hypophthalmichthys molitrix)、草鱼(Ctenopharyngodon idella)混养,定期投喂饲料,水深约1.5 m。水库养殖模式为网箱养殖,未投喂饲料,以浮游植物为食,水温常年在18~22 ℃,水深约50 m。
1.2 方法
鲜鱼覆冰保藏,及时送至实验室。取罗非鱼背部肌肉,先进行pH、质构、滴水损失、熟肉率、贮存损失及感官评定分析,剩余样品置于-18 ℃冷冻保存用于其余指标测定。
1.2.1 pH测定[6]
参考DUUN和RUSTAD[7]的方法,并稍加改动。称取碎鱼肉10 g,加入10 mL的0.15 mol·L-1氯化钾(KCl)溶液,用均质器13 000 r·min-1均质30 s,用pH计测定。
1.2.2 常规成分分析
水分测定采用恒温常压干燥法[8];粗蛋白测定采用凯氏定氮法[8];粗脂肪测定采用索氏提取法[8];灰分测定采用常压干燥法[8];总糖测定采用常规分析方法[9]。
1.2.3 肉质感官评定
取罗非鱼背部肌肉切成2 cm×2 cm×1 cm的块状,放入瓷碗里蒸煮8 min,邀请经过专业培训的9人同时参加品尝,采用“盲法”对罗非鱼的鲜味、口感、嫩度进行打分[10],以1~5之间的分值表示(表 1)。3项评分之和为该样品的可接受度值。
表 1 罗非鱼感官评定标准Table 1. Sensory evaluation standard for tilapia muscle指标 index 1分 2分 3分 4分 5分 鲜味 umami 滋味差,无鲜甜味 滋味较差,略带鲜甜味 滋味一般,有鲜甜味 滋味较好,鲜甜味较浓 滋味佳,鲜味浓 口感 mouthfeel 无弹性,口感差 略带弹性,口感较差 有弹性,口感一般 弹性较好,口感较好 弹性好,口感好 嫩度 tenderness 组织浮软 组织较松软 组织有一定弹性 嫩度较好 嫩度适中 1.2.4 熟肉率、蒸煮损失的测定[11]
取背部肌肉,切成1 cm×1 cm×1 cm的块状,放在蒸格上用沸水蒸8 min,取出后晾15 min,称质量并计算。
$$ {\rm{熟肉率}}(\% ){\rm{ = }}\frac{{\rm{蒸煮后肉样质量}}}{{\rm{蒸煮前肉样质量}}} \times {\rm{100}} $$ $$ \text { 蒸煮损失(%) = } 100 \text { - 熟肉率 } $$ 1.2.5 滴水损失[11]
取背肌切成3 cm×1 cm×1 cm小块,称质量后置于充气的塑料袋中(使肉块悬于中心不接触薄膜),在4 ℃冰箱中吊挂48 h后称质量,以样品质量损失百分比表示滴水损失。
$$ \text { 滴水损失 }(\%)=\frac{\text { 贮前质量 }- \text { 贮后质量 }}{\text { 贮前质量 }} \times 100 $$ 1.2.6 贮存损失测定
取背肌切成3 cm×1 cm×1 cm小块,装袋,在4 ℃冰箱中吊挂24 h后称质量并计算。
$$ \text { 贮存损失 }(\%)=\frac{\text { 贮前质量 }- \text { 贮后质量 }}{\text { 贮前质量 }} \times 100 $$ 1.2.7 肌内脂肪测定
参照郭焱芳[11]方法测定。取肉样绞成肉糜,取10 g置于广口瓶中,加入甲醇60 mL并盖好瓶盖,置于磁力搅拌器上搅拌30 min,加入三氯甲烷90 mL搅拌30 min,静置36 h。将浸提液过滤于刻度分液漏斗中,用约50 mL三氯甲烷分次洗涤残渣;加入30 mL蒸馏水,旋摇后静置待分层,上层为甲醇层,下层为三氯甲烷脂肪层,记录下层体积后缓慢打开分液漏斗弃去约2 mL后再缓慢放出下层液体于烧杯中,取4个已经干燥至恒质量的烧杯,用移液管移出50.00 mL下层液体于烧杯中烘干冷却,称质量并记录。
$$ \text { 肌内脂肪质量分数 }(\%)=\frac{\left(W_2-W_1\right) \times V_1}{W_0 \times 50} \times 100 $$ 其中W0为肉样质量(g);W1为烧杯质量(g);W2为烘干后烧杯和脂肪质量之和(g);V1为下层液体总体积(mL);50为下层液体取样量(mL)。
1.2.8 肌原纤维断裂指数(MFI)
测定参照雒莎莎等[12]和陆海霞[13]的方法并稍作修改。取2 g鱼肉加6倍体积的0.1 mol·L-1 KCl、0.02 mol·L-1三羟甲基氨基甲烷(Tris)-盐酸(HCl)(pH=7.5)缓冲液(A)和2倍体积的1% Triton、0.1 mol·L-1 KCl、0.02 mol·L-1 Tris-HCl缓冲液(B),匀浆,纱布过滤,去结缔组织,8 000 r·min-1冷冻离心10 min,去上清,沉淀用8倍体积的A液离心3次,最后用A液清洗沉淀稀释至20 mL,待测。将肌原纤维悬浮液蛋白质量浓度调整为(0.5±0.05)mg·mL-1,立即取10 mL在540 nm下测吸光度(OD),记为OD540 nm。
$$ \mathrm{MFI}=\mathrm{OD}_{540 \mathrm{~nm}} \times 200 $$ 1.2.9 肌红蛋白总量的测定
参照KRZYWICKI[14]方法,具体试验步骤见马汉军等[15]的方法。
1.2.10 游离氨基酸的测定
使用高效液相色谱仪进行分析[16]。
1.3 数据处理
所有数据采用统计软件SPSS 16.0进行分析处理。
2. 结果与分析
2.1 常规营养成分
2种模式养殖的罗非鱼肉粗脂肪、粗灰分质量分数分别为1.48%、0.74%,池塘养殖的总糖质量分数稍高于水库养殖,但两者均无显著差异(P>0.05)(表 2)。水库养殖的水分质量为湿质量的80.22%,显著高于池塘养殖的77.04%(P<0.05)。这是由于鱼体的水分质量分数和脂肪质量分数互成反比,水库养殖的粗蛋白质量分数(16.65%)和粗脂肪质量分数(1.37%)都低于池塘养殖(分别为18.82%和1.59%),故其水分质量分数相对较高。
表 2 罗非鱼肉常规营养成分比较(X±SD,n=3)Table 2. Nutritional components in muscle of different tilapia% 营养成分
nutritive composition池塘养殖
pond culture水库养殖
reservoir culture水分 moisture 77.04±0.08b 80.22±0.09a 粗蛋白 crude protein 18.82±0.12a 16.65±0.08b 粗脂肪 crude fat 1.59±0.24 1.37±0.15 粗灰分 crude ash 0.72±0.02 0.75±0.02 总糖 total sugar 0.12±0.06 0.06±0.02 注:同行不同字母表示差异显著(P<0.05),后表同此
Note:Means in the same row with different letter are significantly different (P<0.05), the same case in the following tables.2.2 感官评定
2种养殖模式罗非鱼肉的鲜味和口感值较接近,没有显著差异(P>0.05)(表 3)。水库养殖的嫩度和可接受度分别为4.87和14.30,显著高于池塘养殖的4.53和13.47(P<0.05)。
表 3 罗非鱼的感官评价分析(X±SD,n=9)Table 3. Muscle sensory evaluation of the different tilapia评定项目
assessment program池塘养殖
pond culture水库养殖
reservoir culture鲜味 umami 4.50±0.17 4.73±0.12 口感 mouthfeel 4.43±0.15 4.70±0.10 嫩度 tenderness 4.53±0.12b 4.87±0.12a 可接受度 acceptence 13.47±0.42b 14.30±0.26a 2.3 理化特性
表 4为不同养殖模式下罗非鱼肉质各项理化指标。2种养殖模式的熟肉率和蒸煮损失平均值分别为81.49%和18.51%,无显著差异(P>0.05)。池塘养殖的pH显著低于水库养殖(P<0.05);与池塘养殖相比,水库养殖的滴水损失和贮存损失分别高出1.85%和0.69%,差异显著(P<0.05);水库养殖的肌内脂肪比池塘养殖的高0.35%,差异显著(P<0.05);池塘养殖的MFI比水库养殖高38,差异显著(P<0.05)。肌红蛋白质量分数平均值为22.22 mg·kg-1,两者不存在显著差异(P>0.05)。
表 4 罗非鱼肉理化特性比较(X±SD,n=3)Table 4. Physi-chemical characters comparison of the different tilapia理化指标
physi-chemical index池塘养殖
pond culture水库养殖
reservoir culturepH 6.28±0.06b 6.43±0.09a 熟肉率/% rate of cooked meat 82.00±0.98 80.97±0.50 蒸煮损失/% cooking loss 18.00±0.98 19.03±0.50 滴水损失/% drip loss 7.75±0.41b 9.60±0.36a 贮存损失/% storage loss 3.20±0.34b 3.89±0.19a 肌内脂肪/% intramuscular fat 0.51±0.16b 0.86±0.19a 肌纤维断裂指数 myofibrillar fragmentation index(MFI) 161±4.58a 123±22.07b 肌红蛋白/mg·kg-1 myoglobin 20.25±0.69 24.19±2.58 2.4 氨基酸质量分数的分析
从罗非鱼肌肉中检测并鉴定了18种常见的氨基酸(表 5)。其中包括8种必需氨基酸,2种半必需氨基酸和8种非必需氨基酸。比较2种模式中各氨基酸的平均值发现,甘氨酸的质量分数均为最高,分别占其总氨基酸的46.40%(池塘养殖)和55.49%(水库养殖),池塘养殖模式中质量分数次之的是丙氨酸、苏氨酸、丝氨酸,水库养殖模式中质量分数次之的是苏氨酸、组氨酸、谷氨酸。两者间的天冬氨酸、谷氨酸、丝氨酸、甘氨酸、丙氨酸质量分数有显著差异(P<0.05),除此之外其他氨基酸不存在显著差异(P>0.05)。
表 5 罗非鱼肉中主要游离氨基酸组成及质量分数(湿质量)(X±SD,n=3)Table 5. Muscle main free amino acids contents of the different tilapia(wet weight)μg·g-1 游离氨基酸
free amino acid池塘养殖
pond culture水库养殖
reservoir culture天冬氨酸ae Asp 61.74±3.09a 11.73±3.88b 谷氨酸ae Glu 97.06±0.72a 82.73±2.94b 鲜味氨基酸总量(∑UAA) total umami amino acids 158.80±2.87a 94.46±5.96b 丝氨酸be Ser 120.23±5.51a 66.61±4.10b 甘氨酸be Gly 1 194.12±25.19a 1 189.80±16.91b 苏氨酸bc Thr 126.57±12.05 103.46±15.62 丙氨酸be Ala 347.81±18.67a 22.19±9.38b 脯氨酸be Pro 48.41±7.13 63.22±23.32 甜味氨基酸总量(∑SAA) total sweet amino acids 1 837.13±54.55a 1 445.29±58.54b 组氨酸d His 115.21±6.91 100.32±9.58 精氨酸d Arg 59.34±10.56 56.45±17.05 酪氨酸e Tyr 43.53±20.87 35.21±11.21 蛋氨酸c Met 41.85±8.76 34.10±8.41 色氨酸c Trp 43.73±9.58 79.72±26.10 苯丙氨酸c Phe 41.38±2.32 41.15±4.93 异亮氨酸c Ile 26.65±1.16 18.68±4.78 亮氨酸c Leu 47.31±3.05 42.80±7.02 赖氨酸c Lys 68.28±1.19 81.07±4.61 缬氨酸c Val 44.47±7.48 39.99±15.73 半胱氨酸e Cys 45.73±22.56 74.82±41.76 氨基酸总量(∑AA) total amino acids 2 573.41±104.36 2 144.05±99.19 必需氨基酸总量(∑EAA) total essential amino acids 440.24±15.61 440.97±25.31 半必需氨基酸总量(∑HEAA) total half-essential amino acids 174.54±17.28 156.76±26.04 ∑UAA/∑AA/% 6.17 4.41 ∑SAA/∑AA/% 71.39 67.41 ∑EAA/∑AA/% 17.11 20.57 ∑HEAA/∑AA/% 6.78 7.31 注:a.鲜味氨基酸;b.甜味氨基酸;c.必需氨基酸;d.半必需氨基酸;e.非必需氨基酸
Note:a. umami amino acids;b. sweet amino acids;c. essential amino acids;d. half-essential amino acids;e. not essential amino acids罗非鱼的鲜美程度取决于其蛋白质中鲜味氨基酸的组成和质量分数,天冬氨酸和谷氨酸为呈鲜味的特征氨基酸,其中谷氨酸的鲜味更强。谷氨酸不仅是呈鲜味氨基酸,还在人体代谢中具有重要意义,是脑组织生化代谢中首要的氨基酸,参与多种生理活性物质的合成,具有健脑作用[17]。在2种模式中,谷氨酸质量分数(μg·g-1,湿基)分别为97.06(池塘养殖)和82.73(水库养殖)。2种养殖模式的鲜味氨基酸总量(μg·g-1,湿基)分别为158.80(池塘养殖)和94.46(水库养殖),两者差异显著(P<0.05)。甜味氨基酸总量(μg·g-1,湿基)分别为1 837.13(池塘养殖)和1 445.29(水库养殖),分别占总氨基酸的71.39%(池塘养殖)和67.41%(水库养殖),前者明显高于后者(P<0.05)。必需氨基酸总量(μg·g-1,湿基)分别为440.24(池塘养殖)和440.97(水库养殖),两者相近(P>0.05)。组氨酸和精氨酸为半必需氨基酸,其总量(μg·g-1,湿基)分别为174.54(池塘养殖)和156.76(水库养殖)。精氨酸在人体饥饿、创伤或应激条件下会转变为必需氨基酸。
3. 讨论
1) 肌肉营养成分是评价养殖模式肌肉品质的重要指标。池塘养殖罗非鱼的粗蛋白质量分数较水库养殖的高,这可能与投喂的饲料有关。有关研究表明[18],饲料蛋白质量分数越高,鱼体内的粗蛋白质量分数也越高。从试验结果看出,池塘养殖饲料供给及时,营养充足,则鱼体的粗蛋白和粗脂肪质量分数相对较高。在粗灰分和总糖质量分数上,两者相差不大,说明罗非鱼肌肉粗灰分和总糖质量分数受其养殖环境的影响较小。
2) 一般认为,肉品风味随肌内脂肪的增加而改善。BEJERHOLM和BARTON-GADE[19]发现随着肌内脂肪质量分数的增加,嫩度也相应改善。笔者试验中水库养殖罗非鱼的肌内脂肪质量分数高于池塘养殖,与感官评定中的嫩度评分一致,同时,水库养殖的肌原纤维断裂指数比池塘养殖小,即水库养殖的嫩度较好,这3个指标的检测结果是一致的,因此可推测这三者之间存在着一定相关性。同时,pH是反映鱼体死后肌糖原酵解速率的重要指标,pH越低,说明酵解速度越快,pH缓慢降低可保持肉的嫩度。水库养殖的pH显著高于池塘养殖,即水库养殖的嫩度优于池塘养殖,这与前面的3个指标检测结果一致。
3) 滴水损失和持水力能够反映肉类保持其原有水分的能力。滴水损失与肌肉持水力呈负相关,滴水损失越低,肌肉持水力越好,鱼体死后失重小。从试验结果可知,水库养殖的滴水损失和贮存损失都比池塘养殖的高,说明池塘养殖的持水力高于水库养殖。熟肉率是衡量烹调损失的指标,具有重要的经济意义。试验结果表明池塘养殖的熟肉率高于水库养殖。
4) 从对罗非鱼肌肉的品质分析可以看出,尽管属于同一鱼种,但是不同养殖模式的罗非鱼在品质方面存在着一定的差别。有研究表明,鱼类肌肉品质的遗传变异很低[20],所以遗传变异的可能性不大。食物营养价值可以用多项指标来评价,蛋白质为重要的指标之一,尤其是氨基酸的组成及含量。这2种模式罗非鱼的蛋白质质量分数差异显著,其某些游离氨基酸的质量分数也存在显著差异。池塘养殖罗非鱼肌肉中谷氨酸的质量分数明显高于水库养殖,谷氨酸作为一种鲜味氨基酸,在脑组织生化代谢中具有重要作用,参与多种活性物质的合成。池塘养殖的呈味(鲜味和甜味)氨基酸质量分数都高于水库养殖,必需氨基酸总量虽相近,但氨基酸总量和半必需氨基酸总量均高于水库养殖。有研究表明,水产动物肌肉氨基酸组成与含量的不同,除了受到遗传因素的影响外,还与动物自身的生长发育、栖息环境、饵料种类与组成等密切相关[21-22]。此次采集的池塘养殖样品在养殖过程中定期投喂了饲料,而水库养殖样品主要以浮游植物为食,加上栖息环境的不同,因此造成了两者的差异。
从总体上看,水库养殖的罗非鱼嫩度要优于池塘养殖,但在营养成分及鲜甜味方面不及池塘养殖。
-
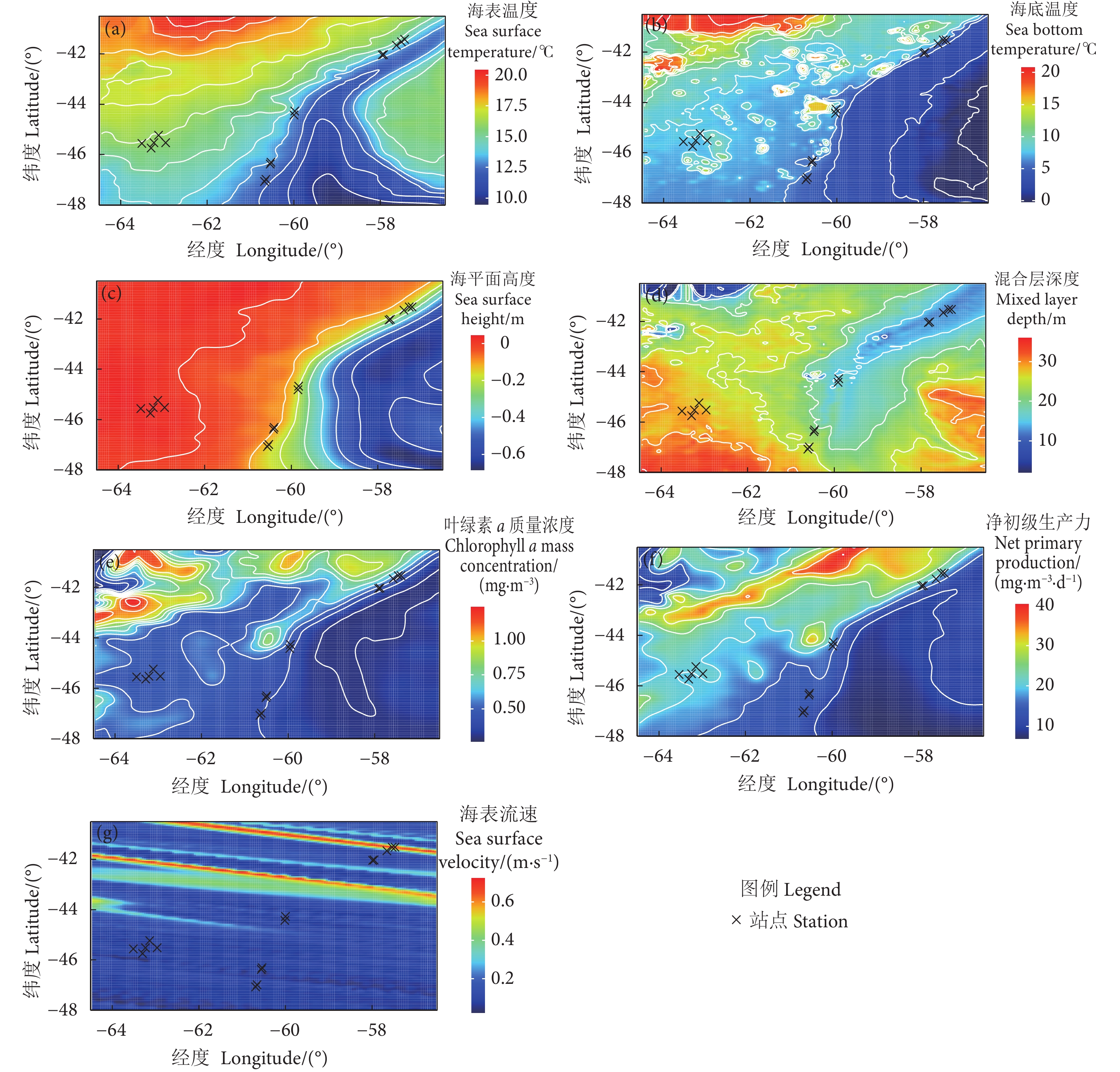
表 1 阿根廷滑柔鱼采样站点海洋环境因子与采样站点线性混合效应模型分析结果
Table 1 LMM fitting results of oceanic variables and sampling stations for I. argentinus
环境因子
Oceanic variable随机效应 Random effect 固定效应 Fixed effect 采样月份
Sampling month残差
Residual采样站点
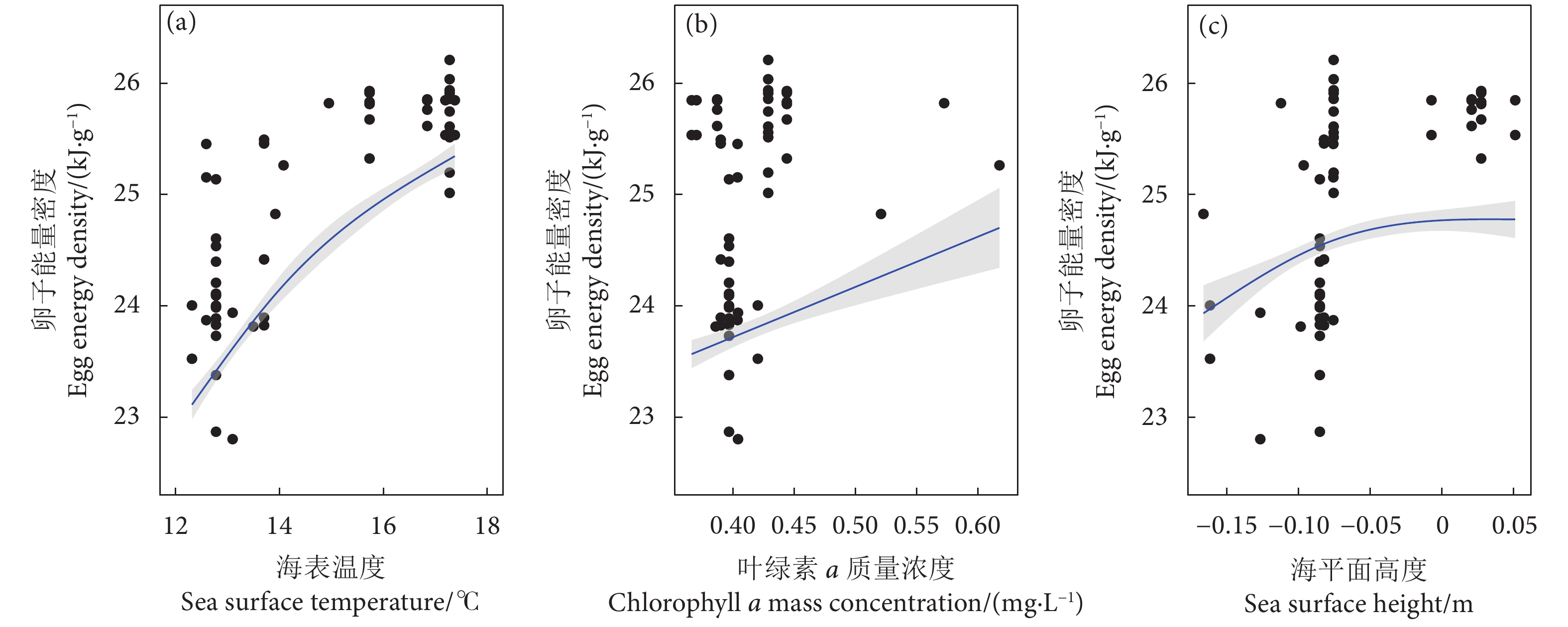
Sampling stationF P 海表温度 SST 0.28 0.47 −13.89×10−3 1 397.70 2.20×10−16 海底温度 SBT 12.5×10−3 0.31 1.16 1 770.60 2.20×10−16 叶绿素a质量浓度 Chl a 2.77×10−5 0.01 −0.11 179.37 2.20×10−16 净初级生产力 NPP 7.21 12.50 −3.45 284.79 2.20×10−16 海平面高度 SSH 2.48×10−5 2.23×10−3 0.07 1 018.10 2.20×10−16 混合层深度 MLD 5.95 37.17 8.50 518.38 2.20×10−16 海平面流速 VEL 4.05×10−5 6.42×10−3 −0.42 1 947.21 2.20×10−16 表 2 阿根廷滑柔鱼雌性个体有效繁殖力与环境因子的GAMM模型拟合结果
Table 2 GAMM model fitting results of effective fecundity and oceanic variables for female I. argentinus
效应
Effect模型参数因子
Model parameter估计
Estimate标准偏差
Standard devianceF P 随机效应 Random effect 采样月份 Sampling month 7.44×10−11 残差 Residual 0.33 固定效应 Fixed effect 截距 Intercept 11.05 0.04 海平面高度 SSH 0.11 0.17 0.16 0.51 叶绿素a质量浓度 Chl a 0.27 0.25 5.57 0.01 海表温度 SST 0.11 0.13 0.74 0.39 海表流速 VEL 0.46 0.31 2.35 0.13 注:GAMM模型中有效繁殖力作自然对数转化,环境因子作z-score标准分数转化。 Note: In GAMM model, the effective fecundity was converted into natural logarithm, and the oceanic variable was converted by z-score transformation. 表 3 阿根廷滑柔鱼雌性个体卵径与环境因子的GAMM模型拟合结果
Table 3 GAMM model fitting results of oviduct egg diameter and oceanic variables for mature female I. argentinus
效应
Effect模型参数因子
Model parameter估计
Estimate标准偏差
Standard devianceF P 随机效应 Random effect 采样月份 Sampling month 1.05×10−7 残差 Residual 0.07 固定效应 Fixed effect 截距 Intercept 0.33 0.01 海平面高度 SSH 0.15 0.05 9.91 2.73×10−3 叶绿素a质量浓度 Chl a 0.30 0.06 17.65 1.06×10−6 海表温度 SST 0.16 0.03 27.23 1.52×10−7 海表流速 VEL 0.11 0.07 2.38 0.14 注:GAMM模型中卵径作自然对数转化,环境因子作z-score标准分数转化。 Note: In GAMM model, the egg diameter was converted into natural logarithm, and the oceanic variable was converted by z-score transformation. 表 4 阿根廷滑柔鱼雌性成熟个体卵子能量密度与环境因子的GAMM模型拟合结果
Table 4 GAMM model fitting results of oviduct egg energy density and oceanic variables for mature female I. argentinus
效应
Effect模型参数因子
Model parameter估计
Estimate标准偏差
Standard devianceF P 随机效应 Random effect 采样月份 Sampling month 7.04×10−9 残差 Residual 0.47 固定效应 Fixed effect 截距 Intercept 3.22 2.56×10−3 海平面高度 SSH 0.04 0.01 14.88 3.28×10−4 叶绿素a质量浓度 Chl a 0.05 0.02 7.62 0.01 海表温度 SST 0.06 0.01 14.95 3.20×10−3 海表流速 VEL 0.01 0.02 2.48 0.13 注:GAMM模型中卵子能量密度作自然对数转化,环境因子作z-score标准分数转化。 Note: In GAMM model, the egg energy density was converted into natural logarithm, and the oceanic variable was converted by z-score transformation. -
[1] 宣思鹏, 陈新军, 林东明, 等. 西南大西洋阿根廷滑柔鱼雄性个体的有效繁殖力特性研究[J]. 水生生物学报, 2018, 42(4): 800-810. [2] 林东明, 宣思鹏, 陈新军. 头足类鞘亚纲繁殖力研究进展[J]. 海洋渔业, 2021, 43(1): 112-128. doi: 10.13233/j.cnki.mar.fish.2021.01.012 [3] 李培伦, 刘伟, 王继隆, 等. 黑龙江乌苏里白鲑的个体繁殖力[J]. 中国水产科学, 2015, 22(6): 1234-1242. [4] 陈新军. 渔业资源与渔场学[M]. 2版. 北京: 海洋出版社, 2014: 26-78. [5] FAO. The state of world fisheries and aquaculture 2022. Towards blue transformation[M]. Rome: FAO, 2022: 46-59.
[6] BOYLE P, RODHOUSE P. Cephalopods: ecology and fisheries[M]. Oxford: Blackwell Science Ltd. , 2005: 80-160.
[7] SCHWARZ R, PEREZ J A A. Growth model identification of short-finned squid Illex argentinus (Cephalopoda: Ommastrephidae) off southern Brazil using statoliths[J]. Fish Res, 2010, 106(2): 177-184. doi: 10.1016/j.fishres.2010.06.008
[8] VILLEGAS-RÍOS D, ALONSO-FERNÁNDEZ A, DOMÍNGUEZ-PETIT R, et al. Energy allocation and reproductive investment in a temperate protogynous hermaphrodite, the ballan wrasse Labrus bergylta[J]. J Sea Res, 2014, 86: 76-85. doi: 10.1016/j.seares.2013.11.010
[9] RODHOUSE P G K, ARKHIPKIN A I, LAPTIKHOVSKY V, et al. Illex argentinus, Argentine shortfin squid[M]//ROSA R, PIERCE G, O'DOR R. Advances in squid biology, ecology and fisheries. Part II: oegopsid squids. New York: Nova Science Publishers, 2013: 109-148.
[10] SCHWARZ R, PEREZ J A A. Age structure and life cycles of the Argentine shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in southern Brazil[J]. J Mar Biolog Assoc UK, 2013, 93(2): 557-565. doi: 10.1017/S0025315412000331
[11] BRUNETTI N E, IVANOVIC M, ROSSI G, et al. Fishery biology and life history of Illex argentinus[G]. Contributed papers to International Symposium on Large Pelagic Squids, 1998: 217-231.
[12] CRESPI-ABRIL A C, BARÓN P J. Revision of the population structuring of Illex argentinus (Castellanos, 1960) and a new interpretation based on modelling the spatio-temporal environmental suitability for spawning and nursery[J]. Fish Oceanogr, 2012, 21(2/3): 199-214.
[13] LAPTIKHOVSKY V V, NIGMATULLIN C M. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda: Ommastrephidae)[J]. ICES J Mar Sci, 1993, 50(4): 393-403. doi: 10.1006/jmsc.1993.1044
[14] LIN D M, CHEN X J, CHEN Y, et al. Sex-specific reproductive investment of summer spawners of Illex argentinus in the southwest Atlantic[J]. Invertebr Biol, 2015, 134(3): 203-213. doi: 10.1111/ivb.12088
[15] LIN D M, HAN F, XUAN S P, et al. Fatty acid composition and the evidence for mixed income-capital breeding in female Argentinean short-fin squid Illex argentinus[J]. Mar Biol, 2019, 166(7): 1-13.
[16] ZANG N, LIN D M, PUNT A E, et al. Nutrient allocation to eggs in female Argentinus shortfin squid, Illex argentinus using fatty acids as nutrient indicator[J]. Can J Zool, 2023, 101(9): 709-719. doi: 10.1139/cjz-2023-0001
[17] SACAU M, PIERCE G J, WANG J J, et al. The spatio-temporal pattern of Argentine shortfin squid Illex argentinus abundance in the southwest Atlantic[J]. Aquat Living Resour, 2005, 18(4): 361-372. doi: 10.1051/alr:2005039
[18] 臧娜, 宋维, 林东明. 阿根廷滑柔鱼雌性个体生殖能量积累及环境效应关系[J]. 上海海洋大学学报, 2022, 31(3): 631-641. [19] BARNECHE D R, ROBERTSON D R, WHITE C R, et al. Fish reproductive-energy output increases disproportionately with body size[J]. Science, 2018, 360(6389): 642-645. doi: 10.1126/science.aao6868
[20] 林东明, 陈新军, 方舟. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究[J]. 水产学报, 2014, 38(6): 843-852. [21] 林东明, 方学燕, 陈新军. 阿根廷滑柔鱼夏季产卵种群繁殖力及其卵母细胞的生长模式[J]. 海洋渔业, 2015, 37(5): 389-398. doi: 10.3969/j.issn.1004-2490.2015.05.001 [22] LIN D M, CHEN X J, CHEN Y, et al. Ovarian development in Argentinean shortfin squid Illex argentinus: group-synchrony for corroboration of intermittent spawning strategy[J]. Hydrobiologia, 2017, 795(1): 327-339. doi: 10.1007/s10750-017-3154-y
[23] MELO Y C, SAUER W H H. Confirmation of serial spawning in the chokka squid Loligo vulgaris reynaudii off the coast of South Africa[J]. Mar Biol, 1999, 135(2): 307-313. doi: 10.1007/s002270050628
[24] HERNÁNDEZ-MUÑOZ A T, RODRÍGUEZ-JARAMILLO C, MEJÍA-REBOLLO A, et al. Reproductive strategy in jumbo squid Dosidicus gigas (D'Orbigny, 1835): a new perspective[J]. Fish Res, 2016, 173(2): 145-150.
[25] THE R CORE TEAM. R: a language and environment for statistical computing, version 4.3.0[CP]. [2023-08-01]. https://www.R-project.org/.
[26] WITTHAMES P R, THORSEN A, MURUA H, et al. Advances in methods for determining fecundity: application of the new methods to some marine fishes[J]. Fish Bull, 2009, 107(2): 148-164.
[27] 张健, 杨培民, 胡宗云, 等. 大洋河刀鲚繁殖生物学特性[J]. 淡水渔业, 2021, 51(6): 3-11. [28] KELLER S, VALLS M, HIDALGO M, et al. Influence of environmental parameters on the life-history and population dynamics of cuttlefish Sepia officinalis in the western Mediterranean[J]. Estuar Coast Shelf Sci, 2014, 145: 31-40. doi: 10.1016/j.ecss.2014.04.016
[29] LIMA F D, LEITE T S, HAIMOVICI M, et al. Population structure and reproductive dynamics of Octopus insularis (Cephalopoda: Octopodidae) in a coastal reef environment along northeastern Brazil[J]. Fish Res, 2014, 152: 86-92. doi: 10.1016/j.fishres.2013.08.009
[30] LAPTIKHOVSKY V V, NIGMATULLIN C M. Aspects of female reproductive biology of the orange-back squid, Sthenoteuthis pteropus (Steenstup) (Oegopsina: Ommastrephidae) in the eastern tropical Atlantic[J]. Sci Mar, 2005, 69(3): 383-390. doi: 10.3989/scimar.2005.69n3383
[31] VELLATHI V, SANTHANAM R. Fecundity of Bigfin squid, Sepioteuthis lessoniana (Lesson, 1830) (Cephalopoda: Loliginidae)[J]. Jordan J Biol Sci, 2013, 6(1): 39-44. doi: 10.12816/0000257
[32] LAROE E T. The culture and maintenance of the loliginid squids Sepioteuthis sepioidea and Doryteuthis plei[J]. Mar Biol, 1971, 9(1): 9-25. doi: 10.1007/BF00348813
[33] RODHOUSE P G, HATFIELD E M C. Dynamics of growth and maturation in the cephalopod Illex argentinus de Castellanos, 1960 (Teuthoidea: Ommastrephidae)[J]. Philos Trans R Soc Lond B Biol Sci, 1990, 329(1254): 229-241. doi: 10.1098/rstb.1990.0167
[34] PIOLA A R, PALMA E D, BIANCHI A A, et al. Physical oceanography of the SW Atlantic Shelf: a review[M]//HOFFMEYER M S, SABATINI M E, BRANDINI F P, et al. Plankton ecology of the southwestern Atlantic: from the subtropical to the subantarctic realm. Cham: Springer International Publishing, 2018: 37-56.
[35] 沈建林, 张衡, 刘大鹏, 等. 摩洛哥沿岸头足类渔场时空分布及其与海温、叶绿素浓度的关系[J]. 渔业信息与战略, 2020, 35(4): 279-285. doi: 10.13233/j.cnki.fishis.2020.04.006 [36] ANDERSON C I, RODHOUSE P G. Life cycles, oceanography and variability: ommastrephid squid in variable oceanographic environments[J]. Fish Res, 2001, 54(1): 133-143. doi: 10.1016/S0165-7836(01)00378-2
[37] BAZZINO G, QUIÑONES R A, NORBIS W. Environmental associations of shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in the Northern Patagonian Shelf[J]. Fish Res, 2005, 76(3): 401-416. doi: 10.1016/j.fishres.2005.07.005
[38] 刘赫威, 余为, 陈新军. 西南大西洋阿根廷滑柔鱼资源及其对环境响应的研究进展[J]. 中国水产科学, 2020, 27(10): 1254-1265. [39] 罗相忠, 覃维敏, 梁宏伟, 等. 长丰鲢繁殖生物学研究[J]. 淡水渔业, 2021, 51(2): 21-27. doi: 10.3969/j.issn.1000-6907.2021.05.003 [40] NIGMATULLIN C M, MARKAIDA U. Oocyte development, fecundity and spawning strategy of large sized jumbo squid Dosidicus gigas (Oegopsida: Ommastrephinae)[J]. J Mar Biolog Assoc UK, 2009, 89(4): 789-801. doi: 10.1017/S0025315408002853
[41] LAPTIKHOVSKY V, NIGMATULLIN C M, HOVING H, et al. Reproductive strategies in female polar and deep-sea bobtail squid genera Rossia and Neorossia (Cephalopoda: Sepiolidae)[J]. Polar Biol, 2008, 31(12): 1499-1507. doi: 10.1007/s00300-008-0490-4
[42] VILLANUEVA R, VIDAL E A G, FERNÁNDEZ-ÁLVAREZ F Á, et al. Early mode of life and hatchling size in Cephalopod molluscs: influence on the species distributional ranges[J]. PLoS One, 2016, 11: e0165334. doi: 10.1371/journal.pone.0165334
[43] PECL G. Flexible reproductive strategies in tropical and temperate Sepioteuthis squids[J]. Mar Biol, 2001, 138(1): 93-101. doi: 10.1007/s002270000452
[44] FERNANDEZ-ARCAYA U, DRAZEN J C, MURUA H, et al. Bathymetric gradients of fecundity and egg size in fishes: a Mediterranean case study[J]. Deep-Sea Res I, 2016, 116: 106-117. doi: 10.1016/j.dsr.2016.08.005
[45] LIN D M, CHEN X J, WEI Y R, et al. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography[J]. Fish Res, 2017, 185: 102-114. doi: 10.1016/j.fishres.2016.09.023
[46] 朱文斌, 朱海晨, 王雅丽, 等. 基于线性混合效应模型的日本鳀幼鱼叉长-体重关系异质性[J]. 应用生态学报, 2021, 32(12): 4532-4538. doi: 10.13287/j.1001-9332.202112.032 [47] FANELLI E, CARTES J E, PAPIOL V. Assemblage structure and trophic ecology of deep-sea demersal cephalopods in the Balearic basin (NW Mediterranean)[J]. Mar Freshw Res, 2012, 63(3): 264-274. doi: 10.1071/MF11157
-
期刊类型引用(1)
1. 薛尊,石建高,张文阳. 中国重力式深水网箱研究进展和展望. 渔业研究. 2024(04): 393-402 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
