Ecological health assessment of Cyprinus carpio and Leiocassis longirostris national aquatic germplasm resources reserve in Huaihe River
-
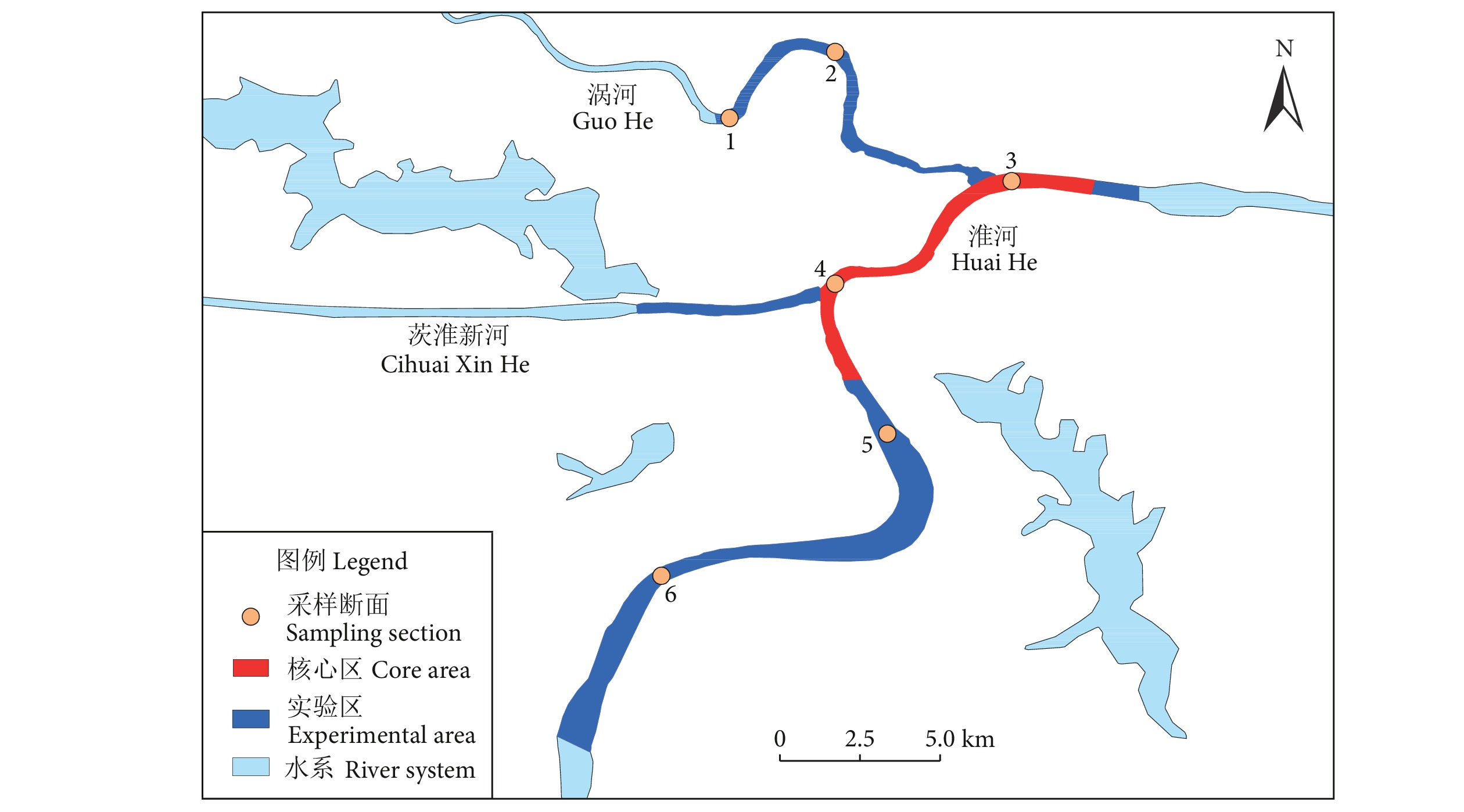
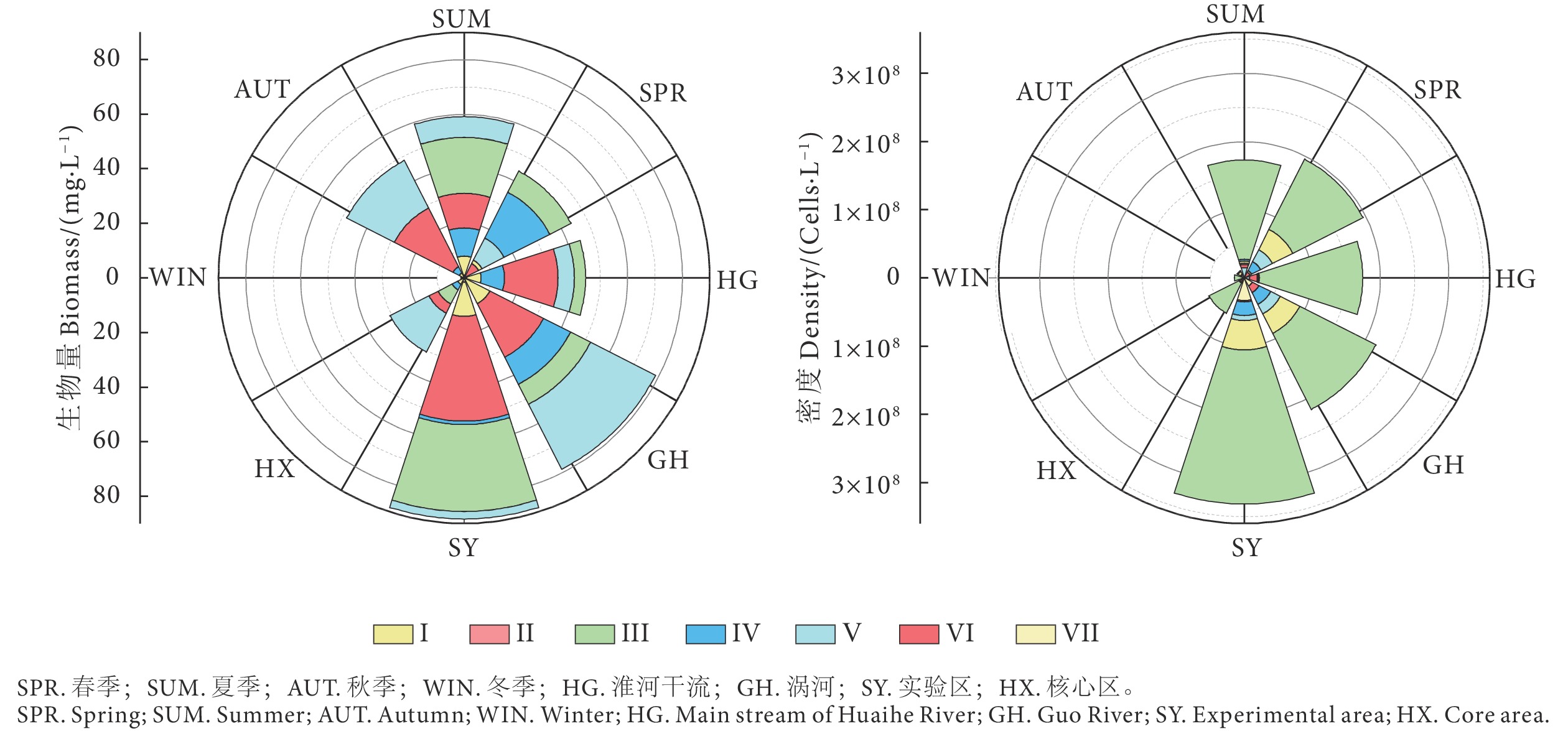
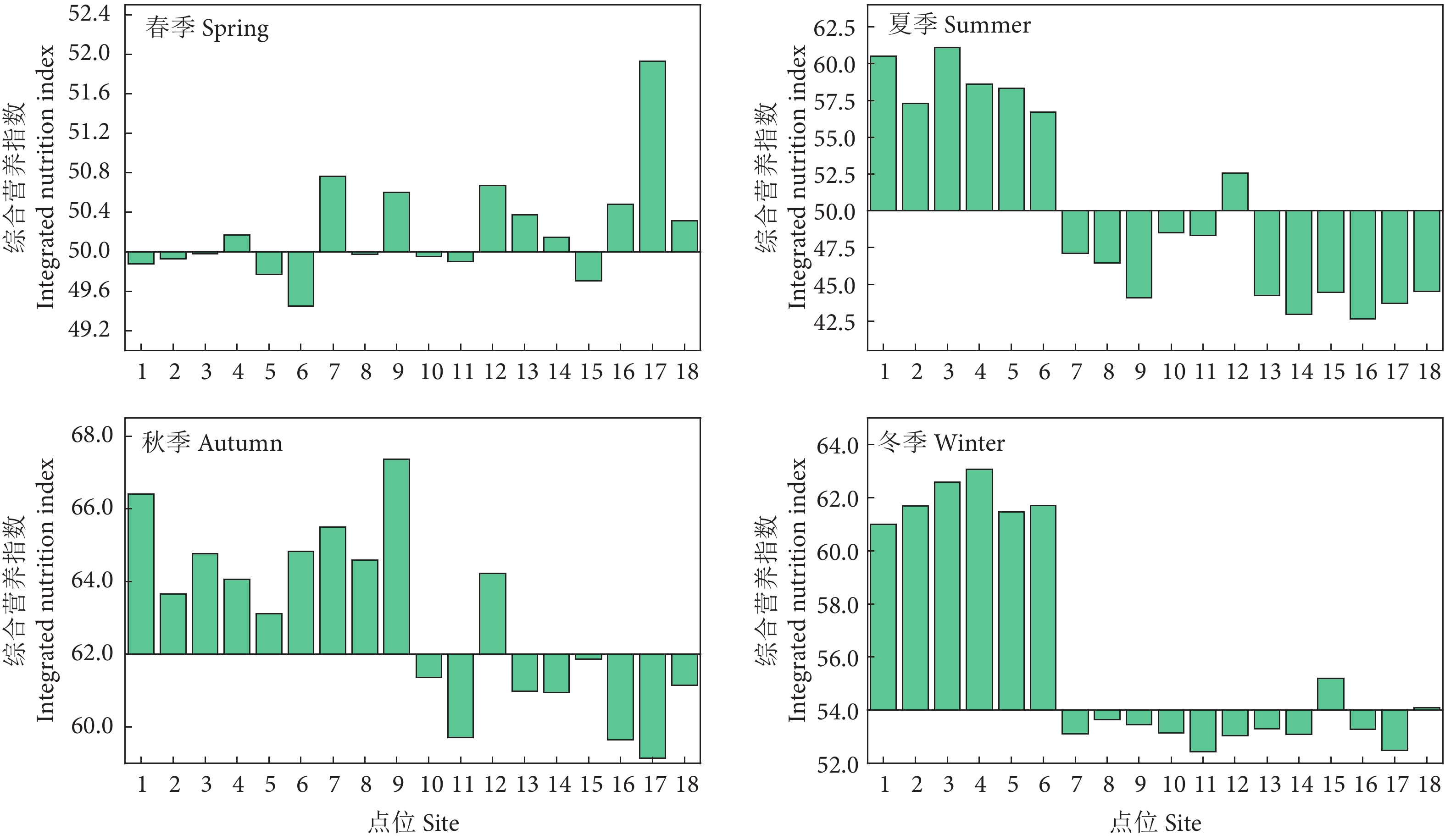
摘要: 评价水域生态健康状况可判别水生态恢复成效,是水环境管理的有效手段。为探究淮河荆涂峡鲤 (Cyprinus carpio)、长吻鮠 (Leiocassis longirostris) 国家级水产种质资源保护区的水生态健康状况,根据2020年浮游植物群落结构的调查结果,结合形态功能群分类法,构建了基于浮游植物生物完整性指数的保护区生态健康评价体系。选择受干扰较小的采样点为参照点,对候选参数进行非参数检验和相关性分析,确定最终的评价参数,采用比值法确定分级评价标准,对保护区水体进行健康评价。结果显示,浮游植物优势功能群演变趋势为III+IV+V (春季)→III+IV+V+VI (夏季)→V+VI (秋季)→IV+V+VI (冬季),除核心区的优势功能群为III+IV+V+VI外,实验区、涡河和淮河干流优势功能群均为III+IV+V+VI。保护区68.06%的样点评价结果为“一般”及以上,总体水生态健康状况良好,具体表现为冬季优于秋季、夏季次之、春季最差的时间格局,以及淮河干流优于涡河、实验区优于核心区的空间格局。Abstract: Evaluation of water ecological health status helps to judge the effectiveness of water ecological restoration, which is an effective means of water environment management. In order to explore the water ecological health status of Cyprinus carpio and Leiocassis longirostris national aquatic germplasm resources reserve in Huaihe River, according to the survey results of phytoplankton community structure in 2020 and combined with the morphological functional group classification, we constructed the ecological health evaluation system of the reserve based on the biological integrity index of phytoplankton. Besides, we carried out the Mann-Whitney non-parametric test and correlation analysis of the candidate parameters to determine the final evaluation parameters, and used the ratio method to determine the grading evaluation standard for the evaluation of the health status of the reserve water. The results show that the evolution trend of dominant functional groups of phytoplankton was III+IV+V (Spring)→III+IV+V+VI (Summer)→V+VI (Autumn)→IV+V+VI (Winter). Except that the dominant functional groups in the core area were III+ IV+V+VI, the dominant functional groups of the experimental area, the Guo river and the Huaihe River were III+IV+V+VI. 68.06% of the sampling sites in the reserve were evaluated as "average" or above, indicating that the overall water ecological health status was good. Specifically, the temporal pattern of winter was better than autumn, followed by summer, and the worst was in spring; the spatial pattern of Huaihe River mainstream was better than Guohe River, and the experimental area was better than the core area.
-
三角帆蚌 (Hyriopsis cumingii) 是中国南方一种重要的经济淡水蚌类。根据《2024中国渔业统计年鉴》,2023年中国淡水珍珠养殖产量为754 920 kg[1],而三角帆蚌珍珠产量在人工养殖淡水育珠蚌中占据重要地位。此外,三角帆蚌可通过高强度的滤食增加水体透明度,直接或间接地改变浮游植物和沉水植物的群落结构。因此,养殖三角帆蚌具有重要的经济价值和生态意义[2-4]。然而,近年来细菌和病毒感染导致贝类大规模死亡的现象时有发生,给珍珠养殖产业造成重大损失[5]。此外,养殖环境的恶化导致水生动物的发病率不断上升,污染物通过诱导免疫抑制,严重破坏了宿主先天免疫对病原体的防御[6]。因此,在集约化养殖条件下如何有效地防治贝类病害已成为产业发展面临的新一轮挑战。了解贝类先天性免疫机制和抗菌作用将有助于制定贝类病害治理方法,有利于推动贝类健康养殖和珍珠产业的可持续发展。
先天免疫系统是脊椎动物和无脊椎动物抵抗微生物入侵的第一道防线[7]。其中,Toll样受体 (Toll-like receptors, TLR) 作为先天免疫中的关键组分,在识别和应对多种病原体中发挥着至关重要的作用[8]。TLR1通过直接招募并结合髓样分化因子88 (Myeloid differentiation factor 88, MyD88) 蛋白,引发自身活化并募集下游信号转导相关蛋白白细胞介素-1受体相关激酶 (Interleukin-1 receptor-associated kinases, IRAKs),活化的IRAKs驱动自体磷酸化并募集肿瘤坏死因子受体相关因子6 (Tumour-necrosis factor receptor-associated factor 6, TRAF6)[9-11],TRAF6进而激活转化生长因子-β激活激酶1 (Transforming growth factor-β-activated kinase 1, TAK1),TAK1进一步刺激IkB激酶 (Inhibitor of kappa B kinase, IKK) 介导的核因子κB (Nuclear factor kappa-B, NF-κB) 和丝裂原活化蛋白激酶 (Mitogen-activated protein kinase, MAPK) 介导的激活蛋白1 (Activating protein-1, AP-1) 的转录反应,从而诱导炎性细胞因子的活化和表达[12-13]。目前已在三角帆蚌中鉴定了11个TLRs。在病原菌刺激下,三角帆蚌肝胰腺中Toll1基因的表达量升高,且过表达可以激活S2细胞中的Toll信号通路,从而上调抗真菌肽 (Drosomycin, DRS) 的表达[14]。然而并无研究证明在受到病原菌刺激时,TLR1是否直接激活MyD88信号通路,并调节下游相关免疫基因发挥抗菌应答作用。HcToll2参与诱导抗真菌肽表达以进行抗菌免疫[15];HcToll3介导调节乳清酸蛋白 (Whey acidic protein, WAP) 和溶菌酶 (Lysozyme, Lys) 的表达,参与了三角帆蚌对弧菌的防御[16];HcToll4和HcToll5则能够识别金黄色葡萄球菌 (Staphyloccocus aureus)、副溶血弧菌 (Vibrio parahemolyticus)、白斑综合征病毒 (White Spot Syndrome Virus) 和聚肌胞苷酸 (Polyinosinic acid-polycytidylic acid, poly I:C),并参与调节三角帆蚌抗菌肽 (Theromacin, Ther) 和乳清酸蛋白的表达[17];此外,HcToll6和HcToll7介导鳃中溶菌酶和防御素 (Defensins, Def) 的表达,参与了副溶血弧菌刺激后机体的抗菌应答过程[18];HcTLRn[19]、HcToll9和HcToll10可通过NF-κB信号通路参与三角帆蚌的抗菌免疫应答[20]。由此可见,在三角帆蚌体内存在多种不同功能的TLRs,它们在对抗不同病原微生物感染中发挥着重要作用。
为探讨三角帆蚌HcTLR1基因在先天性免疫中的作用机制,本研究从感染维氏气单胞菌 (Aeromonas veronii)的三角帆蚌肝胰腺转录组数据库[21]中筛选并克隆了三角帆蚌HcTLR1基因的全长cDNA。采用实时荧光定量分析技术和dsRNA干扰技术研究了HcTLR1基因在不同组织中的表达情况,以及HcTLR1-MyD88信号通路对不同免疫刺激物和维氏气单胞菌的免疫响应情况。为进一步了解TLRs在软体动物先天免疫防御和抗菌应答中的作用奠定了基础。
1. 材料与方法
1.1 实验材料
选用2龄三角帆蚌250只,体质量约为 (75±10) g。实验前,将蚌置于含过滤淡水和空气泵的15 L水循环系统中养殖1周左右,养殖水温 (23.0±1.0) ℃。每天喂食1次小球藻液 (5.6×105 个·mL−1)。暂养期间剔除不健康个体,选取健康个体用于后续实验。
1.2 HcTLR1基因克隆
从构建的三角帆蚌肝胰腺转录组文库中,筛选出TLR1基因片段 (数据未发表)[22]。使用SMARTer® RACE 5'/3' Kit试剂盒 (TaKaRa,日本),结合特异性和通用引物 (表1),以肝胰腺为模板,进行cDNA末端快速克隆 (RACE),扩增两端序列。PCR反应体系为:12 μL LA taq (TaKaRa,日本),1 μL 特异性引物 (Gene specific primer, GSP, 10 μmol·L−1),1 μL 通用引物 (Universal primer, UPM, 10 μmol·L−1),3 μL cDNA,8 μL ddH2O。PCR扩增程序为:98 ℃ 10 s,68 ℃ 30 s,72 ℃ 3 min,30个循环。将回收的PCR扩增产物连接到pMD19T质粒 (TaKaRa,日本) 载体中,并转化至大肠杆菌感受态DH5α细胞 (擎科生物,中国) 中进行菌液PCR和测序。最后,通过拼接HcTLR1的两端序列,获得基因全长序列。
表 1 引物序列Table 1 Sequences of primers引物名称
Primer name引物序列 (5'—3')
Primers sequence (5'−3')用途
Application来源
SourceHcTLR1-3'race-F TGCCATGCTGTACAGACTTGCTACCGAA 基因克隆 本研究 HcTLR1-5'race-R CGTGCACTTCTCGGGACATCTGTGT 本研究 UPM Long CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT 本研究 UPM Short CTAATACGACTCACTATAGGGC 本研究 TLR1-iF+T7 TAATACGACTCACTATAGGGTAAAGTTCGGATGGCGAATC RNA干扰 本研究 TLR1-iR TTTTCCCAAAACCAAGCATC 本研究 GFP-iF+T7 TAATACGACTCACTATAGGGAAGGGCGAGGAGCTGTTCACCG 本研究 GFP-iR CAGCAGGACCATGTGATCGCGC 本研究 HcTLR1-qPCR-F TGCCATGCTGTACAGACTTGCT qPCR 本研究 HcTLR1-qPCR-R CGTGCACTTCTCGGGACATCTGT 本研究 MyD88-qPCR-F GAACGCCACCCTTGGGAAAC 本研究 MyD88-qPCR-R TCCACGACAGCACCCTCAAG 本研究 TRAF6-qPCR-F CGCAGTGTGGTCATCGCTTC 本研究 TRAF6-qPCR-R TGGCACACGAGTTAGGGCAT 本研究 IRAK4-qPCR-F TCGCAAGTGGTACAGGCCAT 本研究 IRAK4-qPCR-R TGACGTGCCAATTACGAGCG 本研究 WAP-qPCR-F TGTAATGTTGACGGGAGTG [22] WAP-qPCR-R CTGTTTTGTTTTGATGGCT LBP/BPI1-qPCR-F TGGAGAACAGAGTCAGAAAGA [23] LBP/BPI1-qPCR-R CGATAGTCAAGCAGGAAATG LBP/BPI2-qPCR-F TATCAGTGTCAGCGGTAGTG [23] LBP/BPI2-qPCR-R CATCAGCGTAAAGAGGGA p65-qPCR-F TGGCAAGGACTGTAAGAAAGG [23] p65-qPCR-R CTTGTGCTTAAATCCAGTCTGA P105-qPCR-F TGTTGTATCCACTCCCATCT [23] P105-qPCR-R TCTTGCTCAACGAACTTCAC Lys-qPCR-F CACAGTTGGTGGTTCAGTAA 本研究 Lys-qPCR-R CGAATCCTTCAGTAGATGGT 本研究 IL17-qPCR-F CCATCCACGATCCTCAACG 本研究 IL17-qPCR-R CGCAAGTGTATCCAACAGCAA 本研究 Def-qPCR-F GGTGTCGTCTATCTTGCTTC [19] Def-qPCR-R AGGTTATTTGGTCATCTATTTTG Ther-qPCR-F CACAGTTGGTGGTTCAGTAA [18] Ther-qPCR-R CGAATCCTTCAGTAGATGGT EF1α-qPCR-F GGAACTTCCCAGGCAGACTGTGC [3] EF1α-qPCR-R TCAAAACGGGCCGCAGAGAAT 注:下划线部分引物序列为T7启动子序列。 Note: The underlined primer sequence is T7 promoter sequence. 1.3 生物信息学分析
使用NCBI (https://www.ncbi.nlm.nih.gov/) 中ORF Finder对基因序列开放阅读框 (Open reading frame, ORF) 与编码氨基酸序列进行预测;用Smart Blast对氨基酸序列进行同源性分析;通过Simple Modular Architecture Research Tool SMART (http://smart.embl-heidelberg.de/) 预测氨基酸所包含的结构域;利用Protparam (http://www.expasy.org/tools/protparam.html) 线上工具获取氨基酸序列组成、分子质量大小、等电点等物理参数信息;利用MEGA 11的邻接法 (Neighbor-Joining, NJ) 构建系统进化树,Bootstrap分析其可靠性,重复1 000次。
1.4 HcTLR1基因的组织表达
分别取三角帆蚌的肝胰腺、斧足、闭壳肌、外套膜、鳃、性腺、血细胞、肾脏和肠组织,并采用心脏取血的方式收集血淋巴,1 000×g离心5 min,收集血细胞。共9只蚌,每3只的组织混合作为1个样品,根据RNAiso plus提取试剂盒 (TaKaRa,日本) 说明书提取组织RNA。参照Hifair III 1st Strand cDNA Synthesis SuperMix (Yeasen,中国) 说明书合成cDNA。以EF-1α基因为内参,以不同组织的cDNA为模板,结合特定的荧光定量引物 (表1),通过BIORAD CFX ConnectTM荧光定量仪 (Bio-Rad Laboratories,美国),检测了2龄三角帆蚌不同组织中HcTLR1基因的相对表达量。反应体系为:10 μL SYBR Green Mix (Yeasen,中国)、0.4 μL q-F (10 μmol·L−1)、0.4 μL q-R (10 μmol·L−1)、2 μL cDNA和7.2 μL ddH2O。反应程序为:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,39个循环。使用2−ΔΔCt法计算基因的相对表达量,每组3个重复,计算平均值。
1.5 免疫刺激
脂多糖 (Lipopolysaccharides, LPS)、肽聚糖 (Peptidoglycan, PGN) 和poly I:C 3种刺激物代表不同的病原体相关分子模式 (Pathogen-associated molecular pattern, PAMP),均购自麦克林公司;维氏气单胞菌GL1由本实验室前期从患病三角帆蚌中分离[23]。将健康三角帆蚌随机分为5组,其中4组向闭壳肌中分别注射200 μL维氏气单胞菌GL1 (107 CFU·mL−1)、LPS、PGN和poly I:C (0.5 mg·mL−1,溶于pH 7.4的PBS),另一组注射相同体积的磷酸盐缓冲溶液 (PBS, pH 7.4) 作为阴性对照。未经处理的三角帆蚌作为空白对照组。在注射后的第6、第12、第24、第48小时,分别收集9只三角帆蚌的血细胞、肝胰腺和鳃组织。每3只蚌的组织混合作为1个样品,用于RNA提取。
1.6 血细胞内RNA干扰实验
使用Primer 5.0软件设计1对含有T7启动子的基因特异性引物:TLR1-iF+T7、TLR1-iR (表1)。以血细胞cDNA为模板,采用rTaq DNA聚合酶 (TaKaRa,日本) 进行特异性DNA片段的扩增。同时,绿色荧光蛋白 (Green fluorescent protein, GFP) 片段用于阴性对照dsRNA的合成。根据T7 High Yield RNA Transcription Kit (Beyotime Biotechnology,中国) 试剂盒操作,合成并纯化相应的dsRNA。
挑选健康的三角帆蚌个体暂养后收集血细胞。血细胞培养于含10% (φ) FBS (Gibico,美国)、2% (φ) 青链霉素 (Beyotime Biotechnology,中国) 的DMEM培养基 (Gibico,美国) 中,培养条件为27 ℃、5% (φ) CO2,并定期观察细胞状态。按照每毫升106个细胞的密度,向细胞中同时加入40 μg的dsRNA及灭活后的维氏气单胞菌GL1。每个时间点的不同处理组各设置3个重复。将上述处理的细胞置于27 ℃、5% (φ) CO2培养箱中静置培养。在培养后的第6、第12和第24小时,分别收集不同处理组的血细胞,以便进行后续的RNA提取和qPCR分析。
1.7 数据分析
所有数据均以“平均值±标准差 ($ \overline x \pm s $)”表示。采用SPSS 26.0软件进行单因素方差 (One-Way ANOVA) 分析及Tukey氏多重检验,显著性水平α为0.05 (n=3)。
2. 结果
2.1 三角帆蚌HcTLR1基因的克隆与序列分析
通过测序、拼接获得HcTLR1基因全长序列 (GenBank登录号:PP051478) 3 969 bp,包含45 bp的5'非翻译区 (Untranslated region, UTR)、237 bp的3'UTR和3 687 bp的ORF,共编码1 228个氨基酸 (图1),预测分子质量为139 kD,理论等电点为5.54。SMART结构域分析预测HcTLR1蛋白包含14个LRR结构域、3个LRR亚家族结构域、2个C端LRR结构域、1个LRR-NT结构域、1个跨膜结构域和1个胞内TIR结构域 (图2)。
![]() 图 1 HcTLR1核苷酸序列和预测的氨基酸序列注:红色碱基代表起始密码子 (ATG) 和终止密码子 (TAA);富含亮氨酸的重复序列 (LRR) 结构域用下划线标出;富含亮氨酸的重复序列典型的亚家族 (LRR TYP) 用双下划线标出;富含亮氨酸重复C-末端结构域 (LRR CT) 用波浪线标出;富含亮氨酸重复N-末端结构域 (LRR NT) 用虚线标出;跨膜结构域 (TM) 用灰色标出;白细胞介素-1受体 (TIR) 结构域用蓝色标出。Fig. 1 Nucleotide sequences and predicted amino acid sequences of HcTLR1Note: Red bases represent the initiation codon (ATG) and stop codon (TAA); the Leucine-rich repeats (LRR) domains were underlined; the Leucine-rich repeats typical subfamily (LRR TYP) was double underlined; the Leucine rich repeat C-terminal domain (LRR CT) was marked with wavy lines; the Leucine rich repeat N-terminal domain (LRR NT) was marked with dotted line; the transmembrane domain (TM) was marked with gray and the Toll/interleukin-1 receptor (TIR) domain was marked with blue.
图 1 HcTLR1核苷酸序列和预测的氨基酸序列注:红色碱基代表起始密码子 (ATG) 和终止密码子 (TAA);富含亮氨酸的重复序列 (LRR) 结构域用下划线标出;富含亮氨酸的重复序列典型的亚家族 (LRR TYP) 用双下划线标出;富含亮氨酸重复C-末端结构域 (LRR CT) 用波浪线标出;富含亮氨酸重复N-末端结构域 (LRR NT) 用虚线标出;跨膜结构域 (TM) 用灰色标出;白细胞介素-1受体 (TIR) 结构域用蓝色标出。Fig. 1 Nucleotide sequences and predicted amino acid sequences of HcTLR1Note: Red bases represent the initiation codon (ATG) and stop codon (TAA); the Leucine-rich repeats (LRR) domains were underlined; the Leucine-rich repeats typical subfamily (LRR TYP) was double underlined; the Leucine rich repeat C-terminal domain (LRR CT) was marked with wavy lines; the Leucine rich repeat N-terminal domain (LRR NT) was marked with dotted line; the transmembrane domain (TM) was marked with gray and the Toll/interleukin-1 receptor (TIR) domain was marked with blue.将三角帆蚌HcTLR1蛋白的功能结构域序列与其他物种功能结构域序列进行多重序列比对,发现不同物种 (包括脊椎动物和无脊椎动物) 的TIR结构域序列具有较高的同源性 (图3)。基于三角帆蚌氨基酸全长序列的系统进化树分析显示,HcTLR1与三角帆蚌Toll 1及栉孔扇贝 (Azumapecten farreri) Toll、长牡蛎 (Crassostrea gigas) TLR1聚为一支,其中与三角帆蚌Toll 1的亲缘关系最近 (图4)。
![]() 图 3 三角帆蚌与其他物种TIR结构域的氨基酸多序列比对注:黑色阴影表示氨基酸相同,其他阴影表示氨基酸部分相同;用于多重序列比对的其他物种的氨基酸序列分别是智人 (CAG38593.1),小鼠 (AAG35062.1),大鼠 (XP_038947854.1),原鸡 (BAD67422.1),斑马鱼 (NP_001124065.1),三角帆蚌 (Toll 2: AIA66467.1, Toll 4: AVR52705.1, Toll 5: AVR52704.1, Toll 6: QCR63936.1, Toll 7: QCR63937.1),紫贻贝 (AFU48614.1),虾夷扇贝 (XP_021346851.1),海湾扇贝 (AVP74315.1),巨海扇蛤 (XP_033755286.1)。Fig. 3 Multiple sequence alignment of TIR domain between H. cumingii and other speciesNote: Black shading represents amino acid identity, and other shading represents partial amino acid identity. The amino acid sequences used for multiple alignment include Homo sapians (CAG38593.1), Mus musculus (AAG35062.1), Rattus norvegicus (XP_038947854.1), Gallus gallus (BAD67422.1), Danio rerio (NP_001124065.1), Hyriopsis cumingii (Toll 2: AIA66467.1, Toll 4: AVR52705.1, Toll 5: AVR52704.1, Toll 6: QCR63936.1, Toll 7: QCR63937.1), Mytilus galloprovincialis (AFU48614.1), Mizuhopecten yessoensis (XP_021346851.1), Argopecten irradians (AVP74315.1) and Pecten maximus (XP_033755286.1).
图 3 三角帆蚌与其他物种TIR结构域的氨基酸多序列比对注:黑色阴影表示氨基酸相同,其他阴影表示氨基酸部分相同;用于多重序列比对的其他物种的氨基酸序列分别是智人 (CAG38593.1),小鼠 (AAG35062.1),大鼠 (XP_038947854.1),原鸡 (BAD67422.1),斑马鱼 (NP_001124065.1),三角帆蚌 (Toll 2: AIA66467.1, Toll 4: AVR52705.1, Toll 5: AVR52704.1, Toll 6: QCR63936.1, Toll 7: QCR63937.1),紫贻贝 (AFU48614.1),虾夷扇贝 (XP_021346851.1),海湾扇贝 (AVP74315.1),巨海扇蛤 (XP_033755286.1)。Fig. 3 Multiple sequence alignment of TIR domain between H. cumingii and other speciesNote: Black shading represents amino acid identity, and other shading represents partial amino acid identity. The amino acid sequences used for multiple alignment include Homo sapians (CAG38593.1), Mus musculus (AAG35062.1), Rattus norvegicus (XP_038947854.1), Gallus gallus (BAD67422.1), Danio rerio (NP_001124065.1), Hyriopsis cumingii (Toll 2: AIA66467.1, Toll 4: AVR52705.1, Toll 5: AVR52704.1, Toll 6: QCR63936.1, Toll 7: QCR63937.1), Mytilus galloprovincialis (AFU48614.1), Mizuhopecten yessoensis (XP_021346851.1), Argopecten irradians (AVP74315.1) and Pecten maximus (XP_033755286.1).2.2 HcTLR1基因组织特异性表达分析
实时荧光定量PCR结果显示,HcTLR1基因在所有检测的组织中均有表达,且表达程度各异 (图5)。其中,血细胞中HcTLR1的表达量最高,并显著高于其他组织 (p<0.05)。其在血细胞中的表达量分别为肝胰腺的13.67倍、斧足的23.27倍、闭壳肌的19.06倍、外套膜的7.1倍、鳃的11.45倍、性腺的18.63倍、肾脏的2.5倍和肠的2.07倍。
![]() 图 5 HcTLR1 mRNA在三角帆蚌组织中的相对表达量注:1. 肝胰腺;2. 斧足;3. 闭壳肌;4. 外套膜;5. 鳃;6. 性腺;7. 血细胞;8. 肾脏;9. 肠;所标字母不同表示差异显著 (p<0.05)。Fig. 5 Relative mRNA expression of HcTLR1 in different tissues from H. cumingiiNote: 1. Hepatopancreas; 2. Foot; 3. Adductor; 4. Mantle; 5. Gill; 6. Gonad; 7. Hemocyte; 8. Kidney; 9. Intestine. Different letters represent significant differences (p<0.05).
图 5 HcTLR1 mRNA在三角帆蚌组织中的相对表达量注:1. 肝胰腺;2. 斧足;3. 闭壳肌;4. 外套膜;5. 鳃;6. 性腺;7. 血细胞;8. 肾脏;9. 肠;所标字母不同表示差异显著 (p<0.05)。Fig. 5 Relative mRNA expression of HcTLR1 in different tissues from H. cumingiiNote: 1. Hepatopancreas; 2. Foot; 3. Adductor; 4. Mantle; 5. Gill; 6. Gonad; 7. Hemocyte; 8. Kidney; 9. Intestine. Different letters represent significant differences (p<0.05).2.3 免疫刺激后不同组织中HcTLR1的表达
在2 龄三角帆蚌受到维氏气单胞菌和不同PAMPs刺激后,采用qPCR技术检测了不同时间点三角帆蚌各组织中HcTLR1基因的相对表达量。结果显示,在鳃组织中,经维氏气单胞菌GL1和poly I:C刺激后,HcTLR1基因表达量呈先上升后下降的趋势。刺激后第12 和第24小时,其表达量显著增加 (p<0.05),分别为PBS组的5.2和4.5倍。而LPS、PNG刺激后,其表达量呈下降趋势,但在刺激后第6小时,与PBS组相比,其表达量显著增加 (p<0.05),分别为4.2和5.4倍 (图6-a)。在肝胰腺中,经维氏气单胞菌GL1、LPS、PNG、poly I:C刺激后,HcTLR1基因的表达量也呈先上升后下降的趋势,且在刺激后第24小时表达量显著上调 (p<0.05),分别为PBS组的14、5.8、8和4.9倍 (图6-b)。在血细胞中,维氏气单胞菌GL1刺激后第6、第12和第24小时,HcTLR1基因的表达量显著上调 (p<0.05),分别为PBS组的2.1、2和2.4倍 (图6-c)。然而,在LPS、PNG、poly I:C刺激后,其表达量先下降后上升,但无显著性差异 (p>0.05)。由此可见,当三角帆蚌经过维氏气单胞菌GL1、LPS、PNG和poly I:C刺激后,HcTLR1基因在不同组织和时间点的表达水平存在显著差异。
![]() 图 6 免疫刺激后三角帆蚌鳃 (a)、肝胰腺 (b) 和血细胞 (c) 中HcTLR1 mRNA在不同时间点的相对表达量注:同一处理时间下不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 6 Relative mRNA expression of HcTLR1 after immune challenges in gill (a), hepatopancreas (b) and hemocyte (c) of H. cumingii at different time pointNote: Different letters at the same treatment time represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).
图 6 免疫刺激后三角帆蚌鳃 (a)、肝胰腺 (b) 和血细胞 (c) 中HcTLR1 mRNA在不同时间点的相对表达量注:同一处理时间下不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 6 Relative mRNA expression of HcTLR1 after immune challenges in gill (a), hepatopancreas (b) and hemocyte (c) of H. cumingii at different time pointNote: Different letters at the same treatment time represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).2.4 HcTLR1基因干扰后MyD88依懒性通路及免疫相关基因的表达
为了探究三角帆蚌HcTLR1基因对TLR信号通路的激活作用,采用dsRNA干扰方法来抑制血细胞中HcTLR1基因的表达。通过qPCR检测HcTLR1及其介导的MyD88依赖性信号通路中多个关键基因的表达变化,包括MyD88、IRAK4、TRAF6、核因子-κB/Rel转录因子p65 (NF-κB/RELA p65, p65)、核因子-κB/Rel 蛋白1 p105 (NF-κB/RELA 1 p105, p105) 和下游免疫相关基因Ther、Lys、Def、Wap、脂多糖结合蛋白/杀菌通透性增加蛋白 (LPS binding protein/bactericidal permeability increasing protein, LBP/BPI) 1、2和白细胞介素17 (Interleukin-17, IL-17)。结果显示,与未处理组和阴性对照dsGFP组相比,dsTLR1组在干扰后的第6、第12和第24小时,HcTLR1 基因的表达量显著下降,干扰效果显著 (p<0.05,图7-a)。在此基础上,进一步在干扰后使用维氏气单胞菌GL1刺激血细胞发现,dsTLR1组的HcTLR1基因表达量在第6、第12和第24小时均显著降低 (p<0.05,图7-b)。此外,与未处理组相比,维氏气单胞菌GL1刺激血细胞12 h后检测发现,dsTLR1组中MyD88依赖性通路相关基因MyD88、IRAK4、TRAF6、p65和p105的表达量分别下降87.8%、97.7%、94.6%、93%和96.3% (p<0.05,图8-a—e)。同时,通路下游抗菌免疫相关基因Ther、Def、Lys、WAP、LBP/BPI 2和IL-17的表达量分别下降97.4%、98.3%、99.7%、91.7%、91.2%和94.4% (p<0.05,图8-f—i,8-k—l)。然而,LBP/BPI 1基因的表达量与对照组相比无显著性差异 (p>0.05,图8-j)。上述结果表明,HcTLR1基因参与三角帆蚌TLR1-MyD88-NF-κB信号通路的激活,并通过激活下游免疫相关基因发挥抗菌应答作用。
![]() 图 7 HcTLR1干扰及免疫刺激后血细胞中HcTLR1 mRNA的相对表达量注:a. dsRNA干扰后血细胞中HcTLR1 mRNA的表达水平;b. dsRNA干扰后并经维氏气单胞菌GL1刺激血细胞中HcTLR1 mRNA的表达水平。同一处理时间下不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 7 mRNA expression levels in hemocytes of H. cumingii after HcTLR1 interference and immune challengesNote: a. HcTLR1 mRNA expression levels in hemocytes after dsRNA interference; b. HcTLR1 mRNA expression levels in hemocytes after dsRNA interference in A. veronii GL1 stimulation. Different letters at the same treatment time represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).
图 7 HcTLR1干扰及免疫刺激后血细胞中HcTLR1 mRNA的相对表达量注:a. dsRNA干扰后血细胞中HcTLR1 mRNA的表达水平;b. dsRNA干扰后并经维氏气单胞菌GL1刺激血细胞中HcTLR1 mRNA的表达水平。同一处理时间下不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 7 mRNA expression levels in hemocytes of H. cumingii after HcTLR1 interference and immune challengesNote: a. HcTLR1 mRNA expression levels in hemocytes after dsRNA interference; b. HcTLR1 mRNA expression levels in hemocytes after dsRNA interference in A. veronii GL1 stimulation. Different letters at the same treatment time represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).![]() 图 8 HcTLR1 基因干扰及免疫刺激后血细胞中TLR1-MyD88-NF-κB信号通路及下游抗菌相关基因的相对表达量注:不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 8 Relative expression of TLR1-MyD88-NF-κB signaling pathway and downstream antimicrobial-associated gene in hemocytes after HcTLR1 gene interference and immune challengesNote: Different letters represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).
图 8 HcTLR1 基因干扰及免疫刺激后血细胞中TLR1-MyD88-NF-κB信号通路及下游抗菌相关基因的相对表达量注:不同字母表示差异显著 (p<0.05),相同字母表示差异不显著 (p>0.05)。Fig. 8 Relative expression of TLR1-MyD88-NF-κB signaling pathway and downstream antimicrobial-associated gene in hemocytes after HcTLR1 gene interference and immune challengesNote: Different letters represent significant differences (p<0.05), while the same letters represent insignificant differences (p>0.05).3. 讨论
本研究克隆了三角帆蚌HcTLR1基因的cDNA序列,编码一个长为3 687 bp的ORF。蛋白质结构预测分析显示,HcTLR1蛋白中含有多个LRR结构域、1个跨膜结构域和1个胞内Toll/白细胞介素-1受体 (TIR),表现出典型的Toll样受体结构。其中,Toll样受体胞外结构域由LRR组成,每个LRR被疏水性的氨基酸间隔开,在识别多种病原体相关的分子模式中发挥重要作用[24-25];而胞内结构域由TIR构成,具有3个保守的氨基酸序列框,负责C端信号传导,并能与含有TIR结构域的接头蛋白MyD88发生相互作用以激活下游信号通路[26-28]。这表明HcTLR1能够识别多种病原体相关分子模式并启动天然免疫反应,参与三角帆蚌的抗菌应答过程。在维氏气单胞菌GL1、LPS、PNG和poly I:C刺激下,三角帆蚌鳃、肝胰腺和血细胞中HcTLR1基因的表达量在不同时间点呈现显著性差异。同时,不同刺激诱导下,免疫持续时效也存在差异。这一发现与已报道的贝类研究结果相符。例如,在副溶血弧菌刺激后,香港牡蛎 (C. hongkongensis) 鳃和血细胞中TLR4基因表达量显著性升高[29];在溶藻弧菌 (V. alginolyticus)、LPS、PGN和poly I:C刺激后,合浦珠母贝 (Pinctada fucata) 肝胰腺中PfTLR3和PfTLR13基因的表达量在不同时间点出现显著性差异[30-31];在LPS、PGN和poly I:C刺激后,三角帆蚌肝胰腺和鳃中TLRn基因的表达水平在不同时间点均显著性升高[20]。以上研究结果均证实了贝类TLRs在应对病原体和PAMPs的刺激时扮演着重要的免疫识别作用[32]。因此,推测HcTLR1分子具有广泛的识别谱,能够识别多种病原体及不同类型的PAMPs,并可能引起一系列级联反应,参与生物体防御功能。
三角帆蚌各组织HcTLR1基因定量结果显示,其在肝胰腺、斧足、闭壳肌、外套膜、鳃、性腺、血细胞、肾脏和肠等9种组织中均有不同程度的表达,特别是在血细胞中的表达量显著高于其他组织。而在贝类抵御外来病原微生物的过程中,血细胞起到了至关重要的作用,既是细胞免疫的主体,又是体液免疫的提供者[33]。已有研究发现,长牡蛎的TLR2和TLR3基因[34-35]及厚壳贻贝 (Mytilus coruscus) 的TLR-like1基因[36]均在血细胞中高表达,并在贝类的免疫应答中发挥关键作用。这与本研究的结果相似,提示HcTLR1在三角帆蚌抗菌应答中同样扮演着重要角色。
鉴于血细胞在贝类免疫系统中的中心地位[37-38],本研究在血细胞内进行RNA干扰实验。结果显示,HcTLR1的干扰导致多个基因 (如MyD88、IRAK4、TRAF6、p65、p105等) 的表达量明显下调,同时下游抗菌免疫基因 (如Ther、Lys、Def、WAP、LBP/BPI 2和IL-17) 的表达量也显著降低。这一结果与厚壳贻贝中干扰McTLRw导致McMyD88、McIRAK4和McTRAF6基因的表达受到显著抑制[39],青蛤 (Cyclina sinensis) 中干扰CsTLR13导致CsMyD88、CsIRAK4、CsTRAF6、CsIKKa、CsIkB、CsNF-kB、CsC-LYZ和CsAMP基因[40]表达显著下调,以及三角帆蚌中干扰HcTLRn导致NF-κB (p65、p105) 及Lys、Ther、WAP、LBP/BPI 1和LBP/BPI 2的表达显著下降[20]等研究结果相一致,这提示HcTLR1可能参与TLR信号通路的激活,且TLR1-MyD88-NF-κB信号通路在三角帆蚌先天免疫应答中起重要作用。Toll信号通路是宿主抗菌应答重要的信号转导通路之一[17],TLR1属于跨膜蛋白,位于信号通路最上游,当受到病原体刺激时,其胞内TIR结构域与包含TIR结构域的接头蛋白MyD88直接相互作用,并经过刺激将IRAK4吸引到TLRs,进而活化IKK复合体、MAPKs和NF-κB等级联反应,最终调节免疫相关基因的表达以发挥多种生物学功能[41]。因此,在三角帆蚌血细胞中,干扰HcTLR1 基因从而导致MyD88依赖性信号通路基因的表达受到抑制,表明HcTLR1可能通过激活MyD88-NF-κB依赖性信号通路来调节下游免疫相关基因的表达,从而发挥抗菌应答作用,但下游MAPK信号通路是否参与三角帆蚌的抗菌应答仍未可知。本研究结果对于深入了解Toll信号通路及HcTLR1在生物体内的抗菌应答机制具有积极意义。
-
表 1 候选参数
Table 1 Candidate parameters
参数种类Parametertype 候选参数Candidate parameter 群落多样性Community diversity M1. 藻类物种数 M2. 蓝藻物种数 M3. 硅藻物种数 M4. 隐藻物种数 M5. 绿藻物种数 M6. 非硅藻物种数 M7. Shannon多样性指数 M8. Pielou均匀度指数 M9. Margalef丰富度指数 M10. Simpson多样性指数 群落丰富度Community richness M11. 藻类密度 M12. 蓝藻密度 M13. 硅藻密度 M14. 隐藻密度 M15. 绿藻密度 M16. 非硅藻密度 M17. 藻类生物量 M18. 蓝藻生物量 M19. 硅藻生物量 M20. 隐藻生物量 M21. 绿藻生物量 M22. 非硅藻生物量 群落均匀度Community evenness M23. 蓝藻密度/% M24. 硅藻密度/% M25. 隐藻密度/% M26. 绿藻密度/% M27. 非硅藻密度/% M28. 蓝藻生物量/% M29. 硅藻生物量/% M30. 隐藻生物量/% M31. 绿藻生物量/% M32. 非硅藻生物量/% 形态功能群 Morphology based functional groups M33. I类功能群密度 M34. II类功能群密度 M35. III类功能群密度 M36. IV类功能群密度 M37. V类功能群密度 M38. VI类功能群密度 M39. VII类功能群密度 M40. I类功能群生物量 M41. II类功能群生物量 M42. III类功能群生物量 M43. IV类功能群生物量 M44. V类功能群生物量 M45. VI类功能群生物量 M46. VII类功能群生物量 M47. I类功能群密度/% M48. II类功能群密度/% M49. III类功能群密度/% M50. IV类功能群密度/% M51. V类功能群密度/% M52. VI类功能群密度/% M53. VII类功能群密度/% M54. I类功能群生物量/% M55. II类功能群生物量/% M56. III类功能群生物量/% M57. IV类功能群生物量/% M58. V类功能群生物量/% M59. VI类功能群生物量/% M60. VII类功能群生物量/% 表 2 参数数据分析
Table 2 Parameter data analysis
季节 Season 参数 Parameter 最大值 Maximum value 最小值 Minimum value 5%分位数 5% Quantile 95%分位数 95% Quantile 参数赋分公式 Parameter assignment formula 对干扰响应 Response to interference 春季 Spring M7 2.254 0.979 1.026 2.246 M7/2.246 下降 M45 1.732 0.000 0.002 1.213 M45/1.213 下降 M58 0.822 0.029 0.086 0.717 0.822−M58/0.822−0.086 上升 夏季 Summer M28 0.677 0.001 0.027 0.668 M28/0.668 下降 M37 2 366 163.857 47 323.277 67 435.670 1 984 028.394 2 366 163.857−M37/2 366 163.857−67 435.670 上升 M50 0.365 0.018 0.019 0.349 0.365−M50/0.365−0.018 上升 秋季 Autumn M9 1.313 0.618 0.554 1.218 0.313−M9/1.313−0.505 上升 M11 4 571 428.571 1 220 940.550 890 150.843 4 321 561.668 4 571 428.571−M11/4 571 428.571−890 150.843 上升 M15 1 703 637.977 170 363.798 170 363.798 1 590 062.112 1 703 637.977−M15/1 703 637.977−170 363.798 上升 M44 13.294 0.003 0.056 6.643 13.294−M44/13.294−0.056 上升 冬季 Winter M8 0.918 0.294 0.314 0.910 M8/0.910 下降 M9 0.876 0.390 0.394 0.849 0.876−M9/0.876−0.394 上升 M22 0.559 0.006 0.019 0.476 0.559−M22/0.559−0.019 上升 M25 0.444 0.000 0.002 0.338 M25/0.338 下降 M26 0.667 0.082 0.099 0.575 M26/0.575 下降 M43 0.254 0.001 0.001 0.241 0.254−M43/0.254−0.001 上升 表 3 保护区P-IBI评价标准
Table 3 P-IBI evaluation criteria for reserve
季节 Season 健康 Health 亚健康 Sub-health 一般 General 较差 Worse 极差 Range 春季 Spring >2.64 1.98~2.64 1.32~1.98 0.66~1.32 <0.66 夏季 Summer >2.86 2.14~2.86 1.43~2.14 0.71~1.43 <0.71 秋季 Autumn >3.83 2.87~3.83 1.91~2.87 0.96~1.91 <0.96 冬季 Winter >5.95 4.46~5.95 2.97~4.46 1.49~2.97 <1.49 表 4 四季P-IBI与环境因子逐步回归
Table 4 Stepwise regression between P-IBI and environmental factors
季节Season 逐步线性回归方程 Stepwise linear regression equation R P F 春季 Spring yP-IBI=−1.464+0.951xTP−0.268xNH3-N 0.914 0.000 38.244 夏季 Summer yP-IBI=2.639−0.304xTP +0.775xNH3-N −1.417xNO2 −-N 0.958 0.000 52.548 秋季 Autumn yP-IBI=−3.044+0.697xTP 0.697 0.001 15.094 冬季 Winter yP-IBI=17.45−0.757xNH3-N 0.757 0.000 21.458 -
[1] 马金玉, 罗千里, 王文才, 等. 华阳河湖群表层沉积物磷形态及生物有效性[J]. 长江流域资源与环境, 2021, 30(12): 2962-2971. [2] 王晨, 陶孟, 李爱民, 等. 基于环境DNA宏条形码技术的秦淮河生物多样性研究[J]. 生态学报, 2022, 42(2): 611-624. [3] 马迎群, 曹伟, 赵艳民, 等. 典型平原河网区水体富营养化特征、成因分析及控制对策研究[J]. 环境科学学报, 2022, 42(2): 174-183. [4] 张宇航, 渠晓东, 王少明, 等. 浑河流域底栖动物生物完整性指数构建与健康评价[J]. 长江流域资源与环境, 2020, 29(6): 1374-1386. [5] 王旭, 王恒嘉, 王永刚, 等. 基于大型底栖动物完整性指数(B-IBI)的密云水库上游河流 (北京段) 水生态健康评价[J]. 生态与农村环境学报, 2022, 38(2): 157-167. [6] KARR R J. Assessment of biotic integrity using fish communities[J]. Fisheries, 2011, 6(6): 21-27.
[7] 田盼盼, 桑翀, 马徐发, 等. 基于周丛藻类群落结构的新疆额尔齐斯河生态健康评价[J]. 生态学报, 2022, 42(2): 778-790. [8] 张亚军, 秦秀东, 李恩军, 等. 基于浮游生物完整性指数的不同循环饥饿投饲模式黄颡鱼养殖塘水质评价[J]. 南方农业学报, 2020, 51(7): 1754-1763. [9] 刘园园, 阿依巧丽, 张森瑞, 等. 着生藻类和浮游藻类在三峡库区河流健康评价中的适宜性比较研究[J]. 生态学报, 2020, 40(11): 3833-3843. [10] 谢孟星, 钱新, 刘彤, 等. 基于微生物完整性指数的河流健康评价——以无锡市为例[J]. 环境科学学报, 2020, 40(3): 1112-1120. [11] 董贯仓, 冷春梅, 丛旭日, 等. 南水北调东线工程运行3年后东平湖浮游植物群落特征及环境驱动因子[J]. 湖泊科学, 2022, 34(1): 61-73. [12] BAEK S H, SON M, KIM D, et al. Assessing the ecosystem health status of Korea Gwangyang and Jinhae bays based on a planktonic index of biotic integrity (P-IBI)[J]. Ocean Sci J, 2014, 49(3): 291-311.
[13] WU N, SCHMALZ B, FOHRER N. Development and testing of a phytoplankton index of biotic integrity (P-IBI) for a German lowland river[J]. Ecol Indic, 2012, 13(1): 158-167.
[14] 顾毓蓉, 薛庆举, 万翔, 等. 基于P-IBI因子分析法评价生态修复后松雅湖水生态状况[J]. 应用与环境生物学报, 2020, 26(6): 1325-1334. [15] 黎明民, 骆鑫, 付家想, 等. 基于浮游植物生物完整性的北部湾生态健康评价[J]. 中国环境监测, 2018, 34(6): 113-121. [16] KRUK C, SEGURA A M. The habitat template of phytoplankton morphology-based functional groups[J]. Hydrobiologia, 2012, 698: 191-202.
[17] SALMASO N, NASELLI-FLORES L, PADISAK J. Functional classifications and their application in phytoplankton ecology[J]. Freshw Biol, 2015, 60(4): 603-619.
[18] 郭芳, 顾继光, 赵剑, 等. 类群划分方法对南亚热带水库夏季浮游植物群落与环境响应关系的影响[J]. 环境科学, 2020, 41(11): 5050-5059. [19] 尚聪聪, 肖慧, 朱琳, 等. 海州湾大竹蛏种质资源保护区生态环境质量分析与评价[J]. 渔业科学进展, 2021, 42(1): 11-17. [20] 邱阳凌, 林育青, 刘俊杰, 等. 淮河干流及主要支流夏季浮游植物群落生物多样性评价[J]. 环境科学学报, 2018, 38(4): 1665-1672. [21] 陈豪, 左其亭, 张永勇, 等. 淮河中上游浮游植物群落结构特征及营养状况评价[J]. 中国农村水利水电, 2019(2): 1-6, 10. [22] 赵秀侠, 侯冠军, 李静, 等. 2015年淮河干流安徽段浮游植物群落结构特征[J]. 湿地科学, 2017, 15(4): 497-504. [23] 周宇建, 张永勇, 花瑞祥, 等. 淮河中上游浮游植物时空分布特征及关键环境影响因子识别[J]. 地理研究, 2016, 35(9): 1626-1636. [24] 吕海深, 丁然, 朱永华. 淮河流域闸坝对径流量的影响分析[J]. 中国农村水利水电, 2020(4): 166-171,176. [25] 章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1995: 18-356. [26] 周凤霞. 淡水微型生物与底栖动物图谱[M]. 北京: 化学工业出版社, 2011: 37-187. [27] 胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态[M]. 北京: 科学出版社, 2006: 23-903. [28] 郭雯, 赵俞廷, 黎宇洋, 等. 红枫湖营养水平及其历史演化趋势[J]. 生态学杂志, 2020, 39(10): 3371-3378. [29] 汪琪, 黄蔚, 陈开宁, 等. 大溪水库浮游植物群落结构特征及营养状态评价[J]. 环境科学学报, 2020, 40(4): 1286-1297. [30] 王备新. 大型底栖无脊椎动物水质生物评价研究[D]. 南京: 南京农业大学, 2003: 86-89. [31] 蔡琨, 秦春燕, 李继影, 等. 基于浮游植物生物完整性指数的湖泊生态系统评价——以2012年冬季太湖为例[J]. 生态学报, 2016, 36(5): 1431-1441. [32] 肖善势, 郝雅宾, 刘金殿, 等. 应用生物完整性指数评价钱塘江流域—浙江段水生态系统健康[J]. 水产科学, 2021, 40(5): 740-749. [33] 张辉, 彭宇琼, 邹贤妮, 等. 新丰江水库浮游植物功能分组特征及其与环境因子的关系[J]. 中国环境科学, 2022, 42(1): 380-392. [34] 李璇, 王莲, 马卫星, 等. 不同河道型微污染水源预处理工程水质净化效能及水质稳定性评价[J]. 环境科学学报, 2020, 40(8): 2771-2784. [35] 胡韧, 蓝于倩, 肖利娟, 等. 淡水浮游植物功能群的概念、划分方法和应用[J]. 湖泊科学, 2015, 27(1): 11-23. [36] 杨毓. 西安地区湖库藻类演替特征及控藻与避藻技术的研究[D]. 西安: 西安建筑科技大学, 2017: 30-31. [37] 胡月敏. 浮游植物对高原水库水环境的指示及影响藻类生长的氮磷限制研究[D]. 贵州: 贵州师范大学, 2018: 32-33. [38] 刘凌, 朱燕, 李博韬, 等. 基于MBFG分类法的长江江苏段浮游植物生物完整性评价[J]. 水资源保护, 2020, 36(4): 13-20. [39] 郑晓宇, 顾詠洁, 金妍, 等. 不同氮、磷质量浓度下四尾栅藻的生长研究[J]. 生态环境学报, 2010, 19(11): 2663-2668. [40] 赵长森, 夏军, 王纲胜, 等. 淮河流域水生态环境现状评价与分析[J]. 环境工程学报, 2008(12): 1698-1704. [41] 何保, 燕亚东, 余苇, 等. 河流交汇口河床地貌演变研究进展[J]. 水资源保护, 2018, 34(6): 17-23. [42] 米潭, 姚建. Y型河流交汇区污染物扩散模拟研究[J]. 环境科学与技术, 2020, 43(11): 9-16. [43] 田鹏, 钱昶, 林佳宁, 等. 滦河流域大型底栖动物生物完整性指数健康评价[J]. 中国环境监测, 2019, 35(4): 50-58. -
期刊类型引用(10)
1. 衣帆,王娇,刘航,陈静,陈琳琳,李晓静,李学鹏,李宝泉. 烟台长岛秋季海洋牧场内外大型底栖动物群落特征分析. 海洋学报. 2024(05): 57-67 .  百度学术
百度学术
2. 袁华荣,章守宇,陈丕茂. 海洋牧场建设效益评价研究进展与展望. 南方水产科学. 2024(05): 1-13 .  本站查看
本站查看
3. 张启宇,张文博,郑奕,陈英义,何锦辉. 基于CiteSpace分析的国内海洋牧场研究进展. 农业工程. 2024(11): 65-73 .  百度学术
百度学术
4. 马文刚,夏景全,魏一凡,尹洪洋,覃乐政,刘相波,胡雪晴,许强,李秀保,王爱民. 三亚蜈支洲岛海洋牧场近岛区底表大型底栖动物群落结构及评价. 热带海洋学报. 2022(03): 135-146 .  百度学术
百度学术
5. 张亚洲,蒋日进,梁君. 嵊泗马鞍列岛海域国家级海洋牧场渔业资源增殖养护效果评析. 浙江海洋大学学报(自然科学版). 2022(05): 466-472 .  百度学术
百度学术
6. 许双杰,高源. 中国海洋牧场发展潜力的时空差异分析. 海洋经济. 2022(06): 64-73 .  百度学术
百度学术
7. 刘伟峰,刘大海,管松,姜伟. 海洋牧场生态效益的内涵与提升路径. 中国环境管理. 2021(02): 33-38+54 .  百度学术
百度学术
8. 王书献,张胜茂,戴阳,王永进,隋江华,朱文斌. 利用声呐数据提取磷虾捕捞深度方法研究. 南方水产科学. 2021(04): 91-97 .  本站查看
本站查看
9. 裴琨,吴一桂,杨润琼. 中国最早的人工鱼礁试验地——防城港市白龙珍珠湾海洋牧场人工鱼礁建设概述. 河北渔业. 2020(06): 22-27+63 .  百度学术
百度学术
10. 吴程宏,张羽翔,赵海龙,陈敏,刘维,林国尧. 海南文昌冯家湾人工鱼礁区渔业资源养护效果初步评估. 海洋湖沼通报. 2020(06): 158-167 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:









 粤公网安备 44010502001741号
粤公网安备 44010502001741号
