Effects of two breeding methods on growth and bacterial structure of Nitzschia closterium f. minutissima
-
摘要:
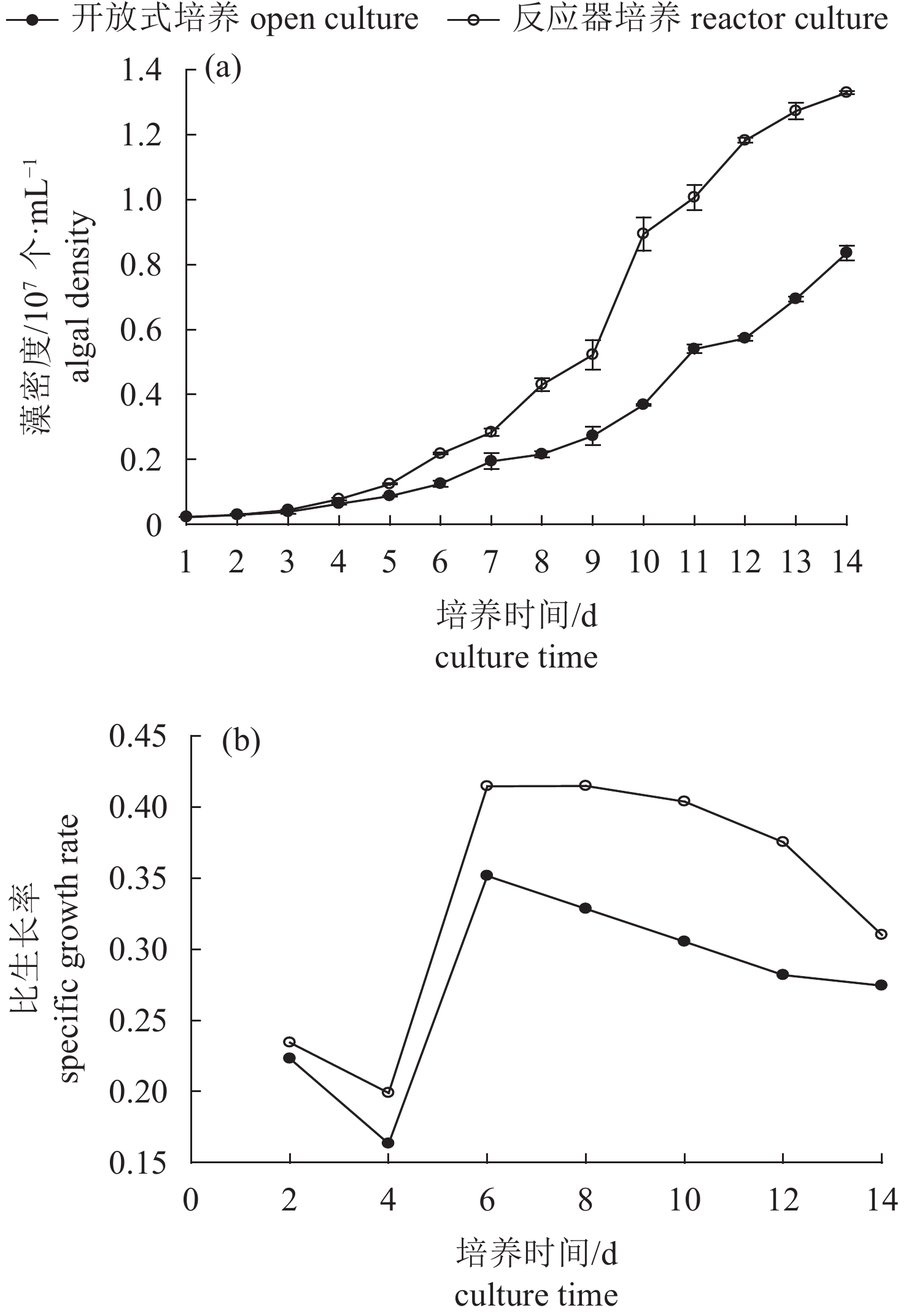
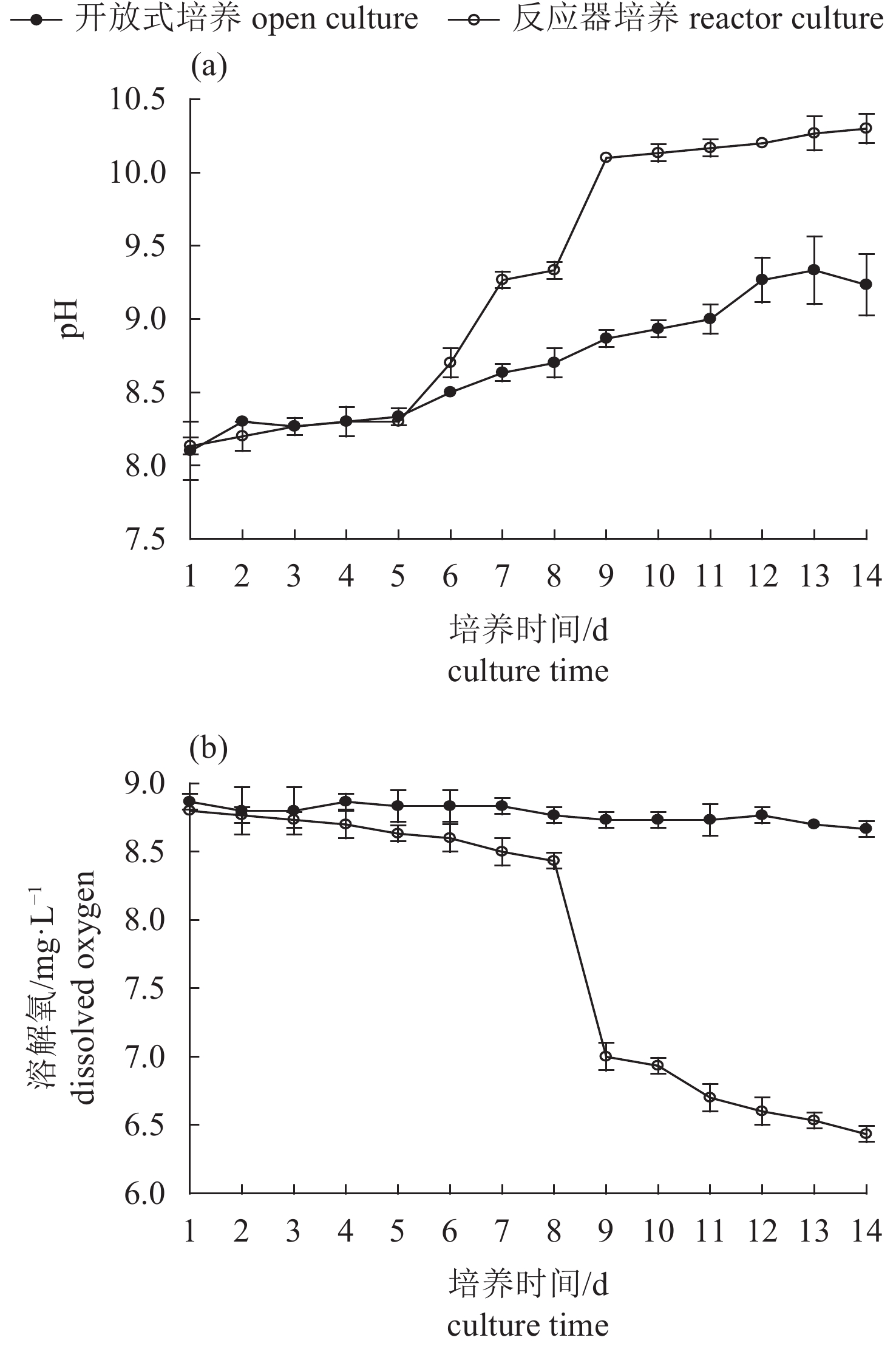
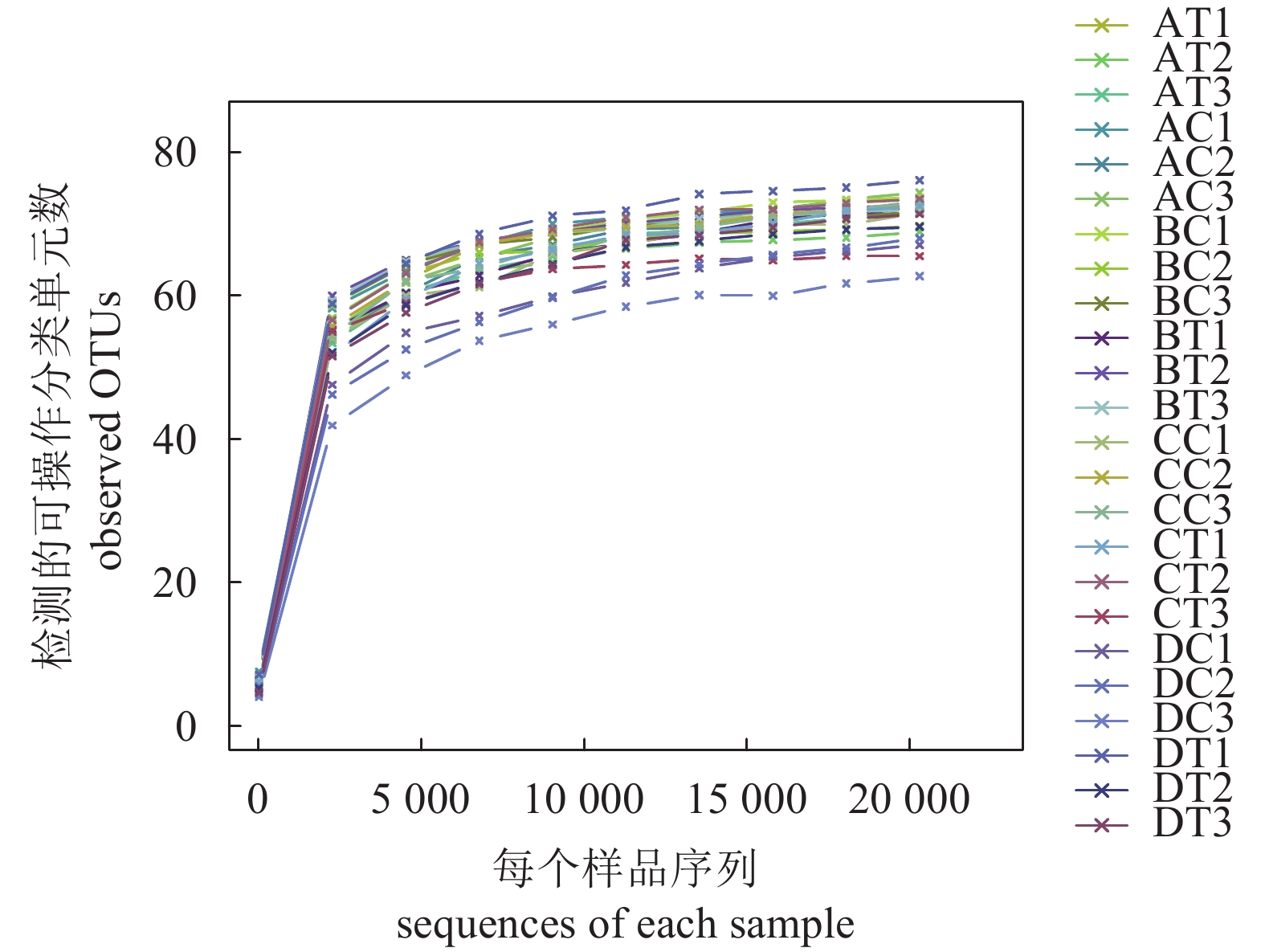
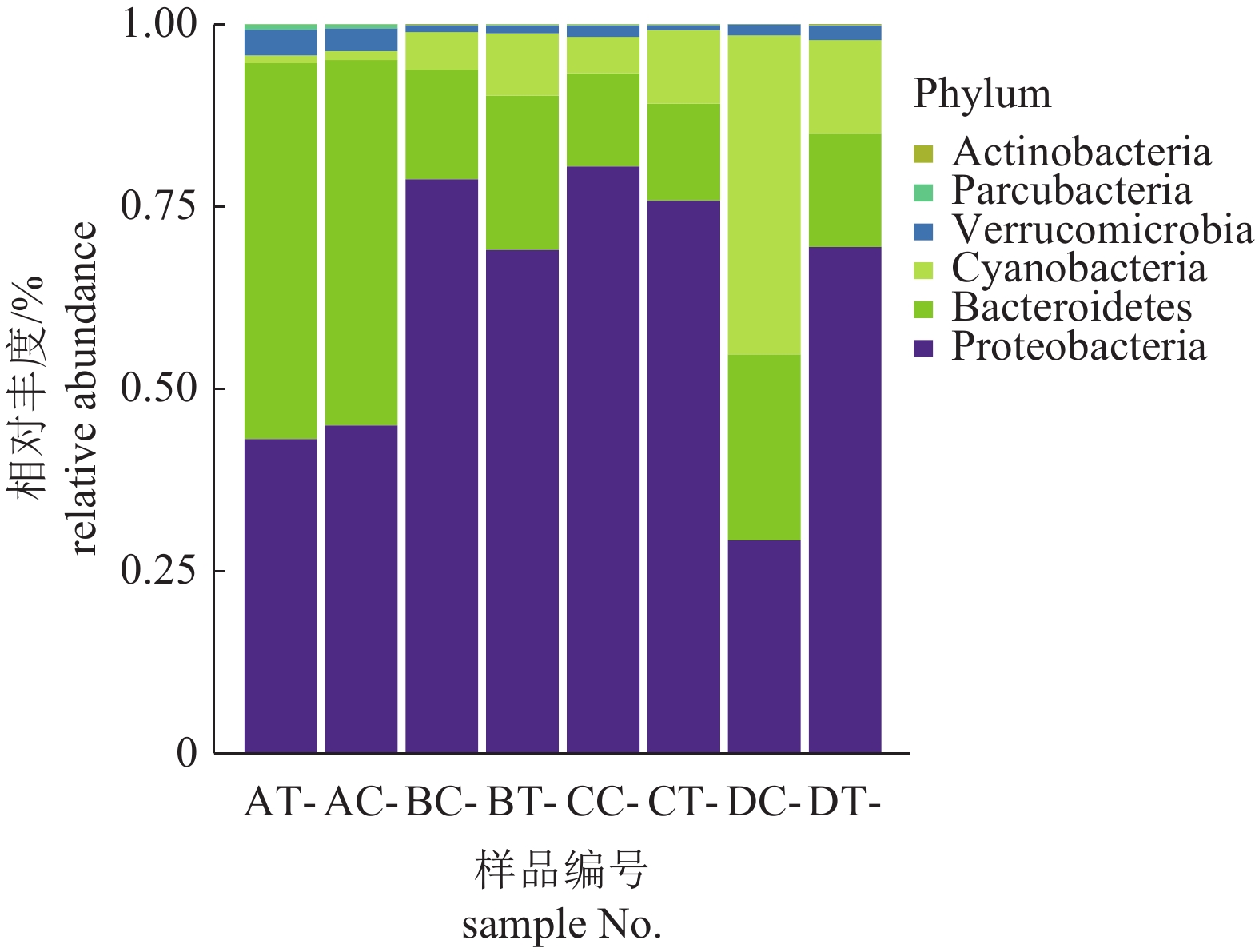
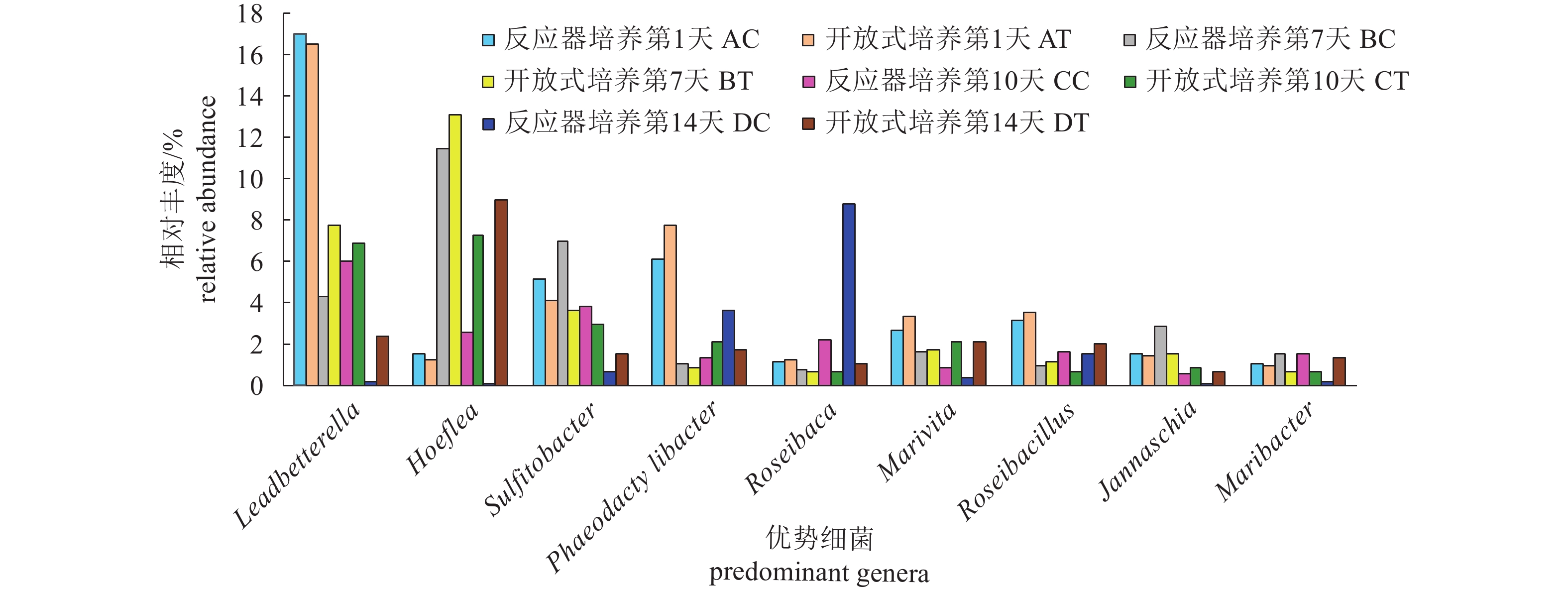
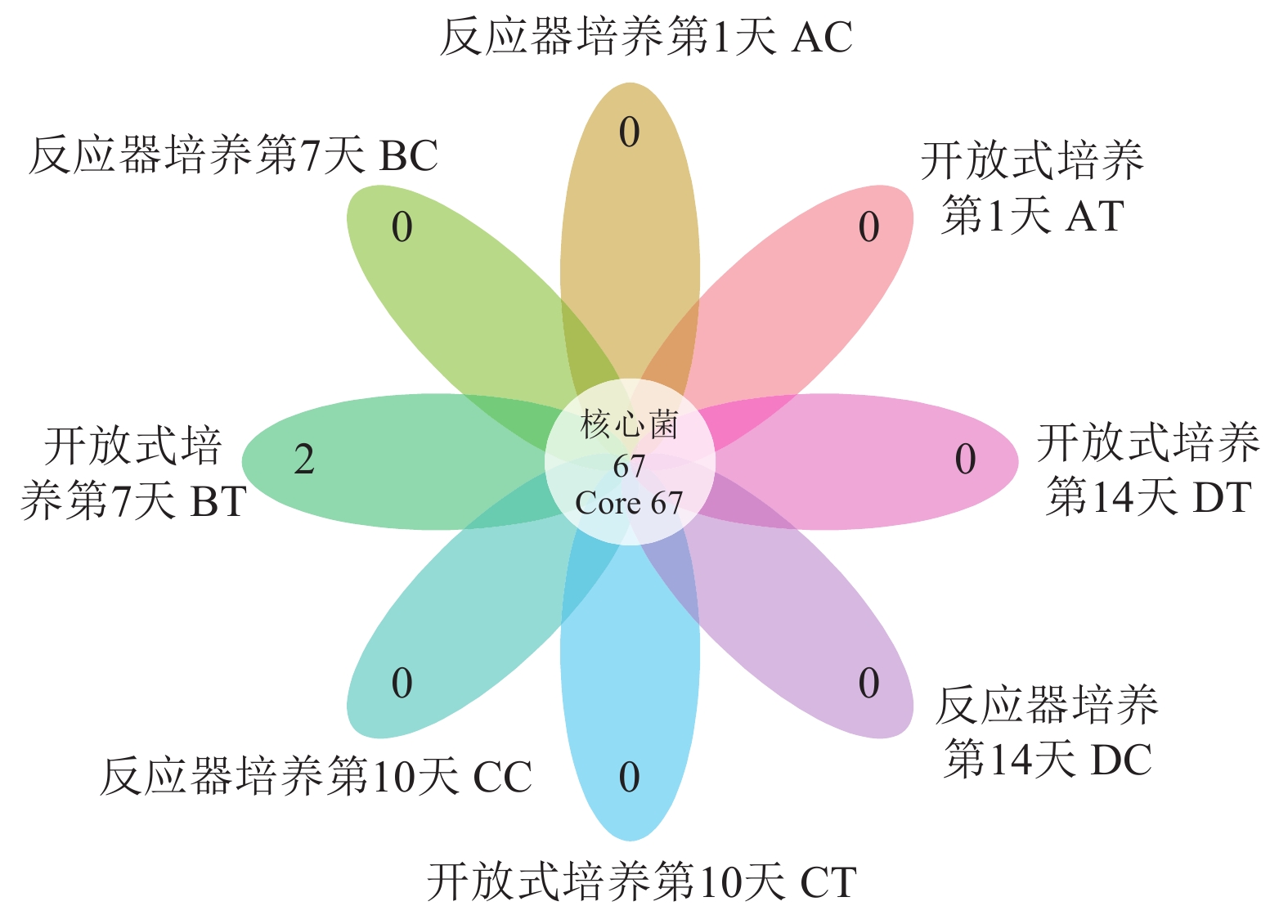
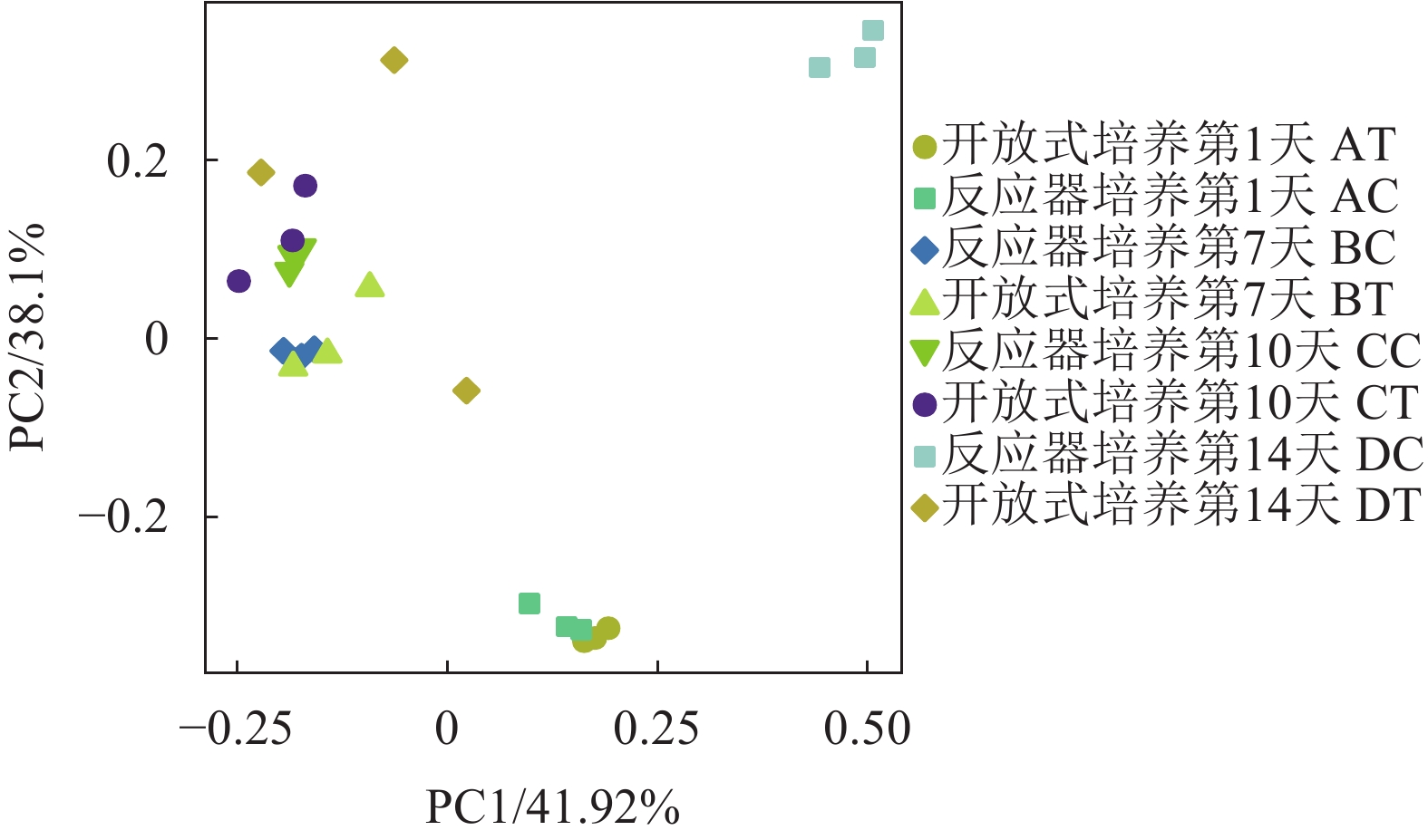
文章以小新月菱形藻 (Nitzschia closterium f. minutissima)为研究对象,分析比较了小新月菱形藻在负压光生物反应器与开放式桶培养下,藻密度、pH、溶解氧及菌落结构的变化情况。结果表明,在负压光生物反应器培养下的藻密度可达到1.33×107个·mL–1,明显高于开放式培养的藻密度 (8.36×106个·mL–1)。藻液中pH随藻密度增加而升高,两者呈显著正相关 (P<0.01),在负压光生物反应器及开放式培养环境中pH最高值分别为10.3和9.3。溶解氧与pH变化趋势相反,在负压光生物反应器内溶解氧随藻密度增加而降低,最后稳定在6.5 mg·L–1,溶解氧的下降可能与玫瑰杆菌 (Roseobacter)成为优势细菌有关。利用16S rDNA基因的高通量测序技术,分析在培养过程中藻际菌群的结构变化,发现菌落的多样性显著下降 (P<0.05),培养前期主要以变形杆菌 (Proteobacteria)和拟杆菌 (Bacteroidetes)为优势细菌,在负压光生物反应器内培养后期主要以蓝细菌 (Cyanobacteria)与玫瑰杆菌为优势细菌,其菌落结构与开放式桶存在明显差异。
Abstract:We compared the density, pH, dissolved oxygen and colony structure of Nitzschia closterium f. minutissima bred in negative pressure photobioreactor and open bucket, respectively. It is shown that the algae grew fast in negative pressure photobioreactor with the highest density of 1.33×107 cells·mL–1, significantly higher than that in open bucket (8.36×106 cells·mL–1). The pH in algal solution increased with increase of algal density, and there was a significant positive correlation between them (P<0.01). The highest pH values in negative pressure photobioreactor and open bucket were 10.3 and 9.3, respectively. Oppositely, in negative pressure photobioreactor, the dissolve oxygen of algea decreased with increase of algal density, which finally stabilized at about 6.5 mg·L–1. The decline of dissolved oxygen might be related to the fact that Roseobacter had become the dominant bacteria. Results of 16S rDNA gene high-throughput sequencing show that the bacterial diversity decreased significantly (P<0.05). Proteobacteria and Bacteroidetes were dominant bacteria at early stage of breeding. However, the dominant bacteria were Cyanobacteria and Roseobacter at late stage in negative pressure photobioreactor, which was obviously different from that in open bucket.
-
陆源性营养盐的输入导致地表水富营养化状况加剧已成为世界各国首要的环境污染问题。营养盐输入与有害藻类水华爆发的相关关系也有相关的综述报道,近20年来的有害藻类水华在富营养化水域生态系统中的发生频率、规模和危害程度呈愈演愈烈的趋势[1-5]。有害藻类水华不仅显著降低了水体的水质状况,而且对水生生物的多样性产生严重的负面影响[6]。氮(N)和磷(P)是藻类生长的主要限制因子这一观点已得到绝大多数研究者认同[7]。水体中的氮磷营养盐浓度通常作为判定藻类生长是否受到限制及限制水平的重要指标,同时也广泛用于预测藻类种群密度和群落的演化趋势分析[2, 8]。尽管氮元素是浮游植物正常生长所需的必要大量元素,然而,多数湖泊的氮浓度情况已达到富营养化水平。因此,磷营养盐的浓度状况往往成为湖泊中有害藻类水华爆发的限制因子[9-11]。根据Redfield理论,藻类生长所需的氮磷原子比率为16:1,然而,不同种类的微藻对营养物质的需求不尽相同,且存在不同程度的生理适应过程[12-14]。因此,水体环境质量变化尤其是富营养化的过程也是微藻群落演替格局的重建,即生长迅速且具有高适应性能力的微藻逐渐成为新环境条件下的优势种群的过程。
近年来的研究表明水体的富营养化状态也存在着相对的氮或磷限制,且这种特殊的氮磷限制存在时空变化。同一水体中氮、磷营养盐限制会出现局部区域差异和季节性交替变化[15]。氮磷营养盐的种类(硝酸盐、亚硝酸盐、铵盐、尿素等)、形态(无机、有机)等因素对藻类的生长、分布以及生理生态学特征也表现出显著的影响[16]。氮磷营养盐限制对微藻生长的影响研究已广泛开展,尤其是在微囊藻为主要水华种类的淡水生态系统中。淡水微藻种间的生理适应性以及生长特征也随富营养化条件的变化而表现出不同的差异[12-14]。氮、磷浓度的变化可以诱导某些生理过程的转变以促使某些种类微藻的快速增长进而获得种间竞争的优势[12, 17]。惠氏微囊藻(Microcystis wesenbergii)是淡水水体中常见的水华种类,其在不同营养盐条件下的生长和生理相应特征研究鲜有报道,氮或磷营养盐极端限制条件下的生长和生理响应尚未见报道。斜生栅藻(Scenedesmus obliquus)作为淡水生态系统中最常见的绿藻种类,与微囊藻一起被广泛用于环境理化因子变化与藻类群落演替响应机制的研究[18-20]。因此该研究尝试揭示不同氮磷起始条件下惠氏微囊藻和斜生栅藻的种群增长和生理响应差异,进而为水体富营养化过程中惠氏微囊藻生长和水华形成提供理论支撑。
1. 材料与方法
1.1 实验藻种
实验藻种为惠氏微囊藻和斜生栅藻。微藻采用BG-11培养基培养,并置于人工气候培养箱(CC275TL-2H,Xutemp)中静置培养,每天摇瓶3次。培养条件设定为温度(23±1)℃,光照强度约为4 000 lx,光周期为12L:12D。
1.2 实验方法
1)微藻的预培养实验。将指数生长期的微藻浓缩收集并接种到未添加氮磷营养盐的BG-11培养基中,预培养时间为4 d,通过预培养阶段消耗藻细胞内储存的氮磷营养盐。
2)不同氮磷浓度下微藻的种群增长实验。氮磷饥饿预培养后的微藻进行离心浓缩,收集藻细胞并接种到不同起始浓度的氮或磷培养液中,氮磷起始浓度和氮磷比设置详见表 1。以BG-11培养基作为对照组,其N/P原子数比为60.69。微藻的培养采用500 mL三角瓶,藻液体积为300 mL,每组3个平行。斜生栅藻起始细胞密度约为8.11×105 个·mL-1,惠氏微囊藻起始细胞密度约为1.82×106 个·mL-1。
表 1 氮磷浓度对微藻生长影响实验的浓度设置Table 1. Concentration of nitrogen and phosphorus组别group 磷浓度/μmol·L-1
Cp (N/P)氮磷比-磷(rP) 组别group 氮浓度/μmol·L-1 CN (N/P) 氮磷比-氮(rN) 对照control 17.6/0.29 60.69 对照control 17.6/0.29 60.69 1/2对照1/2 control 8.8/0.145 60.69 1/2对照1/2 control 8.8/0.145 60.69 N-1/2P 17.6/0.145 121.38 1/2N-P 8.8/0.29 30.34 N-1/8P 17.6/0.036 485.52 1/8N-P 2.2/0.29 7.59 N-1/50P 17.6/0.005 8 3 034.5 1/50N-P 0.352/0.29 1.21 N-1/100P 17.6/0.002 9 6 069 1/100N-P 0.176/0.29 0.61 3)测定指标。隔天取10 mL藻液到玻璃管(Schott Duran,德国)中,并添加25 mL蒸馏水稀释后测定叶绿素a浓度。叶绿素测定采用叶绿素荧光仪(TD-700 Fluorometer,TURANER DESIGNS)进行,测定前遮光黑暗处理20 min。并在培养11 d后计数测定细胞密度和干质量。细胞密度和干质量的测定方法参考文献[21]。
微藻的比生长速率μ=(lnRt-lnR0)/T,Rt为实验终点细胞密度;R0为起始细胞密度;T为2次测定间隔时间(该实验选取第11天计算)。
1.3 数据统计与分析
实验数据采用Origin 8.0整理和制图,并进行藻类生长参数与氮磷浓度以及氮磷比的相关性分析和曲线拟合。氮、磷浓度对藻类的最大限制效应根据不同氮磷浓度处理组的生长指标(比生长速率、生物量、叶绿素浓度)的最小值与BG-11培养基对照组中相应指标的比值计算获得。实验组之间的差异显著性分析采用SPSS 13.0软件包进行,以单因素方差分析(One-Way ANOVA)法来检验处理组间的差异性,P<0.05和P<0.01分别表示显著和极其显著水平。
2. 结果与分析
2.1 不同氮磷起始浓度下微藻的比生长速率
不同氮磷起始浓度对惠氏微囊藻细胞比生长速率的影响见图 1。不同氮起始浓度对惠氏微囊藻比生长速率并未表现出显著的影响,仅1/2对照组比生长速率显著高于对照组(P<0.05),其余各氮起始浓度下的比生长速率与完全对照组无显著差异(P>0.05)。不同磷起始浓度对惠氏微囊藻比生长速率影响仅在低磷浓度(1/100)处理组表现出显著的抑制效应(P<0.05),而1/2对照组比生长速率显著高于对照组(P<0.05)。
不同氮磷起始浓度对斜生栅藻细胞比生长速率的影响见图 2。低氮起始浓度(<1/8)处理组比生长速率仅为完全对照组的75%和61%,表现出显著的抑制效应(P<0.05)。低磷起始浓度(<1/2)组比生长速率仅为完全对照组的95%、85%和77%,其余氮磷起始浓度下的比生长速率与完全对照组无显著差异(P>0.05)。
2.2 不同氮磷起始浓度下微藻的生物量
不同氮磷起始浓度对惠氏微囊藻和斜生栅藻生物量的影响见表 2。不同氮起始浓度处理组惠氏微囊藻生物量无显著的差异,仅1/2对照组生物量比完全对照组增加了25%。低磷浓度(1/100)处理组生物量仅为完全对照组的89%,表现出显著的抑制效应(P<0.05),而1/2对照组生物量显著高于对照组(P<0.05)。
表 2 不同氮磷起始浓度下微藻的生物量Table 2. Effect of nitrogen/phosphorus concentration on biomass of algaemg·L-1 组别group 惠氏微囊藻(M.wesenbergii) 斜生栅藻(S.obliquus) 对照control 161±5.9 472±6.2 1/2对照1/2 control 201±6.8* 531±9.5* N-1/2P 168±7.7 494±17.5 N-1/8P 158±10.7 422±23.4* N-1/50P 162±1.7 292±10.3** N-1/100P 143±3.1* 238±18.6** 1/2N-P 163±4.5 538±31.9* 1/8N-P 164±1.1 507±31.1 1/50N-P 162±1.0 261±24.3** 1/100N-P 157±1.1 195±6.4** 注:对照组为正常BG-11培养基;数字代表实验组氮或磷浓度与对照组浓度的比值;N.硝酸盐;P.磷酸盐;*.显著性相关(P<0.05);**.极显著性相关(P<0.01)
Note:The control treatment used BG-11 medium;the numbers represent the ratio of N or P concentration in different treatments compared with that of control;N. nitrate;P. phosphate;*. significant difference at 0.05 level (P<0.05);**. very significant difference at 0.01 level (P<0.01)不同氮起始浓度处理组斜生栅藻生物量表现出先增加后降低的趋势,1/2对照组、1/2和1/8氮处理组生物量比完全对照组分别增加了12%、14%和7%,而低氮浓度处理组(1/50和1/100)生物量则比完全对照组降低了45%和59%,表现出极显著的抑制效应(P<0.01)。不同磷浓度处理组生物量也表现出先增加后降低的趋势,1/2对照组、1/2磷处理组生物量比完全对照组分别增加了12%和5%,而低磷浓度处理组(1/8、1/50和1/100)生物量则比完全对照组降低了11%、38%和50%,表现出显著的抑制效应(P<0.05)。
2.3 不同氮磷起始浓度下微藻的叶绿素a浓度
氮磷起始浓度变化对惠氏微囊藻和斜生栅藻生长的影响见图 3。惠氏微囊藻在不同氮起始浓度下的生长均显著低于完全对照组,但与1/2对照组的生长无显著差异(P>0.05)。不同磷起始浓度下的生长也表现出类似的趋势,完全对照组微藻生长状况最佳,而低磷浓度(1/100)下生长表现出显著的抑制现象(P<0.05),其余磷浓度处理组间生长差异不显著。斜生栅藻在低氮起始浓度下(<1/8)的生长在第8天显著降低。与完全对照组相比,起始氮浓度的降低促进了藻类的叶绿素a浓度增加,起始氮浓度1/2、1/8、1/50处理组在第11天时叶绿素a浓度比对照组分别增加了29%、23%和3%,第14天时分别增加了61%、52%和59%。磷起始浓度与斜生栅藻的生长呈正相关关系,随着起始磷浓度增加,斜生栅藻的叶绿素a浓度显著增加。与完全对照组相比,1/2对照组的叶绿素a浓度在第11和第14天分别增加了29%和18%。
2.4 氮磷起始浓度与微藻生长指标的相关关系
氮磷起始浓度、氮磷比与2种受试微藻的比生长速率、生物量的相关关系分析见表 3和表 4。磷浓度与2种微藻的生物量之间的相关关系均可用指数型方程进行拟合,且呈极显著的正相关关系。磷浓度降低导致的氮磷比增加与2种微藻的比生长速率之间符合线性拟合方程特征,且呈显著的负相关关系。磷浓度降低导致的氮磷比增加与生物量之间也呈显著的线性负相关关系。氮浓度与2种微藻的生物量之间的相关关系符合指数型方程拟合特征,呈极显著的正相关关系。
表 3 氮磷浓度、氮磷比与惠氏微囊藻微藻比生长速率和生物量的相关关系拟合曲线Table 3. Relationship between initial nitrogen, phosphorus concentration and growth rate, biomass of M.wesenbergii方程equation 指标index 关系式relations 线性方程linear 氮磷比-磷rp 比生长速率μ=-5.22×10-6rP+0.21,R2=0.744 8,P=0.038 指数方程exponential 磷浓度Cp 干质量DW=-2 239.48×e(-Cp/0.000 59)+160.46,R2=0.967 4,P<0.01 线性方程linear 氮磷比-磷rp 干质量DW=-0.003 2r+163.21,R2=0.824 6,P=0.021 指数方程exponential 氮浓度CN 干质量DW=-76.07×e(-CN/0.07)+163.17,R2=0.721 5,P<0.01 指数方程exponential 氮磷比-氮rN 干质量DW=-79.31×e(-rN/0.24)+163.21,R2=-0.761 2, P<0.01 注:CN和CP表示实验设计的氮或磷浓度;rN和rP表示实验设计的氮或磷浓度变化产生的氮磷比检验;后表同此。
Note:CN and CP represent concentrations of nitrate and phosphate,respectively;rN and rP represent the N/P ratio varied with nitrate and phosphate,respectively;the same case in the following table.表 4 氮磷浓度、氮磷比与斜生栅藻比生长速率和生物量的相关关系拟合曲线Table 4. Relationship between initial nitrogen, phosphorus concentration and growth rate, biomass of S.obliquus方程equation 指标index 关系式relations 指数方程exponential 磷浓度Cp 比生长速率μ=-0.12×e(-CP/0.006 7)+0.35,R2=0.902 3,P=1 线性方程linear 氮磷比-磷rp 比生长速率μ=-1.55×10-5rP+0.35,R2=0.908 9,P<0.01 指数方程exponential 磷浓度Cp 干质量DW=-291×e(-CP/0.012 3)+472,R2=0.990 6,P<0.01 线性方程linear 氮磷比-磷rp 干质量DW=-0.049rP+474.94,R2=0.931 6,P<0.01 指数方程exponential 氮浓度CN 比生长速率μ=-0.17×e(-CN/0.692)+0.35,R2=0.994 1,P=1 指数方程exponential 氮磷比-氮rN 比生长速率μ=-0.17×e(-rN/2.382)+0.35,R2=0.940 0,P=1 指数方程exponential 氮浓度CN 干质量DW=-385.77×e(-CN/0.532)+472.00,R2=0.995 7,P<0.01 指数方程exponential 氮磷比-氮rN 干质量DW=-387.37×e(-rN/1.820)+472.00,R2=-0.996 1,P<0.01 3. 讨论
3.1 氮磷起始浓度对微藻生长的影响
氮磷起始浓度、形态、氮源组合方式等对微藻生长的影响研究已有大量报道[11-13, 15]。氮磷浓度与藻细胞生长速率往往呈正相关关系。然而,氮磷浓度过高或过低均对藻细胞生长表现出显著的抑制效应,高浓度的氮源(硝酸盐)对铜绿微囊藻(M.aeruginosa)的生长呈显著的毒性抑制效应(>2 mg·L-1),磷质量浓度超过0.07 mg·L-1,铜绿微囊藻细胞密度表现出显著的抑制效应[18, 22]。该研究结果表明,一定浓度范围内氮磷营养盐含量增加,2种藻的生长指标均呈增加的趋势。但超过适宜浓度的氮磷(过高或过低)均抑制了藻类的生长。抑制效应强弱在不同指标之间存在较显著差异。氮磷浓度变化与比生长速率和生物量的相关关系分析进一步阐明了氮磷浓度与藻类生长之间具有线性相关或指数型相关关系。然而,也发现2种受试微藻的某些生长指标与氮磷浓度间的相关关系并不显著,这一现象主要成因可能是藻类生长过程中对氮磷的吸收和利用的某些特性造成的,如氮限制能够促进蓝藻门铜绿微囊藻的细胞分裂,缩短细胞生长周期[14],且铜绿微囊藻的氮磷营养吸收动力学过程受起始氮磷浓度影响显著[22-23],藻类对磷酸盐的吸收利用存在储存和形态转化等过程[11, 22],以及微囊藻存在对磷酸盐的快速吸收和转化利用高亲和力结合蛋白和特殊的碱性磷酸酶等[24-25]。
氮磷起始浓度变化也导致了培养液中氮磷比的变化,传统的研究认为微藻生长适宜的氮磷原子比率是16:1,氮磷比超过或低于一定的比值下,往往被认为存在磷或氮的限制。有研究者通过对比世界范围内的17个湖泊蓝藻生长与平均总氮(TN)/总磷(TP)的响应规律发现,当TN/TP(质量比)小于29时,蓝藻更易成为优势种;相反,TN/TP大于29时,蓝藻种群数目呈减少的趋势[26]。该研究中斜生栅藻生长速率、生物量和叶绿素a浓度在氮磷比介于30和121之间时表现出一定的促进效应,但随着氮磷比的增加或降低,斜生栅藻受到的抑制效应显著增加。磷源充足条件下,惠氏微囊藻对氮磷比的变化响应不敏感,氮磷比降低(<30)各处理组间生长速率、叶绿素浓度等与对照组无显著差异。同时,氮磷比增加(>3 034)时,生长速率和叶绿素浓度显著低于对照组。这一结果在其他研究中也得到证实,微囊藻水华往往更容易受磷营养盐浓度的限制[8]。起始氮磷浓度降低,惠氏微囊藻的比生长速率和生物量受到的抑制效应显著低于斜生栅藻,这一生长特征更有利于惠氏微囊藻在氮磷营养盐缺乏或限制的条件下成为优势种。微囊藻与绿藻对氮磷浓度的响应和吸收在其他研究中也有相关的报道,铜绿微囊藻在氮限制下的生长速率显著高于斜生栅藻或羊角月牙藻(Selenastrum carpriconutum),且某些微囊藻的固氮作用能够显著促进微囊藻在氮限制条件下成为优势种[13]。
3.2 微藻对氮磷比变化的响应对微藻种间竞争的潜在影响
氮磷比变化常常被用来判定水域生态系统中某些种类微藻水华的预警,而营养盐的限制性排放也被认为是控制藻类水华的重要措施。微囊藻水华与营养盐变化的实验室内研究表明,营养盐充分情况下,绿藻门四尾栅藻(S.quadricauda)更容易成为优势种,而营养盐相对较低的条件下,蓝藻门铜绿微囊藻更容易成为优势种[19]。氮磷比为3.84~307.06时,水华微囊藻和四尾栅藻随着氮磷比的降低,最大生物量和增长率均呈增加的趋势,而蓝纤维藻(Dactylococcopsis sp.)的增长率在氮磷比接近Redfield比值时最高,小球藻(Chlorella sp.)的最大生长率在接近或低于Redfield比值时最高[20]。该研究的结果表明,氮或磷单一营养盐充足条件下,即使氮磷比存在显著的抑制现象(N/P<7.59或N/P>121.38)惠氏微囊藻仍能够维持较高的生长速率,而斜生栅藻的生长则表现出了显著的抑制现象。这一研究结果进一步证实了微囊藻属在营养盐利用上的特性是其成为竞争优势种的重要条件。
氮或磷营养盐单一因素丰富条件下,营养盐的改变也能够诱导或促使蓝藻成为优势种,从而改变水体浮游植物的群落结构。安大略湖的营养盐操纵实验证明,降低氮肥或只增加磷肥导致的氮磷比降低诱导了固氮蓝藻鱼腥藻(Anabaena sp.)和束丝藻(Aphanizomenon sp.)的大量增长[27]。河流水体对中等营养状态的Tega水库中磷酸盐的季节性稀释作用导致了铜绿微囊藻的爆发从而取代硅藻的小环藻属(Cyclotella)种类成为优势种,且铜绿微囊藻在水体氮磷比显著高于29条件下仍然能够维持其优势种地位[10]。武汉东湖微囊藻水华的围隔实验同样表明微囊藻水华不仅在氮磷比<29的水体中爆发,而且在氮磷比>29条件下仍然发生[8]。与其他研究相比,氮磷限制对该研究中惠氏微囊藻生长的限制作用显著低于水华微囊藻(M.flosaquae),这一结果也进一步证实了华南城市小型富营养化湖泊、池塘水体中惠氏微囊藻成为主要水华种类的重要原因。同时,该研究进一步证实了中等或富营养化水体中氮磷比的变化情况不能直接作为微囊藻水华的评判标准,还应关注其营养盐的浓度和水体中微囊藻的种类分布状况。
文章通过对比分离自同一水体的惠氏微囊藻和斜生栅藻在不同氮磷起始浓度下的生长和生理响应,探讨惠氏微囊藻水华爆发的生理学机制。氮或磷单一营养盐处于富营养状态时,增加磷或氮营养盐的限制,惠氏微囊藻的生长均能够维持较高的生长速率,而斜生栅藻则表现出抑制效应。氮磷营养盐处于超富营养状态下,惠氏微囊藻和斜生栅藻的生长均表现出抑制效应。与斜生栅藻相比,惠氏微囊藻对氮、磷限制的低敏感性是其获得种间竞争优势的生理学基础,也是其爆发水华的必要条件。
-
表 1 负压反应器内部参数
Table 1 Internal parameters of negative pressure photobioreactor
直流电压/V
DC voltage负载电流/A
load current功率/W
power流量/L·min−1 flow 相对真空度/kPa
relative vacuum峰值流量 平均流量 24 <0.8 <19.2 20 13 ≈ −60 表 2 不同培养环境藻液菌群α多样性指数比较
Table 2 α diversity index of microflora in algae solution in different breeding environments
组别
treatment多度涵盖估计量
Ace丰富度
Chao1香农指数
Shannon辛普森指数
Simpson开放式培养
open culture第1天 AT 71.9±2.21 71.6±1.18 4.23±0.08a 0.91±0.01a 第7天 BT 75.5±3.57 76.1±5.44 3.59±0.23ab 0.82±0.03ab 第10天 CT 73.1±5.78 75.2±8.50 3.03±0.04b 0.71±0.02b 第14天 DT 75.9±4.05 74.7±3.62 3.30±1.02ab 0.75±0.17ab 反应器培养
reactor culture第1天 AC 77.6±2.60 80.9±10.5 4.25±0.22a 0.91±0.01a 第7天 BC 73.4±1.96 72.8±2.00 3.87±0.20a 0.86±0.02a 第10天 CC 77.2±2.94 81.0±3.46 2.98±0.02b 0.69±0.01b 第14天 DC 71.1±4.36 73.2±5.01 2.78±0.29b 0.74±0.07b 注:同列数据上标不同字母表示平均值差异显著 (P<0.05)
Note: The data in the same column with different superscripts are significantly different (P<0.05). -
[1] 李炳乾, 刘颖芬, 刘洪岩, 等. 小新月菱形藻生长条件及半连续培养条件研究[J]. 水产科技情报, 2012(2): 55-58. doi: 10.3969/j.issn.1001-1994.2012.02.001 [2] 刘娟妮, 胡萍, 姚领, 等. 微藻培养中光生物反应器的研究进展[J]. 食品科学, 2006, 27(12): 772-777. doi: 10.3321/j.issn:1002-6630.2006.12.203 [3] 张芬芬, 马晓建, 常春, 等. 气升式微藻光生物反应器的设计研究进展[J]. 现代化工, 2016, 36(10): 46-49. [4] 刘玉环, 黄磊, 王允圃, 等. 大规模微藻光生物反应器的研究进展[J]. 生物加工过程, 2016, 14(1): 65-73. doi: 10.3969/j.issn.1672-3678.2016.01.013 [5] 周进, 林光辉, 蔡中华. 微生物在藻际环境中的物质循环作用[J]. 应用生态学报, 2016, 27(8): 2708-2716. [6] 王少沛, 曹煜成, 李卓佳, 等. 水生环境中细菌与微藻的相互关系及其实际应用[J]. 南方水产, 2008, 4(1): 76-80. doi: 10.3969/j.issn.2095-0780.2008.01.014 [7] 熊青山, 潘秋玲, 王琴, 等. 溶藻微生物菌群的富集及其溶藻因素[J]. 应用与环境生物学报, 2016, 22(6): 1140-1144. [8] SHIN H, LEE E, SHIN J, et al. Elucidation of the bacterial communities associated with the harmful microalgae Alexandrium tamarense and Cochlodinium polykrikoides using nanopore sequencing[J]. Sci Rep, 2018, 8(1): 5323. doi: 10.1038/s41598-018-23634-6
[9] WANG H, HILL R T, ZHENG T, et al. Effects of bacterial communities on biofuel-producing microalgae: stimulation, inhibition and harvesting[J]. Crit Rev Biotechnol, 2014, 36(2): 1-12.
[10] JUAN F, INÉS G, MARÍA C, et al. Impact of microalgae-bacteria interactions on the production of algal biomass and associated compounds[J]. Mar Drug, 2016, 14(5): 100. doi: 10.3390/md14050100
[11] 贾雨川, 阎华, 关昌峰, 等. 内置组合转子新型管式光生物反应器及微藻光暗周期研究[J]. 现代化工, 2017, 37(9): 168-170. [12] De los DANIEL C V, GARCíA-CRUZ E L, FRANCOMORGADO M, et al. Short-term evaluation of the photosynthetic activity of an alkaliphilic microalgae consortium in a novel tubular closed photobioreactor[J]. J Appl Phycol, 2016, 28(2): 795-802. doi: 10.1007/s10811-015-0612-7
[13] 张成会. 利用管式光生物反应器培养湛江等鞭金藻的研究[D]. 湛江: 广东海洋大学, 2015: 32-40. [14] 肖玉朋, 戴玉杰, 申世刚, 等. 户外管式光生物反应器培养发状念珠藻细胞[J]. 食品科技, 2014, 39(3): 2-6. [15] 朱军保. 沙漠微藻管式光生物反应器研制及其相关研究[D]. 石河子: 石河子大学, 2015: 41-48. [16] ZHU J Y, RONG J F, ZONG B N. Factors in mass cultivation of microalgae for biodiesel[J]. Chin J Catal, 2013, 34(1): 80-100. doi: 10.1016/S1872-2067(11)60497-X
[17] 万晓安, 杨正健, 杨林. 光生物反应器中微藻生长影响因子研究进展[J]. 应用化工, 2016, 45(6): 1140-1145, 1154. [18] 石娟, 潘克厚. 不同光照条件对小新月菱形藻和等鞭金藻8701生长及生化成分的影响[J]. 中国水产科学, 2004, 11(2): 121-128. doi: 10.3321/j.issn:1005-8737.2004.02.007 [19] 梁英, 刁永芳, 陈书秀, 等. 温度对小新月菱形藻叶绿素荧光特性及生长的影响[J]. 水产科学, 2011, 30(8): 435-440. doi: 10.3969/j.issn.1003-1111.2011.08.001 [20] 张海阳. 基于射流流场的微藻混凝共聚气浮采收基础研究[D]. 徐州: 中国矿业大学, 2013: 44. [21] 黄新雪. 螺旋转子管式光生物反应器流体动力学特性研究[D]. 北京: 北京化工大学, 2017: 39. [22] 游亮, 崔莉凤, 刘载文, 等. 藻类生长过程中DO、pH与叶绿素相关性分析[J]. 环境科学与技术, 2007, 30(9): 42-44. doi: 10.3969/j.issn.1003-6504.2007.09.015 [23] VALDES F J, HEMANDEZ M R, CATALA L, et al. Estimation of CO2 stripping/CO2 microalgae consumption ratios in a bubble column photobioreactor using the analysis of the pH profiles.Application to Nannochloropsis oculata microalgae culture[J]. Bioresour Technol, 2012, 119: 1-6. doi: 10.1016/j.biortech.2012.05.120
[24] VADLAMANI A, VIAMAJALA S, PENDYALA B, et al. Cultivation of microalgae at extreme alkaline pH conditions: a novel approach for biofuel production[J]. ACS Sustainable Chem Eng, 2017, 5(8): 7284-7294. doi: 10.1021/acssuschemeng.7b01534
[25] LAKANIEMI A M, HULATT C J, WAKEMAN K D, et al. Eukaryotic and prokaryotic microbial communities during microalgal biomass production[J]. Bioresour Technol, 2012, 124: 387-393. doi: 10.1016/j.biortech.2012.08.048
[26] LURIA C M, AMARAL-ZETTLER L A, DUCKLOW H W, et al. Seasonal shifts in bacterial community responses to phytoplankton-derived dissolved organic matter in the western antarctic peninsula[J]. Front Microbiol, 2017, 8: 2117. doi: 10.3389/fmicb.2017.02117
[27] 王剑. 典型赤潮藻类可培养藻际细菌的分子鉴定与藻菌关系研究[D]. 广州: 暨南大学, 2014: 41. [28] 苗祯. 北极微藻藻际细菌类群结构及其相互作用机制研究[D]. 济南: 山东大学, 2013: 42-44. [29] 苗祯, 杜宗军, 李会荣, 等. 5株北极微藻藻际环境的细菌多样性[J]. 生态学报, 2015, 35(5): 1587-1600. [30] FANG F, GAO Y, GAN L, et al. Effects of different initial pH and irradiance levels on cyanobacterial colonies from Lake Taihu, China[J]. J Appl Phycol, 2018, 30(3): 1777-1793. doi: 10.1007/s10811-018-1394-5
[31] ZHANG Z M, YU Z D, ZHU L, et al. Gradient reduced aeration in an enhanced aerobic granular sludge process optimizes the dominant microbial community and its function[J]. Environ Sci, 2018, 4(5): 680-688.
[32] PRABAGARAN S R, MANORAMA R, DELILLE D, et al. Predominance of Roseobacter, Sulfitobacter, Glaciecola and Psychrobacter in seawater collected off Ushuaia, Argentina, Sub-Antarctica[J]. FEMS Microbiol Ecol, 2010, 59(2): 342-355.
[33] IVANOVA E P, GORSHKOVA N M, SAWABE T, et al. Sulfitobacter delicatus sp. nov. and Sulfitobacter dubius sp. nov. respectively from a starfish (Stellaster equestris) and sea grass (Zostera marina)[J]. Int J System Evolution Microbiol, 2004, 54(2): 475-480. doi: 10.1099/ijs.0.02654-0
[34] PARK J R, BAE J W, NAM Y D, et al. Sulfitobacter litoralis sp. nov., a marine bacterium isolated from the East Sea, Korea[J]. Int J Syst Evol Microbiol, 2007, 57(4): 692-695. doi: 10.1099/ijs.0.64267-0
[35] PALACIOS L, ARAHAL D R, REGUERA B, et al. Hoeflea alexandrii sp. nov., isolated from the toxic dinoflagellate Alexandrium minutum AL1V[J]. Int J Sys Evolution Microbiol, 2006, 56(8): 1991-1995. doi: 10.1099/ijs.0.64238-0
[36] JUNG M Y, SHIN K S, KIM S, et al. Hoeflea halophila sp. nov., a novel bacterium isolated from marine sediment of the East Sea, Korea[J]. Antonie Van Leeuwenhoek Int J Gen Mol Microbiol, 2013, 103(5): 971-978. doi: 10.1007/s10482-013-9876-6
[37] YANG Q, JIANG Z W, HUANG C H, et al. Hoeflea prorocentri sp. nov. isolated from a culture of the marine dinoflagellate Prorocentrum mexicanum PM01[J]. Antonie Van Leeuwenhoek Int J Gen Mol Microbiol, 2018, 111(10): 1-9.
[38] 陈正浩, 张永雨, 杨素萍. 海洋玫瑰杆菌类群研究进展[J]. 生态学报, 2015, 35(5): 1620-1629. [39] GENG H F, BELAS R. Molecular mechanisms underlying roseobacter-phytoplankton symbioses[J]. Curr Opin Biotechnol, 2010, 21(3): 332-338. doi: 10.1016/j.copbio.2010.03.013
[40] CROFT M T, LAWRENCE A D, RAUX-DEERY E, et al. Algae acquire vitamin B-12 through a symbiotic relationship with bacteria[J]. Nature, 2005, 438(764): 90-93.
[41] 杨小茹, 苏建强, 郑小伟, 等. 基于分子技术的1株产毒藻藻际细菌多样性分析[J]. 环境科学, 2009, 30(1): 271-279. doi: 10.3321/j.issn:0250-3301.2009.01.046 [42] 王剑, 王朝晖, 熊毅俊. 不同时期条纹环沟藻可培养藻际细菌研究[J]. 中国环境科学, 2014, 34(6): 1540-1547. -
期刊类型引用(11)
1. 丁婵,秦然,崔福义,赵志伟,梁志杰. 氮源水平对微藻深度脱氮除磷耦合生物大分子累积的影响及其细胞响应. 土木与环境工程学报(中英文). 2023(03): 183-195 .  百度学术
百度学术
2. 宋楚儿,孟振,张正,宋晓金,高淳仁. 微藻在水产养殖水质净化中的应用. 浙江海洋大学学报(自然科学版). 2023(04): 330-337 .  百度学术
百度学术
3. 侯德昌,张莹莹,魏文志. 不同中华鳖养殖模式浮游植物功能群特征及水环境评价. 安徽农业科学. 2022(09): 96-99+170 .  百度学术
百度学术
4. 谢静,程燕,查燕,汤婕,束浩然. 氮磷营养盐对铜绿微囊藻和斜生栅藻生长及竞争的影响. 江西农业大学学报. 2021(03): 694-702 .  百度学术
百度学术
5. 张志纯,郑永坤,买思婕. 光照与氮的交互作用对谷皮菱形藻生长及硝酸还原酶活性的影响. 安徽农业科学. 2021(23): 102-105 .  百度学术
百度学术
6. 孔欣,张树林,戴伟,张达娟,毕相东. 氮、磷营养盐对铜绿微囊藻生长的影响. 水产科技情报. 2020(05): 296-300 .  百度学术
百度学术
7. 薄香兰,刘兴,窦勇,高金伟,贾旭颖,周文礼. 不同氮磷比对小球藻叶绿素荧光参数及生长的影响. 江苏农业科学. 2019(02): 169-172 .  百度学术
百度学术
8. 许海,陈丹,陈洁,朱广伟,秦伯强,朱梦圆,张运林. 氮磷形态与浓度对铜绿微囊藻和斜生栅藻生长的影响. 中国环境科学. 2019(06): 2560-2567 .  百度学术
百度学术
9. 张达娟,张树林,王泽斌,李鹏英. 氮补充对氮饥饿铜绿微囊藻生长的影响. 南方农业学报. 2019(11): 2592-2598 .  百度学术
百度学术
10. 曾玲,龙超,文菁. 营养盐限制对利玛原甲藻生长和产毒的影响. 广东农业科学. 2018(02): 135-144 .  百度学术
百度学术
11. 沈斐,王丽红,周青. 生态化学计量学在水生植物系统研究中的应用及进展. 安全与环境学报. 2017(06): 2426-2431 .  百度学术
百度学术
其他类型引用(11)



 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
