IGF3 gene cloning and expression pattern of Protonibea diacanthus
-
摘要:
以双棘黄姑鱼(Protonibea diacanthus)为实验对象,通过RACE方法克隆得到IGFs家族成员IGF3。双棘黄姑鱼IGF3 cDNA全长1 184 bp。氨基酸一致性分析显示,双棘黄姑鱼IGF3与尼罗罗非鱼(Oreochromis niloticus)一致性最高,仅为58.0%;与自身IGF1的2个亚型及IGF2相比,一致性分别低至26.2%、25.2%和21.9%。系统进化树显示鱼类IGF3基因先与IGF2聚类,再与IGF1汇聚构成IGF家族,最后IGFs与胰岛素聚类。组织表达模式显示IGF3在双棘黄姑鱼心脏、性腺、脑区均有表达,在性腺中表达最强。实时定量PCR结果表明,IGF3在精巢发育期表达量显著高于其他时期,呈显著下降趋势;在卵巢成熟期的表达量显著高于其他时期。此外,雌鱼在成熟期前、中、后脑IGF3的表达量显著高于其他时期,而雄鱼各脑区IGF3表达趋势呈多样性。上述结果表明,IGF3可能参与了双棘黄姑鱼精巢发育和卵巢成熟期生殖功能的调节,且前脑可能主要参与了IGF3在性腺表达的反馈调节。
Abstract:We cloned IGF-Ⅲ gene from Protonibea diacanthus by RACE method. The length of cDNA was 1 184 bp. The homologous analysis of deduced protein shows that the identity of IGF-Ⅲ gene and Oreochromis niloticus was 58.0%. Compared with IGF-Ⅱ and two subtypes of IGF-Ⅰof P.diacantus, the identities were 21.9%, 26.2% and 25.2%, respectively. Phylogenetic tree analysis shows that IGF-Ⅲ tended to cluster with IGF-Ⅱ firstly and then cluster with IGF-Ⅰcomposing IGF family, and finally IGF family clustered in the same branch with Insulin. Tissue distribution shows that IGF-Ⅲ was widely expressed in heart, gonad and brain of P.diacanthus, especially highest in gonad. Quantitative real-time PCR analysis reveals that the expression of IGF-Ⅲ in testis was significantly higher in developing phase than that in the others, showing a significant decline. The expression of IGF-Ⅲ in ovary of maturation phase was also remarkably higher than that in other periods. Besides, the expression of IGF-Ⅲ in forebrain, midbrain and hindbrain in female fish in mature phase was higher than that in other periods. However, IGF-Ⅲ expression pattern was different in male fish. It is suggested that IGF-Ⅲ might be important for the development of testis and maturation of ovary, and forebrain might involve in the feedback regulation of IGF-Ⅲ expression in gonad.
-
双棘黄姑鱼(Protonibea diacanthus)隶属鲈形目,石首鱼科,原黄姑鱼属,俗称黑𩾃、赤𩾃,是近海暖温性底层鱼类。主要分布于朝鲜、日本、东南亚及中国沿海,是近年中国南方沿海新兴的养殖品种[1]。
类胰岛素样生长因子(insulin-like growth factor,IGFs)是一类进化上保守的多肽[2]。具有合成代谢作用[3-4],能促进细胞的分裂和分化、抑制细胞凋亡[5-6],调控动物生长[7-9]、生殖过程[4, 10]等。IGF家族包括IGF配体、IGF受体(insulin-like growth factor receptor,IGFR)和6种IGF结合蛋白(insulin-like growth factor binding protein,IGFBPs)[11]。IGFs由于与多种疾病有关,已成为哺乳类研究的热点[4-6, 12-15]。鱼类IGFs家族的研究相对滞后,且更多倾向于IGF1和IGF2等相关基因和受体的研究[16-19]。2008年有学者在尼罗罗非鱼(Oreochromis niloticus)和斑马鱼(Danio rerio)中发现性腺特异的IGF,将其命名为IGF3[20]。而后有研究发现,IGF3在斑马鱼脑和咽弓部在不同时间都有不同程度的表达[21]。IGF3在生物体内能促进卵巢细胞的发育成熟和相关激素合成[22],增强细胞的增殖和迁移能力[23],缺乏则会导致生物体疾病的产生[24-25]。最近有学者通过制备IGF3多克隆抗体和基因敲除等技术手段证明,IGF3与性别分化相关转录因子及类固醇酶等相互作用,影响罗非鱼生殖细胞的减数分裂[26]。由于IGF3发现较晚,一致性较低,组织表达具有特异性,为研究人员将IGF3扩展到其他物种研究带来不便。从IGF3被发现至今,研究也仅限于罗非鱼、斑马鱼等一些物种,虽然围绕IGF3研究的内容逐渐增多,但还无法与IGF1和IGF2研究的深度与广度相比。文章以双棘黄姑鱼为实验对象,通过RACE的方法成功克隆得到IGF3基因,在生物信息学研究的基础上,通过IGF3在性腺和脑区的表达模式分析,研究IGF3在双棘黄姑鱼中的表达变化情况,为在其功能和调节机制方面更深层次的研究奠定基础。
1. 材料与方法
1.1 材料与主要试剂
双棘黄姑鱼采样于广东省饶平县养殖场,体长60~80 cm,体质量4~6 kg。表达实验鱼用碎冰麻醉后解剖,依次分离前脑、中脑、后脑、垂体、肝脏、心脏、脾脏、肾脏、头肾、胃、肠、鳃、肌肉、性腺,样品保存在冻存管中,液氮速冻处理,存放于-80 ℃超低温冰箱待用。
1.2 总RNA提取和反转录
总RNA参照Trizol reagent(Invitrogen,USA)说明书进行提取。参照ReverTra Ace反转录试剂盒(TOYOBO,Japan)说明书合成第一链cDNA。以内参18S为引物,进行PCR扩增,验证反转录cDNA质量(PCR反应参数为预变性94 ℃ 3 min;变性94 ℃ 30 s,退火53 ℃ 20 s,延伸72 ℃ 20 s,循环次数:25;后延伸10 min;4 ℃保存)。
1.3 双棘黄姑鱼IGF3引物设计与基因克隆
以反转录合成的第一链cDNA为模板,根据已知的斑马鱼和尼罗罗非鱼IGF3 cDNA序列设计中间片段引物,扩增出双棘黄姑鱼IGF3 cDNA部分片段。在此基础上,设计RACE扩增引物IGF3-F2(OUTER)、IGF3-F3(INNER)、IGF3-R2(OUTER)、IGF3-R3(INNER),运用RACE技术,分别克隆出5′和3′端序列。将序列拼接得到IGF3全长序列(表 1)。
表 1 双棘黄姑鱼IGF3 cDNA克隆引物表Table 1 Primer pairs used for amplification of IGF3 of P.diacanthus引物
primer引物序列(5′→3′)
primer sequences扩增目标
amplification targetIGF3-F1 GTGGTCTGGTTATGGCACTC cDNA fragment of IGF3 IGF3-R1 CACAGTACATGTCCAGATGCTG cDNA fragment of IGF3 IGF3-F2(OUTER) GTGTTGTGTGTTCGGATGTG 3′ RACE of IGF3 IGF3-F3(INNER) CTGTGGTACTGACCTCCTCA 3′ RACE of IGF3 IGF3-R2(OUTER) GCAGCACTGGTCTACAATCC 5′ RACE of IGF3 IGF3-R3(OUTER) GAGTGCCATAACCAGACCAC 5′ RACE of IGF3 IGF3-F CAGGATGCACTCCTCATGCT ORF of IGF3 IGF3-R TAAAGGTCATGATTCAGAGC ORF of IGF3 IGF3-QF CAGGATGCACTCCTCATGCT Expression of IGF3 IGF3-QR CTGTGGTTTGCTGCTGGCTC Expression of IGF3 18S-F CCTGAGAAACGGCTACCACATCC Expression of 18s rRNA 18S-R AGCAACTTTAGTATACGCTATTGGAG Expression of 18s rRNA 1.4 双棘黄姑鱼IGF3组织分布及表达
设计特异引物IGF3-QF和IGF3-QR检测双棘黄姑鱼IGF3在各个组织分布情况,内参基因为18S。PCR反应所用试剂为Blend Taq-plus(TOYOBO,Japan),反应条件为94 ℃预变性3 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸1 min,循环30次;后延伸10 min;4 ℃保存。检测的组织有肝脏、心脏、脾脏、肾脏、头肾、胃、肠、鳃、肌肉、性腺、垂体、前脑、中脑、后脑。运用实时定量PCR检测性腺中IGF3的表达模式。目标基因引物与组织分布引物相同,内参基因选择双棘黄姑鱼18S基因。运用Applied Biosystems软件计算性腺发育各时期IGF3相对表达量;使用Graphpad Prism软件中的One-Way Analysis of Variance进行显著性检验的统计学分析。
2. 结果
2.1 IGF3基因克隆及序列分析
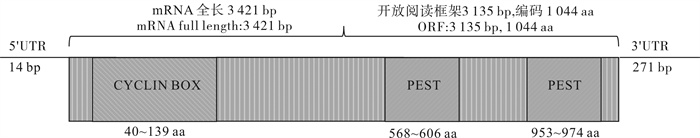
设计全长验证引物IGF3-F、IGF3-R(表 1),通过RACE PCR技术扩增得到双棘黄姑鱼全长片段。双棘黄姑鱼IGF3 cDNA全长1 184 bp。其中5′非编码区(UTR)14 bp;开放阅读框(ORF)600 bp,编码199个氨基酸;3′UTR 570 bp。IGF3也可以划分为前体信号肽、B、C、A、D、E区。但IGF3的D区与E区在氨基酸序列处没有明显的划分标志(图 1)。
2.2 IGF3氨基酸一致性比较
通过Pairwise Alignment进行氨基酸序列一致性比较发现,双棘黄姑鱼与尼罗罗非鱼和斑马鱼IGF3一致性在34.5% ~58%之间,而IGF3与IGF1和IGF2的一致性更低(21.9% ~26.2%)。
2.3 IGF3系统进化树
使用MEGA 4.0构建IGF3 NJ系统进化树(图 2)。鱼类IGF3基因先与IGF2聚类,再与IGF1汇聚构成IGF家族,最后IGFs与胰岛素聚类。
2.4 IGF3组织表达模式
结果显示,心脏、性腺、脑分区中检测到了IGF3 mRNA的表达(表 3)。性腺IGF3 mRNA的表达量明显高于其他组织。
表 2 用于序列比对和系统进化树构建的IGF3氨基酸序列Table 2 IGF3 amino acid sequences used for alignment and construction of phylogenetic tree物种
species蛋白质
protein登录号
GeneBank accession No.尼罗罗非鱼(O.niloticus) IGF3 ABY88870.1 斑马鱼(D.rerio) IGF3a ADO16599.1 斑马鱼(D.rerio) IGF3b ABY88869.1 金鲷(Sparus aurata) Insulin ADV90806.1 热带爪蟾(Xenopus tropicalis) Insulin NP_001093706.1 斑马鱼(D.rerio) Insulin CAC20109.1 人(Homo sapiens) Insulin AAP36446.1 尼罗罗非鱼(O.niloticus) Insulin XP_003458727.1 莫桑比克罗非鱼(O.mossambicus) IGF1 AAB86652.1 点带石斑鱼(Epinephelus coioides) IGF1 AAS01183.1 褐牙鲆(Paralichthys olivaceus) IGF1 AAC62228.1 虹鳟(Oncorhynchus mykiss) IGF1 NP_001118168.1 黄鳍鲷(Acanthopagrus latus) IGF1 AAT35826.1 赤鲈(Perca flavescens) IGF1 AAP93861.1 眼斑拟石首鱼(Sciaenops ocellatus) IGF1-Ea1 ADK38548.1 眼斑拟石首鱼(S.ocellatus) IGF1-Ea2 GU175982 眼斑拟石首鱼(S.ocellatus) IGF1-Ea3 ADM15566.1 眼斑拟石首鱼(S.ocellatus) IGF1-Ea4 GQ443297 斑马鱼(D.rerio) IGF1 NP_571900.1 鲮鱼(Cirrhinus molitorella) IGF1 AAY21902.1 斑点叉尾 
IGF1 NP_001187224.1 牛(Bos taurus) IGF1 NP_001071296.1 羊(Ovis aries) IGF1 AAA80534.1 野猪(Sus scrofa) IGF1 ABG88023.1 人(H.sapiens) IGF1 NP_000609.1 鼠(Mus musculus) IGF1 NP_001104745.1 斑马鱼(D.rerio) IGF2a NP_571508.1 斑马鱼(D.rerio) IGF2b NP_001001815.1 虹鳟(O.mykiss) IGF2 NP_001118169.1 斑点叉尾 
IGF2 NP_001187128.1 金鲷(S.aurata) IGF2 ABQ52655.1 尼罗罗非鱼(O.niloticus) IGF2 ABY88873.1 点带石斑鱼(E.coioides) IGF2 AAS58520.1 牛(B.aurus) IGF2 ABD34310.1 家鼠(M.musculus) IGF2 NP_034644.2 非洲爪蟾(X.laevis) IGF2a NP_001082128.1 非洲爪蟾(X.laevis) IGF2b AAH72153.1 人(H.sapiens) IGF2 NP_001121070.1 羊(O.aries) IGF2 NP_001009311.1 表 3 双棘黄姑鱼与部分脊椎动物IGF3氨基酸序列一致性比较Table 3 Pairwise comparison of amino acid sequences of P.diacanthus IGF3 with those of selected IGF3种类
species蛋白质
protein氨基酸一致性/%
amino acid identity尼罗罗非鱼(O.niloticus) IGF3 58.0 斑马鱼(D.rerio) IGF3a 35.4 斑马鱼(D.rerio) IGF3b 34.5 双棘黄姑鱼(P.diacanthus) IGF1-Ea2 26.2 双棘黄姑鱼(P.diacanthus) IGF1-Ea4 25.2 双棘黄姑鱼(P.diacanthus) IGF2 21.9 2.5 性腺发育各时期IGF3 mRNA的表达
石蜡切片确定双棘黄姑鱼所处的生殖时期分别为发育期、成熟期和退化期(图 4)。实时定量PCR分别检测了双棘黄姑鱼雌鱼和雄鱼在各时期IGF3 mRNA的表达量(图 5)。
![]() 图 3 IGF3组织表达M. marker;A. 肝脏;B. 心脏;C. 脾脏;D. 肾脏;E. 头肾;F. 胃;G. 肠;H. 鳃;I. 肌肉;J. 性腺;K. 垂体;L. 前脑;M. 中脑;N. 后脑;NC. 阴性对照Fig. 3 Tissue distribution of IGF3 inP.diacanthusM. marker; A.liver; B.heart; C.spleen; D.kidney; E. head kidney; F. stomach; G. intestines; H. gill; I. muscle; J. gonad; K. pituitary; L. forebrain; M. midbrain; N. after brain; NC.negative control
图 3 IGF3组织表达M. marker;A. 肝脏;B. 心脏;C. 脾脏;D. 肾脏;E. 头肾;F. 胃;G. 肠;H. 鳃;I. 肌肉;J. 性腺;K. 垂体;L. 前脑;M. 中脑;N. 后脑;NC. 阴性对照Fig. 3 Tissue distribution of IGF3 inP.diacanthusM. marker; A.liver; B.heart; C.spleen; D.kidney; E. head kidney; F. stomach; G. intestines; H. gill; I. muscle; J. gonad; K. pituitary; L. forebrain; M. midbrain; N. after brain; NC.negative control![]() 图 4 双棘黄姑性腺生殖周期组织切片雌鱼: a为发育期(Ⅲ期,×60);b为成熟期(Ⅳ期,×200);c为退化期(Ⅴ期,×200);雄鱼:d为发育期(Ⅲ期,×100);e为成熟期(Ⅳ期,×100);f为退化期(Ⅴ期,×100)Fig. 4 Gonadal histology sections of gonad development of P.diacanthusFemale: a.developmental phase; b.maturation phase; c.involutional phase; Male: d.developmental phase; e.maturation phase; f.involutional phase
图 4 双棘黄姑性腺生殖周期组织切片雌鱼: a为发育期(Ⅲ期,×60);b为成熟期(Ⅳ期,×200);c为退化期(Ⅴ期,×200);雄鱼:d为发育期(Ⅲ期,×100);e为成熟期(Ⅳ期,×100);f为退化期(Ⅴ期,×100)Fig. 4 Gonadal histology sections of gonad development of P.diacanthusFemale: a.developmental phase; b.maturation phase; c.involutional phase; Male: d.developmental phase; e.maturation phase; f.involutional phase![]() 图 5 性腺发育周期双棘黄姑鱼性腺IGF3表达量的变化不同小写字母表示雌鱼之间存在显著性差异(P < 0.005);不同大写字母表示雄鱼之间存在显著性差异(P < 0.005)。所有数据均以平均值±标准误差;星号表示同时间内雌雄表达量极显著, 下图同此。Fig. 5 IGF3 expression level in gonad development of P.diacanthusDifferent lowercase letters represent female significant difference (P < 0.005);different uppercase letters represent the male significant differences(P < 0.005);all data were expressed as X ±SE. Asterisks indicate the expression of male and female significantly in the same time.The same case in the following figure.
图 5 性腺发育周期双棘黄姑鱼性腺IGF3表达量的变化不同小写字母表示雌鱼之间存在显著性差异(P < 0.005);不同大写字母表示雄鱼之间存在显著性差异(P < 0.005)。所有数据均以平均值±标准误差;星号表示同时间内雌雄表达量极显著, 下图同此。Fig. 5 IGF3 expression level in gonad development of P.diacanthusDifferent lowercase letters represent female significant difference (P < 0.005);different uppercase letters represent the male significant differences(P < 0.005);all data were expressed as X ±SE. Asterisks indicate the expression of male and female significantly in the same time.The same case in the following figure.2.6 性腺发育过程脑区IGF3的表达模式
双棘黄姑鱼雌鱼在生殖周期过程中,前脑成熟期IGF3 mRNA表达最高;发育期至成熟期时IGF3 mRNA表达量显著上升,退化期显著下降;雄鱼在生殖周期中,IGF3 mRNA表达量呈下降趋势,发育期IGF3 mRNA表达量最高,至退化期时显著下降;成熟期与退化期差异不显著(图 6-a)。
生殖周期雌鱼中脑成熟期IGF3 mRNA表达最高;发育期至成熟期IGF3 mRNA表达量显著升高,至退化期显著下降。雄鱼IGF3表达趋势与雌鱼类似(图 6-b)。
双棘黄姑鱼雌鱼后脑IGF3 mRNA表达趋势和前脑、中脑相似;成熟期IGF3 mRNA表达量最高、退化期最低,但各时期IGF3 mRNA表达量差异不显著。雄鱼后脑发育期检测不到IGF3 mRNA信号,成熟期和退化期有微弱的IGF3 mRNA信号表达(图 6-c)。
3. 讨论
3.1 双棘黄姑鱼IGF3基因克隆与鉴定分析
有研究将斑马鱼、尼罗罗非鱼和青鳉(Oryzias latipes)IGF3与其他IGFs序列进行序列多重比对发现,IGF3的B和A结构域与IGF-1的一致性只有60%,C和D为30%,E结构域通常是在形成成熟肽时被切除,一致性最低[20]。参照现有文献,不能准确划分出双棘黄姑鱼IGF3氨基酸序列的D区和E区。硬骨鱼类IGF3氨基酸序列的结构划分,还需进一步研究确定。
氨基酸一致性分析,双棘黄姑鱼IGF3基因保守性较低。与尼罗罗非鱼IGF3和斑马鱼2种IGF3亚型一致性分别为58.0%、35.4%和34.5%。不同物种间如此低的保守性,有无可能IGF3是IGF2的亚型?一致性分析显示双棘黄姑鱼IGF3与双棘黄姑鱼IGF2、IGF1-Ea2、IGF1-Ea4氨基酸序列一致性更低,分别为21.9%、26.2%和25.2%。这揭示鱼类IGF3基因的进化分化可能早于IGF1和IGF2。系统进化树结果显示,鱼类IGF3基因先与IGF2聚类,再与IGF1汇聚构成IGF家族,最后IGFs与胰岛素聚类,这更加佐证IGF3是IGFs家族的新成员。然而IGF3遗传信息在生物进化史上丢失于哪个时期、哪个物种,仍需进一步研究。
3.2 双棘黄姑鱼IGF3组织表达模式分析
在双棘黄姑鱼性腺中克隆到IGF3。IGF3虽在性腺内优势表达但并非性腺特异性表达,其在脑分区及心脏中也有较高表达。这与IGF3在尼罗罗非鱼和斑马鱼性腺中特异性表达不同[20],预示着IGF3除对鱼类生殖细胞有影响外,在双棘黄姑鱼中还存在着其他未知的生物功能。
3.3 双棘黄姑鱼IGF3性腺发育表达模式分析
精巢IGF3表达量在发育期显著高于其他时期,且表达量呈显著下降趋势(图 5)。雌鱼卵巢IGF3表达量在成熟期显著高于发育期,发育期精巢IGF3 mRNA表达量要显著高于卵巢;此外在成熟期及退化期,精巢IGF3表达量要显著低于同一时期的卵巢。这种变化预示着IGF3可能与双棘黄姑鱼雄性精巢精子的早期发生以及雌性卵巢卵子的成熟及卵巢功能的维持有关。
有研究显示斑马鱼IGF3表达情况与该研究结果相似,IGF3表达量随着卵泡的发育呈逐渐上升的趋势:IGF3在发育前期微弱表达,而在卵黄生成期时表达量显著增加,至完全生长期时达到峰值[27]。同样在尼罗罗非鱼性腺发育阶段中,IGF3在雄性中高表达而在雌性中低表达[28]。尼罗罗非鱼在个体发育早期便开始转录IGF3 mRNA,原位杂交结果显示IGF3 mRNA首先出现在卵巢的体细胞,之后在卵巢的颗粒细胞及精巢的间质细胞检测到IGF3 mRNA的表达[20];在尼罗罗非鱼的早期性腺发育过程中,受精卵在出膜后5~40 d卵巢IGF3表达量要高于精巢,但在出膜50 d后精巢IGF3表达量高于卵巢,后期卵巢IGF3表达量无明显变化,而精巢中IGF3的表达量一直呈上升趋势[29]。综合分析认为,IGF3在不同时空下对不同物种的生殖细胞功能有所不同。
3.4 双棘黄姑鱼性腺发育各脑分区IGF3表达模式分析
硬骨鱼类的生殖活动是受脑-垂体-性腺轴调控的[30]。脑能分泌神经肽、促性腺激素释放激素[31]、GnIH[32-33]、NKB[34-35]等与生殖相关的激素和因子。在生殖周期中,利用实时定量PCR在脑区检测IGF3 mRNA。雌鱼成熟期前、中和后脑IGF3 mRNA表达量显著高于其他时期,雄鱼各脑分区IGF3 mRNA表达趋势具多样性。
4. 小结
通过RACE方法首次在双棘黄姑鱼中克隆出IGF3基因,并对其基因结构、氨基酸一致性、系统进化、性腺表达模式、脑区表达模式进行了系统性的分析。在性腺组织之外的心脏及脑区等也检测到IGF3的表达,丰富了IGF家族在IGF3方面的信息。但IGF3在性腺发育中的具体功能以及发挥作用的机制如何、各脑区是如何控制下游信号的传导,其反馈调节机制如何,均是需亟待解决的问题。
-
图 3 IGF3组织表达
M. marker;A. 肝脏;B. 心脏;C. 脾脏;D. 肾脏;E. 头肾;F. 胃;G. 肠;H. 鳃;I. 肌肉;J. 性腺;K. 垂体;L. 前脑;M. 中脑;N. 后脑;NC. 阴性对照
Figure 3. Tissue distribution of IGF3 inP.diacanthus
M. marker; A.liver; B.heart; C.spleen; D.kidney; E. head kidney; F. stomach; G. intestines; H. gill; I. muscle; J. gonad; K. pituitary; L. forebrain; M. midbrain; N. after brain; NC.negative control
图 4 双棘黄姑性腺生殖周期组织切片
雌鱼: a为发育期(Ⅲ期,×60);b为成熟期(Ⅳ期,×200);c为退化期(Ⅴ期,×200);雄鱼:d为发育期(Ⅲ期,×100);e为成熟期(Ⅳ期,×100);f为退化期(Ⅴ期,×100)
Figure 4. Gonadal histology sections of gonad development of P.diacanthus
Female: a.developmental phase; b.maturation phase; c.involutional phase; Male: d.developmental phase; e.maturation phase; f.involutional phase
图 5 性腺发育周期双棘黄姑鱼性腺IGF3表达量的变化
不同小写字母表示雌鱼之间存在显著性差异(P < 0.005);不同大写字母表示雄鱼之间存在显著性差异(P < 0.005)。所有数据均以平均值±标准误差;星号表示同时间内雌雄表达量极显著, 下图同此。
Figure 5. IGF3 expression level in gonad development of P.diacanthus
Different lowercase letters represent female significant difference (P < 0.005);different uppercase letters represent the male significant differences(P < 0.005);all data were expressed as X ±SE. Asterisks indicate the expression of male and female significantly in the same time.The same case in the following figure.
表 1 双棘黄姑鱼IGF3 cDNA克隆引物表
Table 1 Primer pairs used for amplification of IGF3 of P.diacanthus
引物
primer引物序列(5′→3′)
primer sequences扩增目标
amplification targetIGF3-F1 GTGGTCTGGTTATGGCACTC cDNA fragment of IGF3 IGF3-R1 CACAGTACATGTCCAGATGCTG cDNA fragment of IGF3 IGF3-F2(OUTER) GTGTTGTGTGTTCGGATGTG 3′ RACE of IGF3 IGF3-F3(INNER) CTGTGGTACTGACCTCCTCA 3′ RACE of IGF3 IGF3-R2(OUTER) GCAGCACTGGTCTACAATCC 5′ RACE of IGF3 IGF3-R3(OUTER) GAGTGCCATAACCAGACCAC 5′ RACE of IGF3 IGF3-F CAGGATGCACTCCTCATGCT ORF of IGF3 IGF3-R TAAAGGTCATGATTCAGAGC ORF of IGF3 IGF3-QF CAGGATGCACTCCTCATGCT Expression of IGF3 IGF3-QR CTGTGGTTTGCTGCTGGCTC Expression of IGF3 18S-F CCTGAGAAACGGCTACCACATCC Expression of 18s rRNA 18S-R AGCAACTTTAGTATACGCTATTGGAG Expression of 18s rRNA 表 2 用于序列比对和系统进化树构建的IGF3氨基酸序列
Table 2 IGF3 amino acid sequences used for alignment and construction of phylogenetic tree
物种
species蛋白质
protein登录号
GeneBank accession No.尼罗罗非鱼(O.niloticus) IGF3 ABY88870.1 斑马鱼(D.rerio) IGF3a ADO16599.1 斑马鱼(D.rerio) IGF3b ABY88869.1 金鲷(Sparus aurata) Insulin ADV90806.1 热带爪蟾(Xenopus tropicalis) Insulin NP_001093706.1 斑马鱼(D.rerio) Insulin CAC20109.1 人(Homo sapiens) Insulin AAP36446.1 尼罗罗非鱼(O.niloticus) Insulin XP_003458727.1 莫桑比克罗非鱼(O.mossambicus) IGF1 AAB86652.1 点带石斑鱼(Epinephelus coioides) IGF1 AAS01183.1 褐牙鲆(Paralichthys olivaceus) IGF1 AAC62228.1 虹鳟(Oncorhynchus mykiss) IGF1 NP_001118168.1 黄鳍鲷(Acanthopagrus latus) IGF1 AAT35826.1 赤鲈(Perca flavescens) IGF1 AAP93861.1 眼斑拟石首鱼(Sciaenops ocellatus) IGF1-Ea1 ADK38548.1 眼斑拟石首鱼(S.ocellatus) IGF1-Ea2 GU175982 眼斑拟石首鱼(S.ocellatus) IGF1-Ea3 ADM15566.1 眼斑拟石首鱼(S.ocellatus) IGF1-Ea4 GQ443297 斑马鱼(D.rerio) IGF1 NP_571900.1 鲮鱼(Cirrhinus molitorella) IGF1 AAY21902.1 斑点叉尾 
IGF1 NP_001187224.1 牛(Bos taurus) IGF1 NP_001071296.1 羊(Ovis aries) IGF1 AAA80534.1 野猪(Sus scrofa) IGF1 ABG88023.1 人(H.sapiens) IGF1 NP_000609.1 鼠(Mus musculus) IGF1 NP_001104745.1 斑马鱼(D.rerio) IGF2a NP_571508.1 斑马鱼(D.rerio) IGF2b NP_001001815.1 虹鳟(O.mykiss) IGF2 NP_001118169.1 斑点叉尾 
IGF2 NP_001187128.1 金鲷(S.aurata) IGF2 ABQ52655.1 尼罗罗非鱼(O.niloticus) IGF2 ABY88873.1 点带石斑鱼(E.coioides) IGF2 AAS58520.1 牛(B.aurus) IGF2 ABD34310.1 家鼠(M.musculus) IGF2 NP_034644.2 非洲爪蟾(X.laevis) IGF2a NP_001082128.1 非洲爪蟾(X.laevis) IGF2b AAH72153.1 人(H.sapiens) IGF2 NP_001121070.1 羊(O.aries) IGF2 NP_001009311.1 表 3 双棘黄姑鱼与部分脊椎动物IGF3氨基酸序列一致性比较
Table 3 Pairwise comparison of amino acid sequences of P.diacanthus IGF3 with those of selected IGF3
种类
species蛋白质
protein氨基酸一致性/%
amino acid identity尼罗罗非鱼(O.niloticus) IGF3 58.0 斑马鱼(D.rerio) IGF3a 35.4 斑马鱼(D.rerio) IGF3b 34.5 双棘黄姑鱼(P.diacanthus) IGF1-Ea2 26.2 双棘黄姑鱼(P.diacanthus) IGF1-Ea4 25.2 双棘黄姑鱼(P.diacanthus) IGF2 21.9 -
[1] 胡珍华. 双棘黄姑鱼人工育苗技术[J]. 河北渔业, 2013(10): 46-48. doi: 10.3969/j.issn.1004-6755.2013.10.017 [2] WOOD A W, DUAN C, BERN H A. Insulin-like growth factor signaling in fish[J]. Int Rev Cytol, 2005, 243: 215-285. https://xueshu.baidu.com/usercenter/paper/show?paperid=5fa0c1ee04da19c87f203719dce59819&site=xueshu_se&hitarticle=1
[3] 徐爽, 赵玉岩, 沈扬, 等. 胰岛素抵抗肥胖大鼠血清增食欲素A与IGF-1及脂代谢相关性研究[J]. 创伤与急危重病医学, 2014, 2(3): 179-182. https://xueshu.baidu.com/usercenter/paper/show?paperid=bab88b4e5834b789b25aabc20f7841af&site=xueshu_se&hitarticle=1 [4] 郑洁莉, 徐莉. 多囊卵巢综合征中医证型与糖代谢及IGF-I、IGFBP-1相关性的研究[J]. 世界中医药, 2014(7): 889-891. doi: 10.3969/j.issn.1673-7202.2014.07.017 [5] 杨海燕, 侯建明, 吴曼, 等. 乳铁蛋白对大鼠成骨细胞增殖及IGF-1/IGF-1R mRNA表达的影响[J]. 中华骨质疏松和骨矿盐疾病杂志, 2014(1): 35-41. doi: 10.3969/j.issn.1674-2591.2014.01.007 [6] 李士英. IGF1R在骨肉瘤组织中的表达及临床意义[D]. 苏州: 苏州大学, 2014: 2-3. https://xueshu.baidu.com/usercenter/paper/show?paperid=39c03ae0cb9ebcbe4be9e1bdb52f47b1 [7] 王佩佩, 李晓存, 冷丽, 等. 鸡IGF-1R基因序列变异与骨骼、体重性状的相关研究[J]. 中国家禽, 2014(11): 5-9. doi: 10.3969/j.issn.1004-6364.2014.11.003 [8] 谢伟姣, 王敏, 于力, 等. IGF-1R、IGFBP-1与妊娠期糖尿病巨大儿的相关性研究[J]. 安徽医科大学学报, 2014(10): 1508-1510. https://lczl.med.wanfangdata.com.cn/Home/DocumentDetail?id=ahykdxxb201410040 [9] 马强. IGF-1基因对猪矮小性状的影响[D]. 吉林: 吉林大学, 2014: 7. http://www.shidacloud.com/?p=137424 [10] 张磊, 王燕燕, 周占琴, 等. 摘除卵巢对布尔山羊杂种母羊组织IGF-I和IGF-1R基因表达的影响[J]. 中国兽医学报, 2014(6): 1005-1011. [11] 杨慧荣, 赵会宏, 陈彦珍. 胰岛素样生长因子IGF系统与鱼类性腺的研究进展[J]. 动物学杂志, 2013, 48(2): 306-313. http://dwxzz.ioz.ac.cn/dwxb/article/abstract/20130223?st=article_issue [12] 田晓慧, 胡斌, 秦溶, 等. 血清IGF-1水平及癌组织VEGF表达在结肠癌患者诊断和治疗中的临床意义[J]. 实用临床医药杂志, 2014(3): 9-11. doi: 10.7619/jcmp.201403003 [13] 徐文芹, 王雨生. IGF-1/IGFBP-3在早产儿视网膜病变中的作用及其应用[J]. 眼科新进展, 2014(9): 889-892. [14] 刘桂红. 2型糖尿病易感基因TCF7L2、IGF2BP2多态性与汉族女性乳腺癌发病风险的关联研究[D]. 石家庄: 河北医科大学, 2014: 30. [15] 谢伟姣. 胎盘中IGF-1、IGF-2、IGF-1R以及IGFBP-3表达水平与妊娠期糖尿病巨大儿的相关性研究[D]. 合肥: 安徽医科大学, 2014: 6-7. https://xueshu.baidu.com/usercenter/paper/show?paperid=3ae9d782ca78f5cbc06b849cff3bda41 [16] 钱焜, 温海深, 迟美丽, 等. 花鲈类胰岛素生长因子-1基因的全长cDNA分离与表达分析[J]. 中国海洋大学学报(自然科学版), 2014, 44(2): 27-34. https://xueshu.baidu.com/usercenter/paper/show?paperid=db12bfed446a8373ee31deabaf248b5d [17] 周春雪, 蒋霞云, 陈杰, 等. 草鱼胰岛素样生长因子1受体基因cDNA全序列的克隆及功能[J]. 中国水产科学, 2014, 21(3): 442-453. http://www.fishscichina.com/zgsckx/article/abstract/5311 [18] 钱焜, 温海深, 迟美丽, 等. 外源激素对花鲈(Lateolabrax japonicus)血清IGF-1含量及肝脏IGF-1和IGFBP-1 mRNA表达的影响[J]. 渔业科学进展, 2014, 35(4): 39-44. doi: 10.11758/yykxjz.20140406 [19] 张毅. 不同倍性鲫鲤GH/IGF-1轴相关因子的表达差异研究[D]. 长沙: 湖南师范大学, 2014: 1-2. https://xueshu.baidu.com/usercenter/paper/show?paperid=9d1d03577b56555ee2591ab452c074d5&site=xueshu_se [20] WANG D S, JIAO B W, HU C J, et al. Discovery of a gonad-specific IGF subtype in teleost[J]. Biochem Biophys Res Commun, 2008, 367(2): 336-341. doi: 10.1016/j.bbrc.2007.12.136
[21] LI J, WU P, LIU Y, et al. Temporal and spatial expression of the four IGF ligands and two IGF type 1 receptors in zebrafish during early embryonic development[J]. Gene Exp Patterns, 2014, 15(2): 104-111. doi: 10.1016/j.gep.2014.05.006
[22] MAITRA S, DAS D, GHOSH P, et al. High cAMP attenuation of insulin-stimulated meiotic G2-M1 transition in zebrafish oocytes: interaction between the cAMP-dependent protein kinase (PKA) and the MAPK3/1 pathways[J]. Mol Cell Endocrinol, 2014, 393(1/2): 109-119. https://xueshu.baidu.com/usercenter/paper/show?paperid=b1977042573bee2eeeccec314bdf5ca9&site=xueshu_se&hitarticle=1
[23] KOKAI L E, MARRA K, RUBIN J P. Adipose stem cells: biology and clinical applications for tissue repair and regeneration[J]. Transl Res, 2014, 163(4): 399-408. doi: 10.1016/j.trsl.2013.11.009
[24] BAJKIN I, BJELICA A, ICIN T, et al. Effects of phthalic acid esters on fetal health[J]. Medicinski Pregled, 2014, 67(5/6): 172-175. https://xueshu.baidu.com/usercenter/paper/show?paperid=408395799e1a4a4c2e007439feebef2e&site=xueshu_se&hitarticle=1
[25] MORAVA E. Galactose supplementation in phosphoglucomutase-1 deficiency: review and outlook for a novel treatable CDG[J]. Mol Genet Metab, 2014, 112(4): 275-279. doi: 10.1016/j.ymgme.2014.06.002
[26] 李明辉. 罗非鱼基因敲除技术的建立及其在性别决定与分化研究中的应用[D]. 重庆: 西南大学, 2014: 93. https://xueshu.baidu.com/usercenter/paper/show?paperid=847fa9339754f81d84660e99617eae50&site=xueshu_se&hitarticle=1 [27] LI J Z, LIU Z H, WANG D S, et al. Insulin-like growth factor 3 is involved in oocyte maturation in zebrafish[J]. Biol Reprod, 2011, 84(3): 476-486. doi: 10.1095/biolreprod.110.086363
[28] BAROILLER J, D COTTA H, SHVED N, et al. Oestrogen and insulin-like growth factors during the reproduction and growth of the tilapia Oreochromis niloticus and their interactions[J]. Gen Comp Endocrinol, 2014, 205(SI): 142-150. https://xueshu.baidu.com/usercenter/paper/show?paperid=848962e043090af77a024ae2d054b4d5&site=xueshu_se&hitarticle=1
[29] LI M H, WU F R, GU Y, et al. Insulin-like growth factor 3 regulates expression of genes encoding steroidogenic enzymes and key transcription factors in the Nile tilapia gonad[J]. Biol Reprod, 2012, 86(5): 163. https://pubmed.ncbi.nlm.nih.gov/22337331/
[30] ZOHAR Y, MUNOZ-CUETO J A, ELIZUR A, et al. Neuroendocrinology of reproduction in teleost fish[J]. Gen Comp Endocrinol, 2010, 165(3SI): 438-455. https://xueshu.baidu.com/usercenter/paper/show?paperid=5735a5560e413b37b3804de10b1aca8e&site=xueshu_se&hitarticle=1
[31] OKA Y. Three types of gonadotrophin-releasing hormone neurones and steroid-sensitive sexually dimorphic kisspeptin neurones in teleosts[J]. J Neuroendocrinol, 2009, 21(4): 334-338. doi: 10.1111/j.1365-2826.2009.01850.x
[32] KRIEGSFELD L J, MEI D F, BENTLEY G E, et al. Identification and characterization of a gonadotropin-inhibitory system in the brains of mammals[J]. Proc Natl Acad Sci USA, 2006, 103(7): 2410-2415. doi: 10.1073/pnas.0511003103
[33] KRIEGSFELD L J. Driving reproduction: rfamide peptides behind the wheel[J]. Horm Behav, 2006, 50(5): 655-666. doi: 10.1016/j.yhbeh.2006.06.004
[34] CHENG G L, COOLEN L M, PADMANABHAN V, et al. The kisspeptin/neurokinin B/dynorphin (KNDy) cell population of the arcuate nucleus: sex differences and effects of prenatal testosterone in sheep[J]. Endocrinology, 2010, 151(1): 301-311. doi: 10.1210/en.2009-0541
[35] KRAJEWSKI S J, BURKE M C, ANDERSON M J, et al. Forebrain projections of arcuate neurokinin B neurons demonstrated by anterograde tract-tracing and monosodium glutamate lesions in the rat[J]. Neuroscience, 2010, 166(2): 680-697. doi: 10.1016/j.neuroscience.2009.12.053
-
期刊类型引用(4)
1. 陶欣,邱丽华,张博,王鹏飞,闫路路,赵超,林云想,林锋. 花鲈igf3基因SNP位点的鉴定及其与生长性状的关联分析. 基因组学与应用生物学. 2024(01): 109-116 .  百度学术
百度学术
2. 张家荣,秦宏宇,谢婷,张效宇,李飞霞,吕俊贤,贾玉东. 大菱鲆类胰岛素生长因子3基因的克隆和表达分析. 渔业科学进展. 2024(02): 220-232 .  百度学术
百度学术
3. 黄婷,陈福艳,张彬,黎铭,林勇,李莉萍,童桂香,唐瞻杨,韦信贤,蒋伟添. 双棘黄姑鱼源致病发光杆菌的分离与鉴定. 西南农业学报. 2022(06): 1462-1469 .  百度学术
百度学术
4. 郑建波,贾永义,蔡李娜,顾志敏,刘士力,迟美丽,程顺. 翘嘴鲌胰岛素样生长因子igf3基因的克隆及表达分析. 水生生物学报. 2021(04): 734-740 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
